丹参川芎嗪对离体大鼠心肌缺血/再灌注损伤的保护作用
黄文东 杨艳芳 高 琦 李启森 朱邦豪▲
1.广东省茂名市人民医院药剂科,广东茂名 525000;2.广东省茂名市人民医院中心实验室,广东茂名 525000;3.中山大学中山医学院心脑血管研究中心,广东广州 510080
心肌缺血/再灌注(ischemia-reperfusion,I/R)造成的心肌可逆性或不可逆性的损伤是缺血性心脏病最严重的损伤类型,随着介入和溶栓技术的广泛应用,I/R导致损伤目前已成为心血管疾病防治领域的重要问题之一[1-3]。川芎嗪(Ligustrazine)是中药川芎的有效成分之一,有报道川芎嗪具有清除氧自由基抑制脂质过氧化,抑制细胞凋亡,保护心肌细胞,干扰炎症反应,保护心肌细胞等作用[4-5]。同时丹参素(Salvia miltiorrhiza)为唇形科植物丹参的干燥根及根茎的有效成分,主要用于治疗心血管疾病,如心绞痛、心肌梗死和中风[6],体内外研究表明,丹参素具有多种药理作用,包括舒张冠状动脉、抗凝、保护心肌缺血损伤、抗心律失常等[7-8]。目前丹参素和川芎嗪广泛应用于临床上,近年来出现了丹参川芎嗪注射液等复方制剂,课题组前期已研究丹参川芎嗪对大鼠在体心肌缺血/再灌注损伤具有保护作用[9],本实验主要通过构建大鼠离体模型,从离体的角度探讨丹参川芎嗪对离体心肌缺血/再灌注损伤的影响,为临床使用提供理论依据。
1 资料
1.1 一般资料
选用SPF级SD雄性大鼠55只,随机分为五组(n=11),空白对照组的体重(265.38±10.44)g,日龄(49.9±1.12)d,模型组的体重(267.72±11.21)g,日 龄(50.2±1.31)d,SLI高 剂 量 组 的 体 重(264.18±12.37)g,日龄(49.1±1.35)d,中剂量组的体重(265.27±11.95)g,日龄(49.8±1.45)d,低剂量组的体重(269.72±10.19)g,日龄(50.3±1.32)d,各组一般资料比较,差异无统计意义(P>0.05),具有可比性。购于广州中医药大学实验动物中心,生产许可证号:SCXK(粤)2013-0020。于中山大学中山医学院实验动物中心(合格证为粤监证字2012C012号)进行动物饲养及实验。
1.2 药品和试剂
丹参川芎嗪注射液(吉林四长制药有限公司,20170108)。肝素(500U/kg),河北常山生化;戊巴比妥钠,德国Merok公司生产;乳酸脱氢酶(LDH)、肌酸激酶(CK)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒,购于南京建成生物医学工程研究所。其他试剂购于广州市化学试剂厂。
1.3 主要仪器
PL202-S电子天平[梅特勒-托利多(上海)有限公司];BL-420S生物机能实验系统(成都泰盟);langendorff离体心脏灌流仪(澳洲ADI公司);高速冷冻离心机(Beckman,US);酶标仪(MJ Research,US);倒置显微镜(重庆光学仪器厂,CN)。
2 方法
2.1 实验分组
SD大鼠55只,随机分为五组(n=11),分别是空白对照组(Control)、模型组(Model)、SLI高剂量组(High)、中剂量组(Middle)、低剂量组(Low)。临用前将受试物溶于灌流液中,使高中低剂量组的终浓度分别为 2.5、1.25、0.625mL/L。
2.2 Langendorff离体心脏模型制备
2.2.1 Krebs-Henseleit(K-H)灌流液配方(mmol/L)[10]NaCl 118.0,KCl 4.7,MgSO4·7H2O 1.2,NaHCO325.0,KH2PO41.2,CaC122.5,葡萄糖 11.0,牛血清蛋白 0.25,PH7.4。
2.2.2 操作步骤 参考已发表文章[10-11]方法,SD大鼠腹腔注射肝素钠(50U/kg)行肝素化抗凝,15min后腹腔注射戊巴比妥钠(50mg/kg)麻醉后,开胸将心脏迅速取出,转移到4℃(K-H)灌流液的玻璃皿中,轻轻挤出残留血液,同时快速用线绳将主动脉固定于体外灌流的套管上。提前设定恒温循环器(37±0.5)℃,用 95%O2和 5%CO2混合气体饱的灌流液进行恒压灌流,灌注压为60mm Hg,在左心室内放置球囊连接压力传感器测定心室内压,用蛙心夹夹住心尖部和乳突部连接传感器检测心电图。模型组用正常灌流液灌注,平衡20min后,停止灌注20min,复灌60min。给药组分别在停灌前用含有2.5、1.25、0.625mL/L的灌流液灌注10min后,全心停灌20min,再灌注60min;空白对照组连续灌流100min。
2.3 监测指标
2.3.1 心功能参数 使用labchart生物信号采集仪器记录各组受试药物对左心室收缩压(LVSP)、左心室舒张压(LVEDP)、心率(HR)、左心室内压最大上升、下降速率(+dp/dtmax、-dp/dtmax)心功能指标的影响。
2.3.2 冠脉流量 人工测量离体心脏的冠脉流量(CF),分别收集缺血前及再灌后 15、30、60min时1min内的冠脉流出液,用量筒测量体积,单位以mL/min表示。
2.3.3 检测冠脉流出液中LDH、CK、SOD、MDA的活性 使用1.5mL离心管收集特定时间点的冠脉流出液,并快速置于-80℃冰箱冻存。待全部标本收集完成后再用相应的试剂盒测定目标检测物的生物活性。
2.3.4 HE染色切片观察心肌损伤情况 待离体心脏灌流结束后摘下大鼠心脏,并将心脏置于4%多聚甲醛的离心管固定3d,然后制成石蜡包埋切片,根据大鼠心肌纹路连续切5片,并进行HE染色,在倒置显微镜下观察相应组别的心肌情况。
2.4 统计学处理
采用SPSS13.0统计分析软件对数据进行统计分析,计量资料以(±s)表示,采用 t检验,两组以上变量比较采用方差分析,计数资料以[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
3 结果
3.1 大鼠离体心脏血流动力学影响
缺血/再灌注后各时间点检测结果显示,模型组的LVSP、HR、±dp/dtmax相较于空白组显著降低(P<0.05)。与模型组相比,SLI高剂量组的LVSP在 30min后明显升高(P=0.022);SLI高剂量组的LVEDP在缺血/再灌注30min后明显降低(P=0.003)。SLI高剂量组的±dp/dtmax在缺血/再灌注30min后明显升高,其中+dP/dtmax与模型组相比(P=0.019),-dP/dtmax与模型组相比(P=0.028),差异均有统计学意义(P<0.05)。缺血/再灌注30min后高剂量组的HR相较于模型组显著升高(P=0.005),差异均有统计学意义(P<0.01)。由此可知SLI能有效改善心肌缺血/再灌注损伤对心脏舒缩功能的抑制作用。见表1。
表1 SLI对缺血/再灌注心肌相关指标的影响(±s)
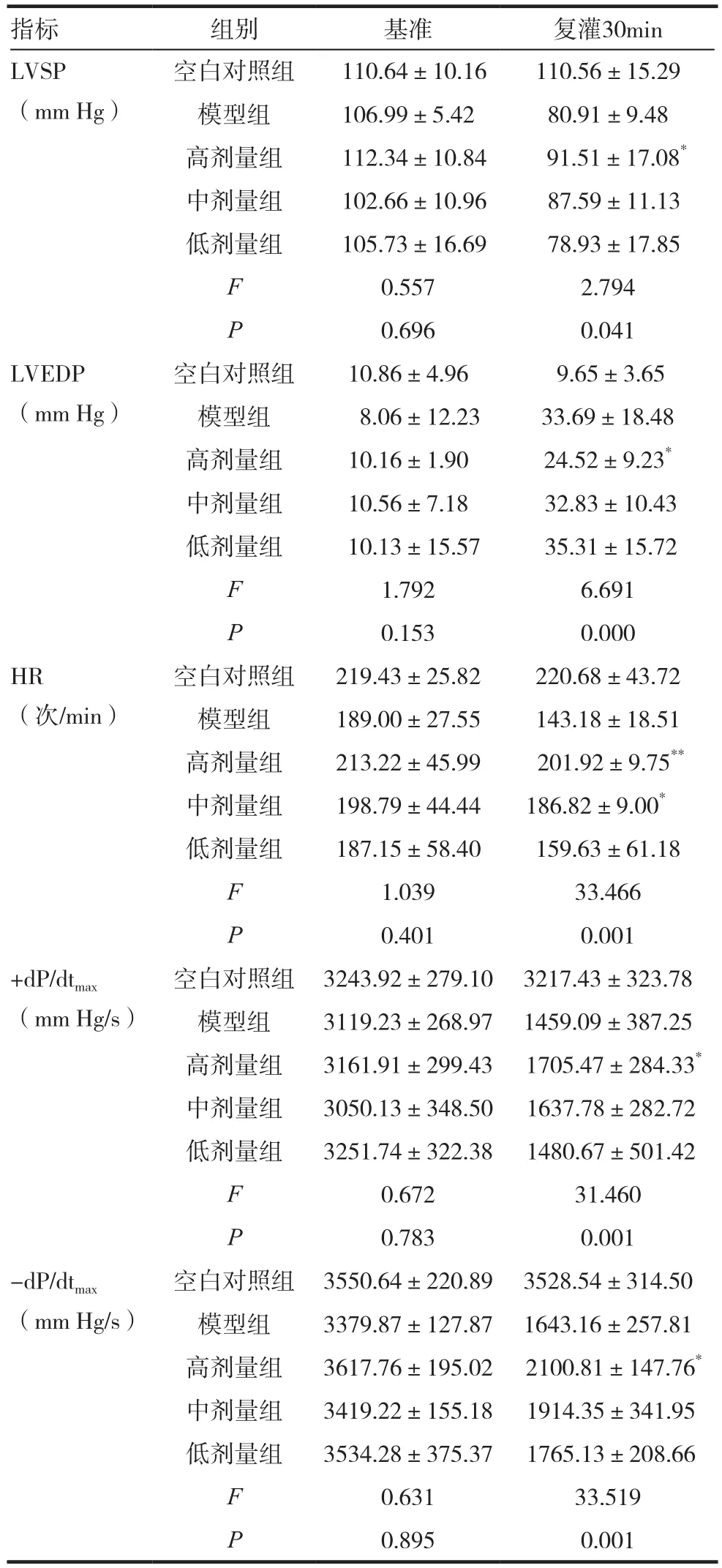
表1 SLI对缺血/再灌注心肌相关指标的影响(±s)
注:与模型组比较,*P<0.05,**P<0.01
指标 组别 基准 复灌30min LVSP(mm Hg)空白对照组 110.64±10.16 110.56±15.29模型组 106.99±5.42 80.91±9.48高剂量组 112.34±10.84 91.51±17.08*中剂量组 102.66±10.96 87.59±11.13低剂量组 105.73±16.69 78.93±17.85 F 0.557 2.794 P 0.696 0.041 LVEDP(mm Hg)空白对照组 10.86±4.96 9.65±3.65模型组 8.06±12.23 33.69±18.48高剂量组 10.16±1.90 24.52±9.23*中剂量组 10.56±7.18 32.83±10.43低剂量组 10.13±15.57 35.31±15.72 F 1.792 6.691 P 0.153 0.000 HR(次/min)空白对照组 219.43±25.82 220.68±43.72模型组 189.00±27.55 143.18±18.51高剂量组 213.22±45.99 201.92±9.75**中剂量组 198.79±44.44 186.82±9.00*低剂量组 187.15±58.40 159.63±61.18 F 1.039 33.466 P 0.401 0.001+dP/dtmax(mm Hg/s)空白对照组 3243.92±279.10 3217.43±323.78模型组 3119.23±268.97 1459.09±387.25高剂量组 3161.91±299.43 1705.47±284.33*中剂量组 3050.13±348.50 1637.78±282.72低剂量组 3251.74±322.38 1480.67±501.42 F 0.672 31.460 P 0.783 0.001-dP/dtmax(mm Hg/s)空白对照组 3550.64±220.89 3528.54±314.50模型组 3379.87±127.87 1643.16±257.81高剂量组 3617.76±195.02 2100.81±147.76*中剂量组 3419.22±155.18 1914.35±341.95低剂量组 3534.28±375.37 1765.13±208.66 F 0.631 33.519 P 0.895 0.001
3.2 冠脉流量的影响
在稳定灌流条件下,空白对照组前后的灌流量基本保持平稳,缺氧再复灌30min后,与模型组比较,高剂量组有显著性增加(P=0.001),差异有统计学意义(P<0.05),而中剂量和低剂量组差异无统计学意义(P>0.05),可知SLI能明显改善大鼠离体心脏灌流量。见表2。
表2 SLI对心肌梗死冠脉流量(CF)的影响(±s,mL/min)

表2 SLI对心肌梗死冠脉流量(CF)的影响(±s,mL/min)
注:与模型组比较,*P<0.05
?
3.3 灌脉流出液中LDH、CK、MDA、SOD的生物活性测定
各组在停灌前,LDH、CK、SOD、MDA含量值与空白对照组相比较均无差异,在缺血处理20min后,再灌注30min时,SLI高剂量组LDH与模型组相比较(P=0.029),CK 值与模型组相比较(P=0.015),差异有统计意义(P<0.05),中剂量组和低剂量组再灌注30min时,与模型组差异无统计学意义(P>0.05);缺血再灌注30min,高剂量组SOD值与模型组相比较(P=0.009);而再灌注30min的MDA值则明显降低(P=0.023)。结果显示SLI各剂量组均能抑制心肌细胞LDH释放,呈现出一定的量效关系。见表3。
3.4 HE染色光学显微镜研究SLI对心肌结构的影响
在显微镜下观察,正常组的心肌细胞着色均匀,心肌横纹肌排列整齐,胞膜完整,边界清晰;模型组心肌细胞着色不均,纤维排列紊乱,心肌有断裂,核裂解消失,部分区域水肿变性,心肌纤维间可见中性粒细胞浸润,部分心肌细胞坏死。见图1。
表3 SLI对大鼠心肌梗死LDH/CK/SOD和MDA的影响(±s)
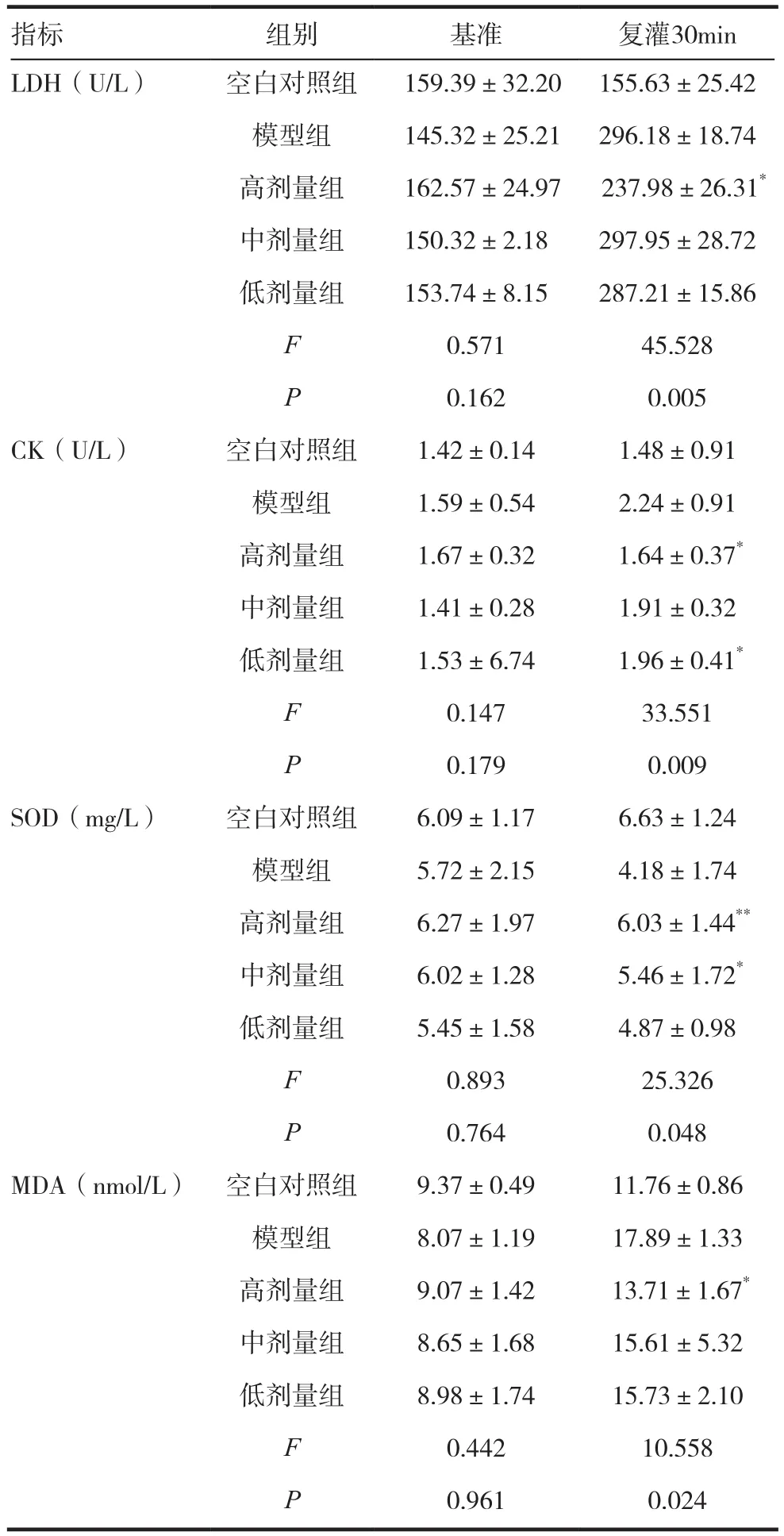
表3 SLI对大鼠心肌梗死LDH/CK/SOD和MDA的影响(±s)
注:与模型组比较,*P<0.05,**P<0.01
指标 组别 基准 复灌30min LDH(U/L) 空白对照组 159.39±32.20 155.63±25.42模型组 145.32±25.21 296.18±18.74高剂量组 162.57±24.97 237.98±26.31*中剂量组 150.32±2.18 297.95±28.72低剂量组 153.74±8.15 287.21±15.86 F 0.571 45.528 P 0.162 0.005 CK(U/L) 空白对照组 1.42±0.14 1.48±0.91模型组 1.59±0.54 2.24±0.91高剂量组 1.67±0.32 1.64±0.37*中剂量组 1.41±0.28 1.91±0.32低剂量组 1.53±6.74 1.96±0.41*F 0.147 33.551 P 0.179 0.009 SOD(mg/L) 空白对照组 6.09±1.17 6.63±1.24模型组 5.72±2.15 4.18±1.74高剂量组 6.27±1.97 6.03±1.44**中剂量组 6.02±1.28 5.46±1.72*低剂量组 5.45±1.58 4.87±0.98 F 0.893 25.326 P 0.764 0.048 MDA(nmol/L) 空白对照组 9.37±0.49 11.76±0.86模型组 8.07±1.19 17.89±1.33高剂量组 9.07±1.42 13.71±1.67*中剂量组 8.65±1.68 15.61±5.32低剂量组 8.98±1.74 15.73±2.10 F 0.442 10.558 P 0.961 0.024
4 讨论
心肌缺血/再灌注(I/R)损伤是指心肌缺血后再恢复血液供应,会引起心肌超微结构不可逆坏死现象。在心肌缺血再灌注过程中,虽然再灌注能够改善血液供应,但会引起心肌超微结构、功能、代谢及电生理方面发生进一步的损伤而导致病情恶化。目前的研究显示心肌缺血/再灌注损伤的机制与自由基增多、细胞内钙超载、微血管损伤等有关[12-14],心肌缺血再灌注过程中由于局部心肌缺血缺氧,在恢复灌注过程中氧气供应充足,产生大量的氧离子、氢氧根等,这些成分可能是引起心肌缺血/再灌注损伤的主要因素之一[15-16]。

图1 不同处理组心肌组织切片的HE染色结果图
本课题主要研究SLI对离体心脏模型的血流动力学以及心肌酶等指标的影响,结果表明SLI能通过影响血流动力学指标和心率,以提高心肌供氧量,改善心功能。通常胞质酶如AST、LDH和CK作为心肌缺血损伤的诊断标志物,在诱导细胞膜渗透或破裂时,从受损的心肌组织中泄漏到血液中[17-18]。因此,血清中AST、LDH和CK的活性能够反映膜完整性的改变和心肌损伤的程度。在本研究中,我们发现SLI剂量组依赖性地降低I/R损伤引起的LDH和CK水平升高,提示SLI可以抑制急性心肌缺血损伤的细胞膜损伤。
据报道,氧化应激是导致心肌损伤的主要原因[19-21]。过量的氧自由基导致脂质过氧化过程。SOD是机体清除氧自由基、减少自由基产生和心肌细胞H/R损伤的第一道防线。MDA是脂质过氧化的主要终产物,其浓度可以反映心肌损伤程度[22-23]。在我们的研究中,SLI不仅显著降低了MDA含量,而且增加了SOD酶活性。结果表明,SLI能增强清除氧化自由基的能力,至少在一定程度上能减少心肌损伤。
本实验HE染色显示,模型组心肌损伤引起心肌细胞膜损伤,心肌坏死、肌腱有断裂,纤维排列紊乱,核碎裂、消失,胞质红染,呈现不规则粗颗粒状,炎性细胞浸润,染色质凝结、胞质空泡和肌纤维丢失。SLI可消除心肌细胞膜损伤,偶尔出现肌纤维丢失和炎性细胞浸润,明显缩小坏死灶,明显减弱坏死程度。结果显示,SLI对缺血/再灌注的心肌组织具有的一定保护作用。
综上所述,我们的研究首次表明,SLI能减轻心肌再灌注所造成的损伤,主要是通过调节心肌酶对大鼠心肌I/R损伤具有显著的心肌保护作用,增强了清除氧化自由基的能力。

