豆豉返霜过程中基本理化特性及微生物多样性差异分析
朱敏方 张 露 叶云花 廖 卉
(1.江西师范大学国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.江西省淡水鱼高值化利用工程技术研究中心,江西 南昌 330022)
豆豉是中国的传统发酵豆制品,是大豆经过浸泡、蒸煮、摊凉、制曲、发酵等一系列工艺处理后制成的一种营养丰富、风味独特的调味副食品。豆豉中含有多种有益成分如大豆多肽、大豆异黄酮、大豆低聚糖、大豆皂苷、类黑精类、豆豉溶栓酶等[1]。国内外研究发现豆豉具有抗氧化[2-3]、降血糖[4]、降血压[5-7]、抗老年痴呆症[8]等多种保健功能。
稻香园豆豉是通过“沪酿3.042米曲霉”发酵制得,其传统发酵工艺中的洗曲仅洗掉了豆豉表面曲霉菌分生孢子和菌丝体,而基质菌丝可能继续生长引起返霜。经前期预试验模拟货架期豆豉储存条件(温度约为20 ℃,相对湿度约为50%),大约贮藏90 d时豆豉开始出现返霜;而通过恒温恒湿培养箱(温度37 ℃,相对湿度75%)进行加速返霜寿命试验,第5天就开始出现明显的返霜,且两者最终返霜豆豉在感官评价上是一致的。返霜后豆豉色泽上,表面由褐色变成白色,出现霜状颗粒;气味上,出现不符合豆豉香气的异味;黏度上,由外表微湿润不粘手转变为表面干燥或粘手。返霜极大地影响了外观,也会使消费者对返霜豆豉的营养安全性产生质疑。曾小飞[9]对返霜后豆豉表面白色物质进行涂布培养,发现细菌为引起豆豉返霜的主要微生物,其次为酵母菌和霉菌。但目前未见关于豆豉在返霜过程中基本营养成分和返霜前后微生物多样性差异的相关报道。
试验拟以豆豉为研究对象,对贮藏0,3,6,9,12,15,18,21 d 的豆豉进行取样测定水分、灰分、粗蛋白、粗脂肪、总糖、还原糖、总酸、氨基态氮含量,研究其基本成分变化规律;前期预试验测得贮藏前3 d豆豉的氨基酸含量变化不大,综合考虑选取贮藏0,6,15,21 d的豆豉进行氨基酸组成的测定,通过氨基酸评分对豆豉的蛋白质营养价值进行评价;通过Illumina Miseq测序分析豆豉返霜前后微生物群落多样性差异,为豆豉的加工储藏以及食用安全性提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
干豆豉(未添加面粉发酵):利用沪酿3.042米曲霉发酵制成,南昌稻香园调味品有限公司;
硫酸钾、五合水硫酸铜、氢氧化钠、浓硫酸、石油醚(沸程30~60 ℃)、甲醛溶液:天津市大茂化学试剂有限公司;
葡萄糖:上海阿拉丁生化科技股份有限公司;
DNS试剂:北京索莱宝生物科技有限公司;
各试剂如无特别说明均为分析纯。
1.1.2 主要仪器设备
高速中药粉碎机:DFY-500型,温岭市林大机械有限公司;
恒温恒湿培养箱:LRHS-200-A型,山东博科生物产业有限公司;
红外智能消化炉:SKD-08S2型,上海沛欧分析仪器有限公司;
自动凯氏定氮仪:SKD-800型,上海沛欧分析仪器有限公司;
电子分析天平:FA1104N型,上海丙林电子科技有限公司;
多参数测试仪:S220型,梅特勒—托利多仪器(上海)有限公司;
紫外分光光度计:N-2000型,日本日立公司;
氨基酸分析仪:L-8900型,日本Hitach公司;
PCR仪:GeneAmp®9700型,美国爱普拜斯公司。
1.2 方法
1.2.1 样品的制备 将适量豆豉样品平铺于37 ℃,湿度75%的恒温恒湿培养箱中进行返霜。前期预试验结果显示,从第5天开始豆豉表面长出白斑,出现返霜现象,第20天90%以上豆豉都出现返霜,因此选取试验周期为21 d,从0 d开始每隔3 d取一次样,共取样8次,取样时采取五点取样法进行取样后真空包装,于-80 ℃冻存备用。测定各理化指标时,将豆豉粉碎至无肉眼可见颗粒后进行测定。
1.2.2 水分及灰分百分比的测定 参照GB 5009.3—2016中的直接干燥法测定豆豉中水分百分比。参照GB 5009.4—2016测定豆豉中灰分百分比。
1.2.3 粗蛋白及粗脂肪百分比的测定 粗蛋白含量测定使用凯氏定氮法,具体操作参照GB 5009.5—2016;粗脂肪含量测定使用索氏抽提法,称取充分粉碎混匀后的试样3.500 g,移入滤纸筒中进行索氏抽提,具体操作参照GB 5009.6—2016,以上试验重复3次。
1.2.4 总酸和氨基态氮含量的测定 总酸含量测定使用pH电位法,具体参照GB/T 12456—2008;氨基态氮含量测定使用甲醛滴定法,具体操作参照GB 5009.235—2016,试验重复3次。
1.2.5 还原糖和总糖含量的测定 参照文献[10]。
1.2.6 氨基酸含量分析
(1)氨基酸含量测定:称取粉碎均匀的豆豉粉末0.5 g,加入8% TCA溶液,充分混匀后47 ℃超声提取1 h,20 000 r/min离心30 min,取5 mL上清液用8%的TCA溶液定容后,20 000 r /min离心30 min,取2 mL滤液,蒸干后加入2 mL 6 mol/L盐酸溶液,抽真空后置于110 ℃的环境中水解24 h,过滤后蒸干,加入2 mL 0.02 mol/L 盐酸溶液溶解,用活性炭柱对溶液脱色后再经0.22 μm滤膜过滤后上机测定[11-12]。
(2)营养评价:将所测得的豆豉中必需氨基酸含量换算成每克蛋白质中含氨基酸的毫克数,按式(1)、(2)计算氨基酸评分(AAS)和必需氨基酸指数(EAAI)[13]。
(1)
式中:
n——比较的氨基酸数;
m1——试验蛋白质的氨基酸含量,mg/g;
m2——鸡蛋蛋白质的氨基酸含量,mg/g。
(2)
式中:
m3——试验蛋白质的氨基酸含量,mg/g;
m4——FAO/WHO模式中氨基酸含量,mg/g。
1.2.7 微生物分析
(1)DNA抽提和PCR扩增:总DNA抽提通过使用E.Z.N.A.®soil试剂盒进行,使用微量紫外分光光度计检测抽提出的DNA浓度和纯度,同时对DNA提取质量进行检测;细菌采用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3-V4可变区进行PCR扩增,真菌基因组DNA采用真菌通用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′),扩增程序为95 ℃预变性3 min,27个循环(95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol dNTPs,0.8 μL 5 μmol 引物,0.4 μL FastPfu 聚合酶;10 ng DNA模板。
(2)Miseq高通量测序:PCR产物通过2%琼脂糖凝胶回收,利用AxyPrep DNA凝胶回收试剂盒(Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测并利用QuantiFluorTM-ST蓝色荧光定量系统(Promega, USA)进行检测定量后根据Illumina MiSeq平台(Illumina, San Diego, USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库后进行测序。
(3)生物信息分析:基于上海美吉生物医药科技有限公司旗下I-Sanger生信云平台(https://www.isanger.com/index.html)进行所有的生物信息分析。
1.3 数据处理
所有试验均重复3遍,采用Origin 8.6进行作图,SPSS 22.0软件分析数据间的显著性差异,P<0.05则认为样品间具有显著性差异。
2 结果与分析
2.1 返霜过程中基本理化特性变化
返霜过程中豆豉水分和灰分的含量变化如图1(a)所示,在试验范围内豆豉水分含量呈现先上升后逐渐稳定的趋势,在第9天达到最大值(19.38%)。贮藏9 d后豆豉水分含量略有下降,但基本保持稳定,可能与微生物在代谢过程中消耗了水分和产生的生物热有关[14]。豆豉在贮藏过程中灰分含量变化较小,可能是因为在返霜过程中,微生物代谢产物积累的程度略有不同[10]。
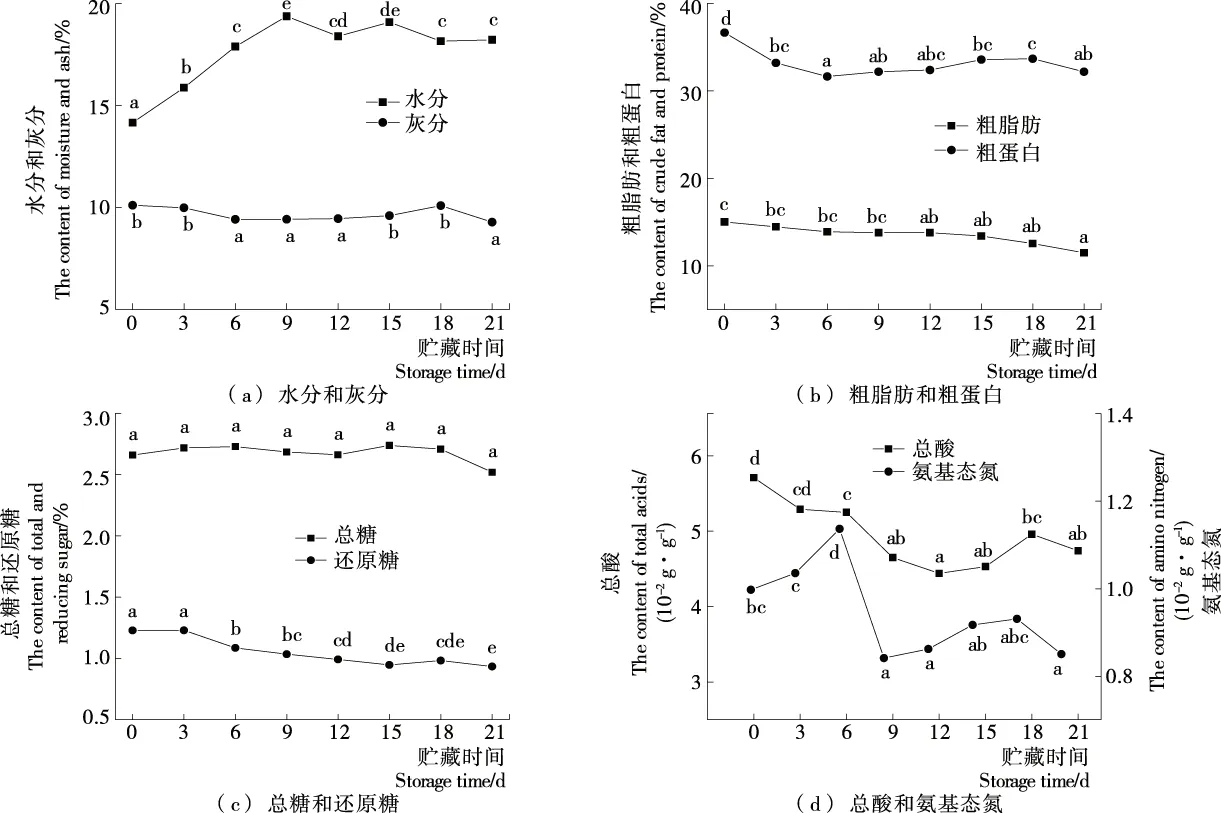
字母不同表示组间具有显著性差异(P<0.05)
返霜过程中豆豉粗脂肪和粗蛋白的含量变化如图1(b)所示,在试验范围内豆豉的粗脂肪含量逐渐下降,第21天时粗脂肪含量由最初的15.01%降至11.48%。粗蛋白含量也整体呈下降趋势且前6 d变化显著,之后粗蛋白含量为32.18%~33.67%。蛋白质含量整体下降的原因可能是返霜过程中微生物代谢产生相关的酶,将蛋白质分解为氨基酸供自身代谢所用。
由图1(c)可知,在试验范围内豆豉各阶段的总糖含量都无显著性差异。这是因为出厂前的灭酶处理使糖化酶失活,抑制了淀粉的分解。还原糖含量在返霜期间呈下降趋势,到第21天时由最初的1.23%降至0.93%,这是由微生物代谢导致的[10]。
返霜过程中豆豉总酸和游离氨基态氮含量变化如图1(d)所示,在返霜前期豆豉的总酸含量降低,是由于培养湿度过大,豆豉吸收空气中水分导致本身水分含量升高,酸度下降。贮藏12~21 d时酸度略有升高,可能是微生物代谢产生了有机酸。贮藏0~6 d时豆豉中氨基态氮含量上升,与粗蛋白含量变化趋势相反,说明蛋白质不断被微生物分解为氨基酸。
2.2 氨基酸含量分析
由表1可知,除色氨酸未测定外(由于测定氨基酸含量时采用酸水解法,会破坏色氨酸),共检测到17种氨基酸。返霜过程中豆豉的氨基酸含量为229.624~251.379 mg/g。其中必需氨基酸总量由第0天的97.19 mg/g 降低至第21天的88.21 mg/g,非必需氨基酸由154.19 mg/g减少至141.42 mg/g。但是,必需氨基酸占总氨基酸的比例(EAA/TAA)以及非必需氨基酸占总氨基酸的比例(EAA/TAA)均变化不大,说明豆豉返霜过程中各氨基酸含量均匀减少。贮藏21 d时豆豉中鲜味氨基酸(Asp、Thr、Ser、Glu、Gly、Ala)和苦味氨基酸占总氨基酸的比例相比于0 d时均变化不大。贮藏15 d时各氨基酸含量有所回升,可能是后期微生物分解蛋白质产生氨基酸的含量大于其代谢所消耗的氨基酸含量。
2.3 必需氨基酸组成评价
食物蛋白质的营养价值评价,不仅要考虑其必需氨基酸含量,同时还要考虑必需氨基酸之间的比例要与人体必需氨基酸含量模式是否接近[15]。由表2可知,未返霜豆豉中亮氨酸、苯丙氨酸+酪氨酸含量高于FAO/WHO模式,其余必需氨基酸含量均低于FAO/WHO模式。贮藏6,15,21 d的豆豉中所有必需氨基酸含量均低于FAO/WHO模式,且均低于贮藏0 d时的,说明返霜会导致豆豉中各必需氨基酸的流失,与氨基酸含量变化的结果一致。
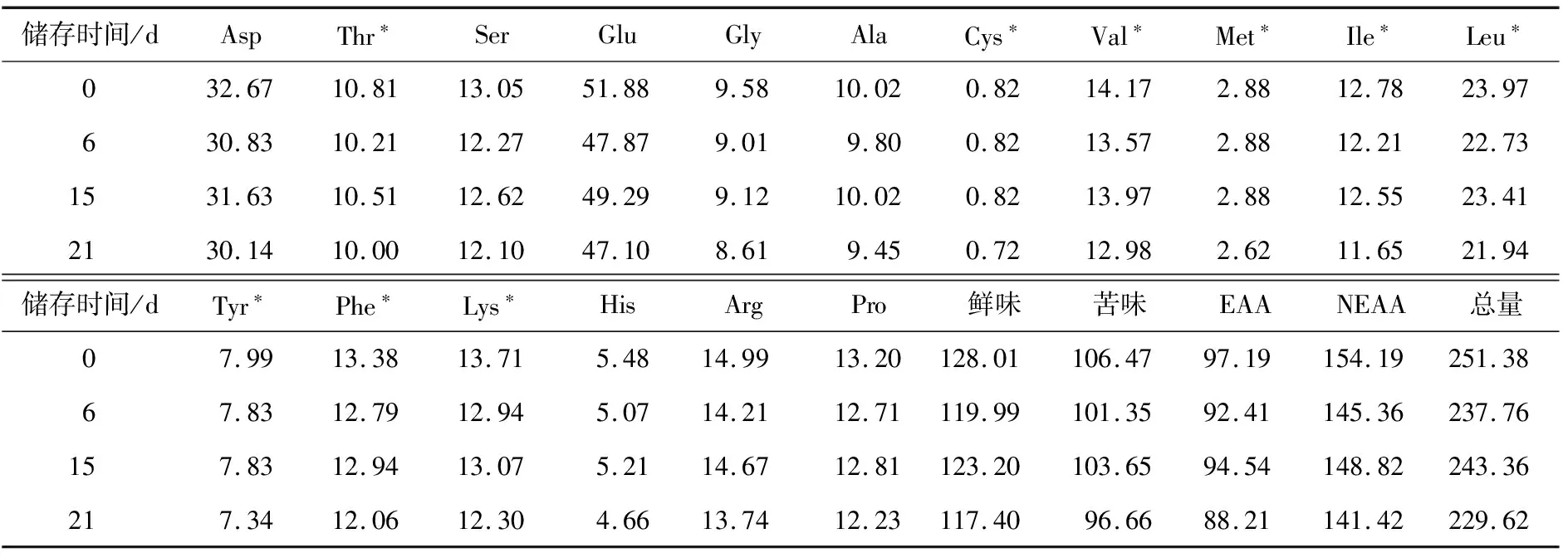
表1 豆豉储存过程中不同样品氨基酸含量的变化†
† “*”代表必需氨基酸,“EAA”代表必需氨基酸含量,“NEAA”代表非必需氨基酸含量,“TAA”代表总氨基酸含量。
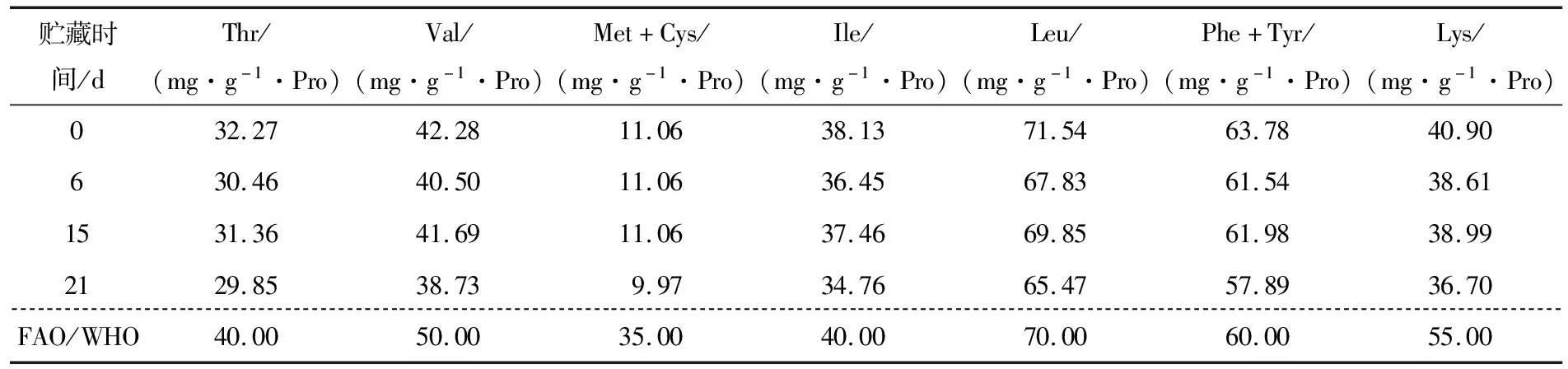
表2 返霜过程中豆豉必需氨基酸组成变化
氨基酸评分越高,其蛋白质营养价值越高,当氨基酸评分越接近100,说明其蛋白质氨基酸组成与FAO/WHO模式氨基酸组成一致[15-16]。由表3可知,豆豉在返霜过程中第一限制氨基酸为甲硫氨酸+半胱氨酸,第二限制氨基酸为赖氨酸。氨基酸评分最高的是苯丙氨酸+酪氨酸,贮藏0,9,15,21 d的必需氨基酸指数(EAAI)分别为77.47,74.33,75.69,70.32。
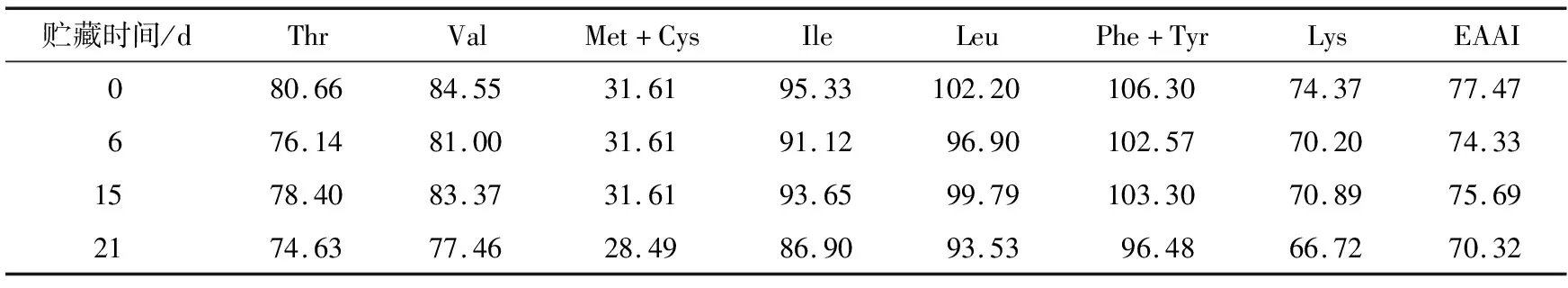
表3 返霜过程中豆豉氨基酸评分表
2.4 返霜前后微生物组成差异分析
2.4.1 OTU及其丰度分析 为研究各样本的物种组成,对所有样本的有效Tags,以97%的一致性进行可操作分类单元(Operational Taxonomic Units,OTUs)聚类,然后对OTUs的代表序列进行物种注释。贮藏0 d豆豉样品(Y)与贮藏21 d后的返霜豆豉样品(F)共得到细菌及真菌的有效序列分别为112 334,142 460个,经聚类分析后得到返霜前后细菌OTUs分别是365和267,真菌OTUs分别是122和111。由图2可知,返霜前后豆豉细菌共有OTU数为226个,约占总OTU数的35.76%;而真菌共有OTU数为41个,占总OTU数的17.60%。后续数据分析,以最小样本序列数对原始OTU数据进行抽平后再进行分析。
稀释曲线趋于平缓,说明测序数据量合理,再增加测序量已不太可能检测到新的微生物种属,同时微生物的多样性已经不再有显著变化[17]。由图3可知,无论是细菌还是真菌样品的稀释曲线随测序数据量的增加,逐渐趋于平缓,说明本次测序数据量合理。
2.4.2 返霜前后微生物多样性变化 返霜前后豆豉样品微生物多样性系数如表4所示。返霜后,细菌的Sobs、Chao、Ace和Shannon指数均低于原样,说明随着返霜的进行豆豉样品的细菌物种丰富度降低;真菌Ace、Chao、Shannon指数增加以及Simpson指数的减少,说明返霜后豆豉的真菌物种丰富度增加。

图2 豆豉返霜前后细菌和真菌OTU数目的差异
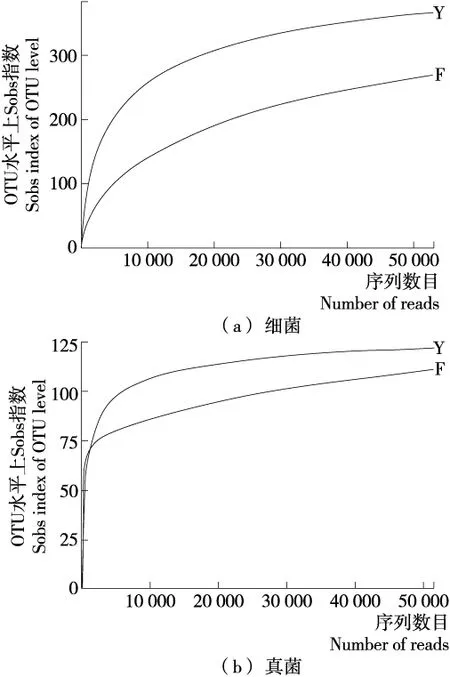
图3 细菌和真菌稀释曲线图
2.4.3 物种注释 由图4(a)可知,返霜前后豆豉样品中细菌主要由厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)组成,且返霜后拟杆菌门比例下降。由图5(a)、(b)可知,返霜后芽孢杆菌属(Bacillus)占比由68.95%增加至85.54%,还含有0.04%的乳酸杆菌属(Lactobacillus)、0.24%的埃希氏菌—志贺氏菌属(Escherichia-Shigella)、0.50%的unclassified_f_Peptostreptococcaceae、5.46%的Lentibacillus以及4.82%的others(others代表丰度小于0.01的菌属集合,可以忽略不计)。相比于返霜前,除norank_f_Bacillaceae占比基本没有变化外,其他细菌含量占比均降低,说明返霜有利于芽孢杆菌属微生物的繁殖且芽孢杆菌属在返霜前后均占绝对优势。
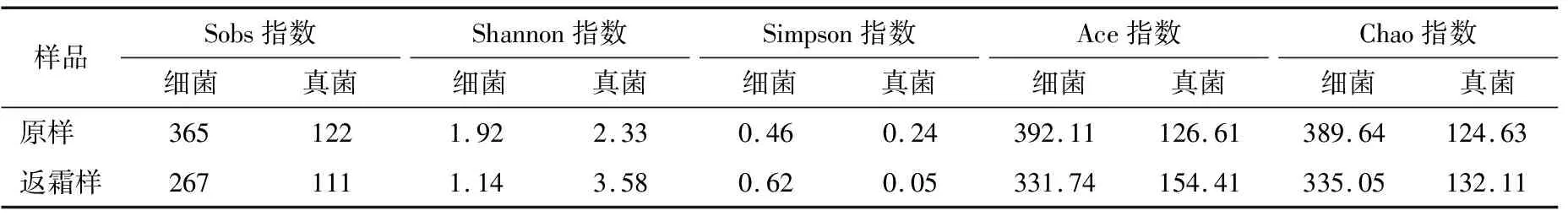
表4 返霜前后豆豉OTU水平Alpha多样性统计表
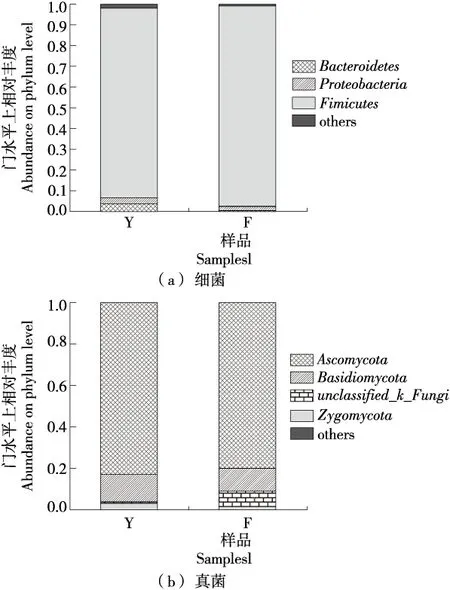
图4 返霜前后豆豉细菌和真菌门的水平分布柱形图
由图4(b)可知,豆豉真菌组成主要为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、Uclassified_k_Fungi,返霜后Uclassified_k_Fungi比例上升而担子菌门比例下降。由图5(c)、(d)可知,曲霉属(Aspergillus)变化最大,其占比由66.28%下降至25.40%。返霜前豆豉真菌组成主要是曲霉属、毛孢子菌属(Thrichosporon)、Unclassified_f_norank、隐球菌属(Cryptococcus)、根毛霉属(Rhizomucor)、横梗霉属(Lichtheimia)以及others等。返霜后含量>5%的真菌除了曲霉属外还有热子囊菌属(Thermoascus)、Unclassi-fied_f_Davidiellaceae、Unclassified_f_Fungi、Purpureocillium、镰胞菌属(Fusarium)。返霜后豆豉样品出现镰胞菌属、炭疽菌属(Colletotrichum)、链格孢属(Alternaria)等植物病原菌,存在一定的食品安全问题。镰胞菌属是一类包含许多强破坏性的植物致病真菌且分布广泛的丝状真菌,大都能够产生一些有毒的次生代谢产物,其中真菌毒素就是一种对脊椎动物有毒害作用的次生代谢产物[18]。链格孢属真菌是一类在许多果蔬中均有报道的优势潜伏侵染菌,能够引起果蔬腐烂,同时还是一种条件致病菌能够引起角膜炎、口腔溃疡、哮喘、皮肤链格孢病等多种疾病[19]。
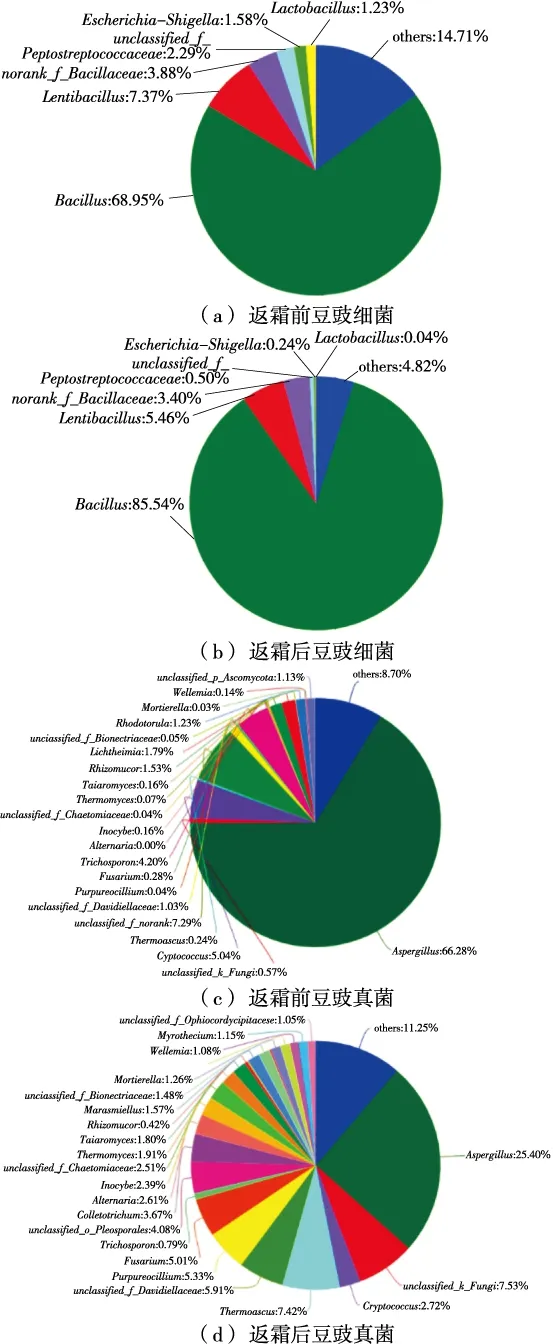
图5 返霜前后豆豉细菌和真菌属的水平分布饼图
3 结论
试验结果表明,返霜过程中豆豉的基本营养成分不断流失。返霜后豆豉蛋白质营养价值降低,细菌物种丰富度减少而真菌物种丰富度增加,且出现植物病原属如镰胞菌属、炭疽菌属、链格孢属等。因此,豆豉在贮藏过程中应尽可能避免高温、阳光直射以及潮湿的环境,同时可以考虑采用真空包装以及充入惰性气体的包装方式。试验虽对豆豉返霜过程中各理化指标、氨基酸含量变化和返霜前后微生物多样性差异进行了研究,但豆豉营养成分与微生物多样性变化之间的相关性,尤其是与优势微生物变化的相关性还有待进一步研究,有效抑制返霜的方法也有待探索。

