草鱼鱼油微胶囊芯材释放条件及缓释特性研究
刘晓丽 魏长庆 夏文水
(1.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122;3.江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122;4.石河子大学新疆植物药资源利用教育部重点实验室,新疆 石河子 832003;5.石河子大学食品学院,新疆 石河子 832003)
淡水鱼鱼腹中富含亚麻酸、二十二碳六烯酸(DHA)、亚油酸、二十碳五烯酸(EPA)、花生四烯酸等人体所需必需脂肪酸,研究[1-3]表明这些必需脂肪酸具有降低血清胆固醇含量、提高视力、抗肿瘤、免疫调节等功能。但在加工、贮藏和运输过程中,一部分多不饱和脂肪酸容易发生氧化酸败,不仅造成产品营养成分含量降低,还会产生具有刺激气味的酮类、醛类等物质,进一步降低产品营养价值[4-5],鱼油氧化产生的自由基等甚至会诱发诸如脑溢血、高血压等疾病[6]。利用多糖及蛋白包裹鱼油形成微胶囊技术,可以阻隔鱼油与空气的接触,达到保护芯材的目的,从而提高鱼油贮藏稳定性,拓展鱼油在生产和加工中的应用范围[7-8]。
常见的微胶囊芯材释放动力学模型有零级[9-10]、一级释放动力学方程[11-12]、Avrami’s模型、Higuchi模型[13-15]等。在实际贮藏过程中,芯材的释放受温度、湿度、光照、pH等诸多因素的影响,因此大部分芯材释放动力学模型为几种动力学的综合。Solomon等[16]研究发现香茅油微胶囊在贮藏10 h后,有70%的释放量,可控制释放过程;刘斯博等[17]研究表明亚麻籽油微胶囊具有较好的耐高温性,但受湿度的影响较显著。
目前国内外的研究[5,18-19]主要集中于微胶囊的制备工艺、理化性能,以及针对微胶囊芯材的释放过程,有关鱼油微胶囊释放动力学的研究却鲜有报道。试验拟利用壳聚糖和大豆分离蛋白为壁材,草鱼鱼油为芯材,在前期制备出鱼油微胶囊的基础上,应用Avrami’s公式对微胶囊在不同贮藏条件下芯材的释放率进行拟合,同时对释放动力学、释放速率常数和释放机制参数进行分析;研究体外模拟消化道环境对微胶囊芯材的缓释行为和粒径大小的影响,以期为鱼油微胶囊的贮藏与加工提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
草鱼鱼油:实验室精制;
壳聚糖(CTS):40 kDa,脱乙酰度80%~90%,BR级,实验室自制;
大豆分离蛋白(SPI):BR级,源叶生物科技股份有限公司;
胃蛋白酶(>250 U/mg)、胰蛋白酶(3 000~3 500 U/g):北京索莱宝科技有限公司;
其余试剂均为国产分析纯。
1.1.2 仪器与设备
高速剪切机:Ultraturrax T-10b型,德国IKA公司;
电子精密天平:JB5374-91型,美国Mettler Toledo公司;
pH计:FE20K型,美国 Mettler Toledo公司;
数控超声波清洗器:KQ-500 DE型,昆山舒美超声仪器有限公司;
粒度仪:NanoBrook Omni型,美国布鲁克海文有限公司;
喷雾干燥机:GZ-5型,无锡市阳光干燥设备厂;
粒度仪:NanoBrook Omni型,美国布鲁克海文有限公司;
恒温恒湿培养箱:SPX-80B,北京市恒诺利兴科技有限公司;
喷雾干燥机:GZ-5型,无锡市阳光干燥设备厂。
1.2 方法
1.2.1 鱼油微胶囊的制备 根据前期[20]制备方法,将一定量的溶于1%醋酸溶液的CTS、SPI溶液与鱼油混匀后,6 000 r/min剪切乳化5 min,调pH至6.5,40 ℃下超声均质10 min,在加入谷氨酰胺转氨酶(18 U/g SPI)固定化的同时低速搅拌1 h,静置分层,过滤,喷雾干燥,得鱼油微胶囊产品[19-20]。其中,芯材与壁材(质量比)1∶2,包埋率77%,得率80%。
1.2.2 不同贮藏条件下的释放行为 每3 d取适量样品计算芯材保留率,采用Avrami’s公式进行拟合,建立微胶囊释放动力学模型,分析不同贮藏条件下芯材的释放规律。
(1)贮藏温度:恒温恒湿培养箱相对湿度32%、光照强度0 lx,将样品分别置于4,25,35,50 ℃特定温度下贮藏21 d。
(2)相对湿度:恒温恒湿培养箱光照强度0 lx、温度4 ℃,将样品分别置于32%,54%,76%,92%相对湿度下贮藏21 d。
(3)光照强度:恒温恒湿培养箱温度4 ℃、相对湿度32%,将样品分别置于0,4 000,6 000,10 000 lx光照强度下贮藏21 d。
1.2.3 保留率及释放率计算 分别按式(1)、(2)计算芯材保留率及释放率。
(1)
r=1-R1,
(2)
式中:
R1——保留率,%;
Q1——总油含量,g;
Q0——即时表面含油量,g;
Q2——表面含油量,g;
r——释放率,%。
1.2.4 释放动力学模型 Avrami’s公式如式(3)所示。
R2=exp[-(kt)n],
(3)
式中:
R2——释放率,%;
k——释放速率常数;
t——贮藏时间,d;
n——释放机制参数。
对式(3)取两次对数得:
ln(-lnR2)=n(lnk+lnt)。
(4)
以lnt、ln(-lnR2)分别为横、纵坐标拟合方程,从而求解出n和k值。
1.2.5 体外模拟人体消化道环境对鱼油微胶囊芯材释放的影响
(1)人体口腔唾液(SOS):参照刘斯博等[17]的方法配制SOS溶液。
(2)胃液(SGF):分别准确称取0.32 g胃蛋白酶和0.2 g 氯化钠,加入100 mL水溶解后,调节pH至2.0,配制成SGF溶液。
(3)肠液(SIF):分别称取1.0 g胰蛋白酶和0.68 g磷酸氢二钾,加入100 mL水溶解后,调节pH至6.8,配制成SIF溶液。
将鱼油微胶囊样品依次置于现配的SOS(0~10 min)、SGF(10~120 min)和SIF(120~270 min)中,(37±1)℃下水浴并以100 r/min搅拌一定时间,模拟人体消化道的消化功能,测量不同时间下的芯材保留率。
1.2.6 微胶囊粒径变化 将体外模拟人体消化道试验过程中不同时间点的样品置于水中分散均匀后,用粒度仪测定样品粒径分布,并分析其变化。
1.2.7 数据处理 所有试验数据均为3次测定的平均值,采用SPSS 18.0软件对试验数据进行多重比较及差异显著性检验分析,利用Origin 8.5软件作图。
2 结果与分析
2.1 贮藏温度对芯材保留率的影响
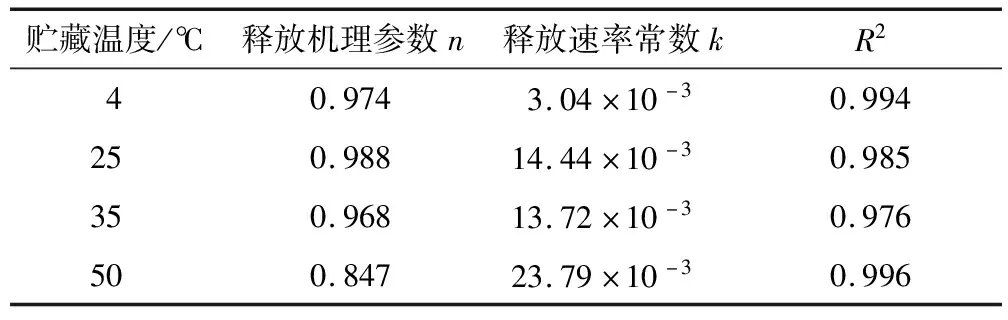
由图1可知,芯材保留率随贮藏时间的增加逐渐下降;同一时间下,贮藏温度越高,芯材保留率越低。4 ℃下贮藏21 d可达93%的芯材保留率,而50 ℃下贮藏21 d后,有大部分芯材被释放,保留率降至58%,且显著低于25,35 ℃下的(P<0.05)。相同条件下,芯材保留率随贮藏时间的延长逐渐降低,是因为较高的温度下,壁材膨胀使其所形成的保护结构被破坏,囊膜孔径增大、通透性增强,甚至出现裂缝,对芯材的阻力变小,使芯材加速逸出和释放[21-22];另一方面,高温环境能促使芯材分子加速运动,使其动能增大,加快芯材的释放速率[23]。因此,高温会对芯材、壁材都造成影响,样品应尽量贮藏在温度较低的环境中。
由表1可知,R2>0.97说明拟合性较好,可对其释放规律进行较好的解释[24];释放机理参数n<1,表明该释放过程介于扩散限制动力学与一级动力学之间;k值随贮藏温度的增加而显著增加(P<0.05)。综上可知,鱼油微胶囊的释放为非稳态的动力学过程,贮藏温度对鱼油微胶囊芯材保留率具有显著影响(P<0.05),4 ℃下贮藏可以有效阻止或延缓其释放。

图1 鱼油微胶囊在不同贮藏温度下的芯材保留率及Avrami’s回归分析
Figure 1 Core material retention and Avrami’s regression analysis of fish oil microcapsules at different storage temperatures
表1 不同贮藏温度下的芯材释放机理参数及释放速率常数
Table 1 Release mechanism parameters and release rate constants at different storage temperatures
贮藏温度/℃释放机理参数n释放速率常数kR240.9743.04×10-30.994250.98814.44×10-30.985350.96813.72×10-30.976500.84723.79×10-30.996
2.2 相对湿度对芯材保留率的影响
由图2可知,芯材保留率随相对湿度和贮藏时间的增加而大幅下降,相对湿度92%下贮藏21 d后,鱼油微胶囊芯材保留率仅为47%,显著低于相对湿度34%下的(P<0.05)。
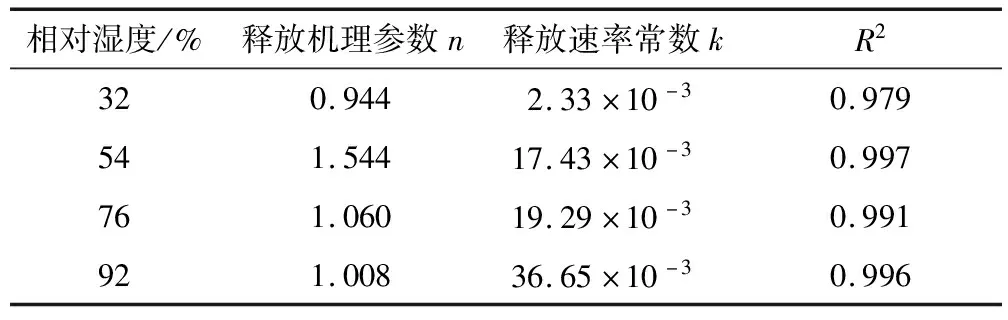
由表2可知,R2>0.97说明拟合程度较好;k值随相对湿度的增加而增加;n>1(相对湿度32%除外)说明该释放过程超过一级反应动力学参数。因此,当环境中相对湿度增加,水分子在使壁材发生吸水的同时,还可以通过微胶囊表面进入其内部,使膜渗透性、机械强度、致密度等下降,进一步加快芯材释放速度[25],故贮藏环境应尽量保持低相对湿度。
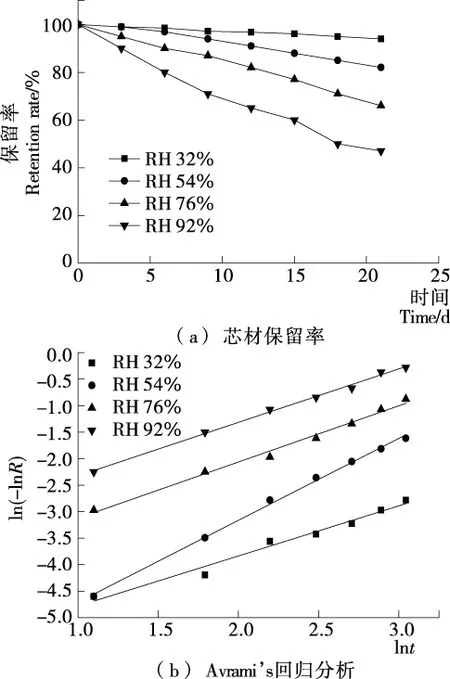
图2 鱼油微胶囊在不同相对湿度下的芯材保留率和Avrami’s回归分析
Figure 2 Core material retention and Avrami’s regression analysis of fish oil microcapsules at different storage humidity
表2 不同相对湿度下的芯材释放机理参数及释放速率常数
Table 2 Release mechanism parameters and release rate constants at different storage humidity
相对湿度/%释放机理参数n释放速率常数kR2320.9442.33×10-30.979541.54417.43×10-30.997761.06019.29×10-30.991921.00836.65×10-30.996
2.3 光照强度对芯材保留率的影响
由图3可知,芯材保留率随光照强度和贮藏时间的增加逐渐下降,说明光照强度可促使鱼油中游离基的产生,进一步发生自由基链反应[26]。
由表3可知,R2>0.98说明拟合程度较好;k值随光照强度的增加逐渐增加;n>1说明该释放过程超过一级反应动力学参数,故应尽量避光贮藏鱼油微胶囊。
2.4 体外模拟人体消化道环境对芯材释放的影响
由图4可知,样品在SOS、SGF和SIF模拟体外试验中表现出了良好的缓释及控制释放行为。0~10 min为模拟口腔释放过程,其释放率仅为4.7%,大部分进入下一阶段中释放;10~120 min在SGF的酸性环境中缓慢释放,120 min时的释放率仅为22.9%,可能是壳聚糖与大豆分离蛋白所形成的壁材具有较好的机械强度,模拟体外口腔消化液及胃液对壁材的消化能力有限,只有一部分多糖被消化,因此无法完全破坏壁材使芯材完全释放出来[26-27]。120 min后进入SIF溶液中,芯材释放率明显增加,270 min时释放率达80.6%,说明碱性环境的改变和胰蛋白酶的分解作用同时破坏了多糖和蛋白质之间的相互交联,打破了共价键,进一步溶解蛋白,使微胶囊骨架结构的致密度降低、快速降解,甚至在壁材表面出现一定的空隙,使芯材逐渐释放扩散[28]。因此,大豆分离蛋白和壳聚糖复合壁材具有较强的抗消化能力,可以使微胶囊中的芯材在整个模拟体外消化道环境防止芯材立即释放,起到缓释作用[29]。
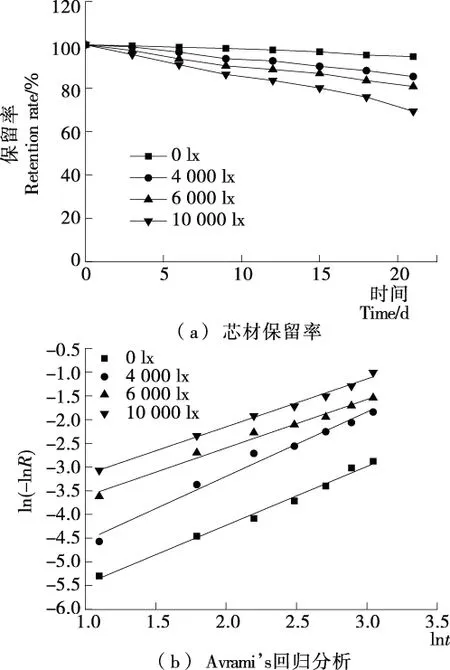
图3 鱼油微胶囊在不同光照强度下的芯材保留率和Avrami’s回归分析
Figure 3 Core material retention and Avrami’s regression analysis of fish oil microcapsules at different light intensities
表3 不同光照强度下的芯材放机理参数及释放速率常数
Table 3 Release mechanism parameters and release rate constants at different light intensities

光照强度/lx释放机理参数n释放速率常数kR201.2404.47×10-30.99240001.35710.64×10-30.98360001.02212.83×10-30.986100001.01016.06×10-30.993
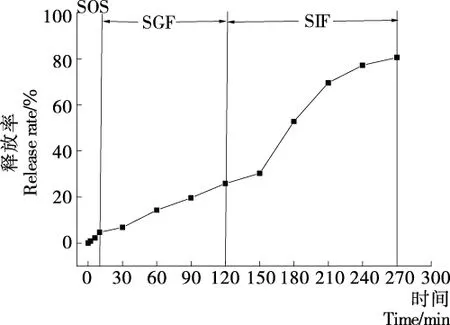
图4 鱼油微胶囊在SOS、SGF及SIF中芯材的释放率
2.5 体外模拟人体消化道环境中微胶囊粒径的变化
由图5可知,0~120 min,平均粒径由15.82 μm减小至5.67 μm,减少了64%,而此时的芯材释放率仅为22.9%;120~270 min平均粒径减小至2.98 μm。当微胶囊在SGF溶液中时,虽然壁材在胃蛋白酶及酸性环境的作用下逐渐溶解,但整个结构仍然保持完整,芯材不能立即释放,起到缓释作用;而当微胶囊进入SIF溶液中时,由于环境的改变使得壁材结构快速瓦解,最终有80.6%的芯材被释放。
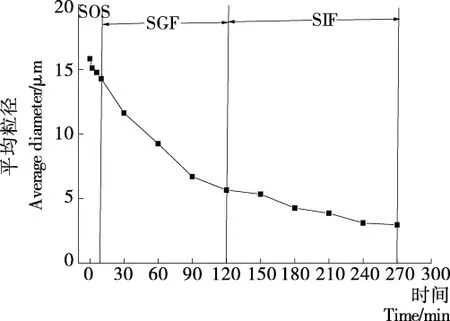
图5 鱼油微胶囊在SOS、SGF及SIF环境中的平均粒径
3 结论
在前期研究的基础上,对通过复合壁材制备的鱼油微胶囊产品在不同贮藏温度、相对湿度和光照强度下芯材的释放性能进行测定,并采用Avrami’s公式进行拟合,其中R2>0.97,说明拟合程度良好。通过分析释放机制参数和释放速率常数,明确了不同贮藏条件下的释放类型:当贮藏温度4~50 ℃,相对湿度34%时,n<1,说明介于扩散限制动力学和一级释放动力学之间;当相对湿度54%~92%,光照强度0~10 000 lx时,n>1,说明属于一级释放动力学。通过对模拟消化道中的释放情况进行研究发现,经270 min后,微胶囊释放率达80.6%,表明微胶囊在模拟消化道中有缓释行为,而微胶囊相应的粒径从起始的15.82 μm经模拟消化道环境后减小至2.98 μm,表明该种微胶囊产品能够顺应人体肠道的消化吸收功能。体外模拟试验中对于壁材的耐酸性要求更高,后期可复配一些耐酸的物质达到更好的缓释效果。

