新型高倍二肽甜味剂的制备与表征
穆小青 晏日安 谭奇坤 胡 晶 周 华
(暨南大学食品科学与工程系,广东 广州 510632)
阿斯巴甜是由James Schlatter于1965年在研究一种四肽促胃液分泌激素的过程中偶然发现得到的[1]。作为第一代二肽甜味剂,阿斯巴甜具有口感好、热量低、易制备等优点。但由于在一定使用条件下阿斯巴甜的稳定性较差,且分解后产生苯丙氨酸,苯丙酮尿症患者不宜食用,因而限制了其使用范围[2]。为了提高二肽甜味剂的稳定性和甜度,使其更适于消费者生理需求和食品加工要求,研究者们对阿斯巴甜的苯丙氨酸或天冬氨酸进行了结构修饰,得到的二肽甜味剂有良好的稳定性。目前关于阿斯巴甜衍生物的研究较为广泛,已经合成阿力甜[3]、纽甜[4]、爱德万甜[5]等多种二肽甜味剂。其中,应用最多的是纽甜(图1),化学名为N-[N-(3,3-二甲基丁基)-L-α-天冬氨酰]-1-甲酯,其甜度约为蔗糖的8 000倍,摄入人体后不会被分解为单个氨基酸,苯丙酮尿症患者亦可服用,已经被批准作为食品添加剂广泛应用于食品加工行业[4]。

图1 纽甜及纽甜类似物结构
纽甜类似物是一类以天冬氨酸和苯丙氨酸为二肽母体,由各种取代基的苯丙醛与阿斯巴甜反应制得的二肽甜味剂。较阿斯巴甜,纽甜类似物有更好的稳定性和甜度。研究[6-8]表明,在纽甜类似物基团R上引入各种3-苯基丙基取代基可获得比阿斯巴甜更甜的甜味剂,且甜度强弱与基团R上的甲基数有关。但目前大多数纽甜类似物制备时,合成各种取代基的苯丙醛条件苛刻,操作复杂且产率低,不能很好地应用于食品工业中。因而,很多学者将目光集中在优化各种取代基的苯丙醛的制备方法上,以期得到更优良的甜味剂和更简易的反应条件。目前二肽甜味剂的合成中,制备各种取代基的苯丙醛主要方法有Grignard reaction(格氏反应)和Friedel-Crafts(傅克烷基化)反应。由于反应条件复杂,且伴随许多副反应的发生,因而大大降低了反应产率和经济效益,限制了这些甜味剂在工业生产上的应用[9-12]。因此,增加纽甜类似物基团R的碳链长度,合成有关取代基的苯丙醛,是近些年研究者们想攻克的重点和难点。
为在纽甜类似物基团R上引入各种3-苯基丙基取代基,试验拟设计以苯硼酸与不饱和烯酸为原料通过Heck(赫克)反应得到苯丙酸类似物,继而得到苯丙醛类似物及二肽甜味剂的合成路线。Heck反应中,催化剂Pd(OAc)2/bpy(醋酸钯/联吡啶)性质稳定,在有氧和高湿环境下的催化效率都很高,反应产率也高,能克服传统Grignard reaction和Friedel-Crafts反应条件复杂,副产物多的缺点[13-15]。同时,试验还对溶剂浓度、催化剂用量、反应温度、反应时间对该反应的影响进行考察,以期筛选出最优反应条件。
1 材料与方法
1.1 仪器
磁力搅拌器:MS-H-Pro型,美国赛洛捷克公司;
旋转蒸发器:N-1300V-WB型,东京理化器械株式会社;
低温反应仪:PSL-1820型,东京理化器械株式会社;
电子天平:AL204型,瑞士梅特勒—托利多公司;
控温型显微熔点测定仪:X-5型,北京泰克仪器有限公司;
红外光谱仪:is50 FT-IR型,美国Thermo公司;
电子轰击电离质谱仪:QTRAP4500型,美国Thermo公司;
核磁共振波谱仪:AVANCE Ⅲ型,瑞士布鲁克公司。
1.2 样品与试剂
3,4-亚甲基苯硼酸(99%)、3,3-二甲基丙烯酸(99%)、丙酮、醋酸钯、联吡啶、氯化亚砜、二异丁基氢化铝、钯/碳:分析纯,萨恩化学技术(上海)有限公司;
N-α-L-天冬氨酰-L-苯丙氨酸甲酯:分析纯,上海阿拉丁生化科技股份有限公司;
甲醇、二氯甲烷、石油醚、乙酸乙酯:分析纯,广州市光华科技股份有限公司;
氘代-甲醇、氘代-氯仿:99.8%,Cambridge Isotope Laboratories。
1.3 试验方法
1.3.1 合成路线 如图2所示,先经过Heck加成反应、酯化反应、DIBAL-H合成中间体3-甲基-3-(3,4-亚甲二氧基苯基)丁醛,后利用3-甲基-3-(3,4-亚甲二氧基苯基)丁醛和阿斯巴甜通过催化加氢合成终产物N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯。
(1)3-甲基-3-(3,4-亚甲二氧基苯基)丁酸(5)的合成:向100 mL圆底烧瓶中依次加入3,4-亚甲基苯硼酸(1.327 g,8 mmol)、丙酮水溶液(V丙/V水=5∶1,24 mL)、3,3-二甲基丙烯酸(0.400 g,4 mmol)、醋酸钯(0.054 g,0.24 mmol)、联吡啶(0.062 g,0.4 mmol),加热至70 ℃并冷凝回流,磁力搅拌36 h后,薄层层析监测(TLC)。反应结束后冷却至室温,硅藻土过滤除去醋酸钯,然后用二氯甲烷洗涤滤渣,并用二氯甲烷(80 mL×3)萃取有机层,水(65 mL)洗涤有机层,最后用无水硫酸钠干燥、过滤,减压除去溶剂,柱层析纯化(石油醚∶乙酸乙酯=300∶10~300∶13),得到白色固体产物3-甲基-3-(3,4-亚甲二氧基苯基)丁酸[15](0.792 5 g,3.6 mmol),产率90%。

图2 N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯的合成路线
(2)3-甲基-3-(3,4-亚甲二氧基苯基)丁酸甲酯(6)的合成:向150 mL圆底烧瓶中依次加入3-甲基-3-(3,4-亚甲二氧基苯基)丁酸(1.121 g,5 mmol)、无水甲醇(50 mL),于0 ℃下搅拌反应,向反应瓶中缓慢滴加氯化亚砜(2.5 mL),室温下磁力搅拌4 h,TLC监测(石油醚∶乙酸乙酯=10∶1,Rf=0.5,碱性高锰酸钾显色)。反应结束后,减压除去溶剂,柱层析进一步纯化(石油醚∶乙酸乙酯=300∶3~300∶4),得到无色透明液体3-甲基-3-(3,4-亚甲二氧基苯基)丁酸甲酯[16](1.156 g,4.7 mmol),产率97%。
(3)3-甲基-3-(3,4-亚甲二氧基苯基)丁醛(7)的合成:向100 mL底烧瓶中依次加入3-甲基-3-(3,4-亚甲二氧基苯基)丁酸甲酯(236.27 mg,1 mmol)、无水二氯甲烷(20 mL),反应置于-78 ℃下搅拌。在氮气保护下,向反应瓶中缓慢滴加二异丁基氢化铝(DIBAL-H,1.0 mol/L in THF,1.2 mL,1.2 mmol),-78 ℃下搅拌反应1 h,TLC监测(石油醚∶乙酸乙酯=10∶1,Rf=0.4,茴香醛显色)。反应结束后,向反应液中加入饱和氯化铵溶液(20 mL)以淬灭反应,搅拌至室温。搅拌结束后,用二氯甲烷(20 mL×3)萃取有机相,饱和食盐水(20 mL)洗涤有机相,无水硫酸钠干燥、过滤,最后减压除去溶剂,柱层析进一步纯化(石油醚∶乙酸乙酯=150∶3),得到无色透明液体[17](189.72 mg,0.92 mmol),产率92%。
(4)N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯(9)的合成:向50 mL圆底烧瓶中依次加入3-甲基-3-(3,4-亚甲二氧基苯基)丁醛(206.24 mg,1 mmol),体积分数为80%的甲醇(10 mL),N-α-L-天冬氨酞-L-苯丙氨酸-1-甲酯(294.20 mg,1 mmol),搅拌5 min。然后在氮气保护下,向反应液中加入10%钯碳(80 mg),常温常压氢气条件下反应24 h。TLC监测(二氯甲烷∶甲醇∶乙酸=2.0∶1.0∶0.1,Rf=0.2,茚三酮显色)。反应结束后,硅藻土过滤除去钯碳,然后用二氯甲烷洗涤滤渣,减压除去溶剂,柱层析进一步纯化(石油醚∶乙酸乙酯∶乙酸=200∶25∶2),得到白色固体产物[18-19](348.9 mg,0.72 mmol),产率72%,熔程82~84 ℃。
1.3.2 反应条件的优化 以3-甲基-3-(3,4-亚甲二氧基苯基)丁酸(5)的产率为指标,分别选取3,4-亚甲基苯硼酸与3,3-二甲基丙烯酸摩尔比2∶1,丙酮溶液体积浓度为80%,Pd(OAc)2摩尔分数5%,反应温度60 ℃,反应时间48 h。固定其他影响因素,分别考察溶剂浓度为70%,80%,90%,100%,催化剂摩尔分数为3%,4%,5%,6%,7%,反应温度为50,60,70,80,90 ℃,反应时间为24,36,48,60,72 h时3-甲基-3-(3,4-亚甲二氧基苯基)丁酸(5)的产率变化,确定最适反应条件。
1.3.3 产物甜度的感官测定 根据文献[20]修改如下:
(1)对照甜味剂溶液的配制:在25 ℃下,称取1 g蔗糖加蒸馏水稀释至10 mL,即为100 g/L的蔗糖溶液,依次配制100,200,300,…,900,1 000 g/L的蔗糖溶液。
指的是学生针对特定的学生习作进行讨论修改的一种方式。运用这一教学指导策略,教师可建议学生在写作训练遇到难以独立解决的困难时主动与同学讨论解决策略,得出结论之后再对文章进行润色。应用这一策略,教师应事先对学生进行小组划分,以便于学生进行讨论修改,并且引导学生在讨论习作问题的时候从评判标准出发。
在25 ℃下,称取1 g阿斯巴甜加蒸馏水稀释至1 L,即为1 g/L的阿斯巴甜溶液,依次配制1,2,3,…,9,10 g/L的阿斯巴甜溶液。
(2)待测甜味剂溶液的配制:在25 ℃下,称取10 mg样品加蒸馏水稀释至1 L,即为10 mg/L的样品溶液。依次配制10,20,30,…,90,100 mg/L的样品溶液。
(3)相对甜度测定:待测甜味剂的甜度为相对甜度,采用感官品尝的方式来测定,评定小组由10人(男女比例1∶1)组成,分别进行品尝。品尝待测甜味剂溶液前,用纯净水漱口,间隔15 min后再品尝下一个待测样品。判断系列浓度样品中与对照组溶液的甜度相同或相近的甜味剂浓度,按式(1)计算样品的相对甜度。
(1)
式中:
s——相对甜度,%;
c1——对照甜味剂浓度,mg/L;
c2——等甜度样品浓度,mg/L。
1.4 数据处理
化合物结构的绘制及结构分析、化学反应路线分析,ChemBioOffice 2014;化合物1H NMR、13C NMR谱图的分析,结构的确定MestReNova 12.0;IR谱图的分析,OMNIC8.2;MS谱图的分析,SCIEX OS1.4;反应条件、甜度分析,Microsoft Excel 365。
2 结果与讨论
2.1 产物结构表征
2.1.1 3-甲基-3-(3,4-亚甲二氧基苯基)丁酸(5)结构的鉴定
(1)1H NMR(600 MHz,CDCl3)δ6.85(d,J=1.9 Hz,1H),6.79(dd,J=8.2,2.0 Hz,1H),6.72(d,J=8.2 Hz,1H),5.91(s,2H),2.58(s,2H),1.40(s,6H)。
(2)13C NMR(75 MHz,CDCl3)δ177.98,148.20,146.24,142.75,119.01,108.45,107.10,101.56,78.10,77.68,77.26,48.82,37.59,29.80。
(3)IR(KBr)νmax3 437,3 070,2 977,2 913,2 681,2 603,1 818,1 694,1 599,1 504,1 429,1 412,1 373,1 320,1 254,1 229,1 186,1 119,1 036,937,904 cm-1。
(4)HRMS(ESI+)m/zC12H14O4,223.096 6;(ESI-)m/zC12H14O4,221.081 4。
2.1.2 3-甲基-3-(3,4-亚甲二氧基苯基)丁酸甲酯(6)结构的鉴定
(1)1H NMR(300 MHz,CDCl3)δ6.87(d,J=1.9 Hz,1H),6.80(dd,J=8.2,1.9 Hz,1H),6.73(d,J=8.2 Hz,1H),5.92(s,2H),3.55(s,3H),2.57(s,2H),1.41(s,6H)。
(2)13C NMR(75 MHz,CDCl3)δ172.62,148.16,146.16,143.00,119.00,108.40,107.12,101.54,78.14,77.72,77.29,51.88,48.99,37.71,29.80。
(3)IR(KBr)νmax3 349,2 952,2 835,1 730,1 488,1 432,1 345,1 235,1 112,1 024,934,906,858,808,725,640 cm-1。
(4)MS(ESI,+ve)m/z237.1[(M+H)+];259.1[(M+Na)+]。
2.1.3 3-甲基-3-(3,4-亚甲二氧基苯基)丁醛(7)结构的鉴定
(1)1H NMR(600 MHz,CDCl3)δ9.50(t,J=3.0 Hz,1H),6.88(d,J=1.9 Hz,1H),6.81(dd,J=8.2,2.0 Hz,1H),6.77(d,J=8.2 Hz,1H),5.94(s,2H),2.62(d,J=3.0 Hz,2H),1.42(s,6H)。
(2)13C NMR(151 MHz,CDCl3)δ 203.37,148.25,146.18,141.82,118.81,108.37,106.80,101.37,57.03,37.03,30.03。
(3)IR(KBr)νmax2 964,2 737,1 716,1 611,1 487,1 431,1 341,1 231,1 111,1 036,934,859,810,727,641 cm-1。
(4)GC-MS(EI)m/z206.1。
2.1.4N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯(9)结构的鉴定
(1)1H NMR(600 MHz,CDCl3)δ8.53(s,1H),7.23(t,J=7.1 Hz,2H),7.19(t,J=7.4 Hz,1H),7.17~7.11(m,2H),6.80(s,1H),6.70(s,2H),5.85(s,2H),4.72(td,J=8.1,5.4 Hz,1H),3.91(s,1H),3.65(s,3H),3.13(dd,J=13.9,5.4 Hz,1H),2.97(dd,J=13.9,8.5 Hz,1H),2.59(d,J=33.5 Hz,4H),1.98(s,2H),1.22(d,J=2.8 Hz,6H)。
(2)13C NMR(151 MHz,CDCl3)δ175.23,171.76,168.84,148.14,145.99,141.77,136.62,129.54,128.84,127.36,118.81,108.29,106.82,101.25,58.78,54.32,52.73,44.01,41.20,37.90,37.07,30.06,29.72,29.46。
(3)IR(KBr)νmax2 956,1 799,1 739,1 686,1 550,1 503,1 489,1 433,1 344,1 233,1 113,1 039,985,911,814,730,702,645 cm-1。
(4)HRMS(ESI+)m/zC26H32N2O7,485.227 3。
根据NMR的分析方法对终产物N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯进行1H NMR和13C NMR分析,其NMR谱图如图3所示。由1H NMR可知,δ8.53(s,1H)为终产物肽键氨基上的1个氢;7.23(t,J=7.1 Hz,2H),7.19(t,J=7.4 Hz,1H),6.70(s,2H)分别为苯丙氨酰甲酯苯环上的5个氢;7.17~7.11(m,2H),6.80(s,1H)为3,4-亚甲二氧基苯基苯环上的3个氢;5.85(s,2H)为3,4-亚甲二氧基中间碳上面的2个氢;4.72(td,J=8.1,5.4 Hz,1H)为L-苯丙氨酰甲酯叔碳上的1个氢;3.91(s,1H)为L-天冬氨酰叔碳上的1个氢;3.65(s,3H)为L-苯丙氨酰甲酯伯碳上的3个氢;3.13(dd,J=13.9,5.4 Hz,1H),2.97(dd,J=13.9,8.5 Hz,1H)为L-苯丙氨酰甲酯仲碳上的2个氢;2.59(d,J=33.5 Hz,4H)是L-天冬氨酰仲碳的2个氢和3-甲基-3-(3,4-亚甲二氧基苯基)丁基上靠近氮的仲碳上的2个氢;1.98(s,2H)为3-甲基-3-(3,4-亚甲二氧基苯基)丁基上靠近苯环的仲碳上的2个氢;1.22(d,J=2.8 Hz,6H)为3-甲基-3-(3,4-亚甲二氧基苯基)丁基上2个甲基上的6个氢。
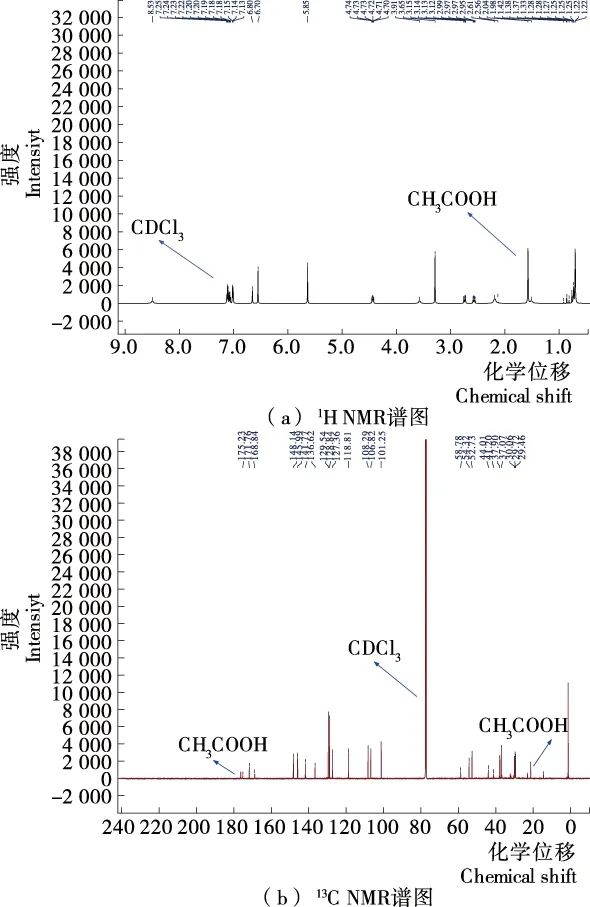
图3 化合物9的1H NMR和13C NMR谱图
由13C NMR谱可知,δ175.23,171.76,168.84为3个羰基上的碳;148.14,145.99,141.77,136.62,129.54,128.84,127.36,118.81,108.29,106.82为2个苯环上的碳;101.25为3,4-亚甲二氧基苯基上的仲碳;58.78为L-天冬氨酰上的叔碳;54.32为L-苯丙氨酰甲酯上的叔碳;52.73为L-苯丙氨酰甲酯上的伯碳;44.01为3-甲基-3-(3,4-亚甲二氧基苯基)丁基上靠近苯环的仲碳;41.20为3-甲基-3-(3,4-亚甲二氧基苯基)丁基上靠近氮的仲碳;37.90,37.07分别为L-天冬氨酰和L-苯丙氨酰甲酯的仲碳;30.06,29.72,29.46分别为3-甲基-3-(3,4-亚甲二氧基苯基)丁基上的季碳和2个伯碳。
由IR图谱数据可知,与阿斯巴甜相比,终产物在1 233 cm-1处出现新的吸收峰且强度很强,为C—O键伸缩振动的特征吸收峰。结合NMR、IR和HRMS,可以确定3-甲基-3-(3,4-亚甲二氧基苯基)丁醛与阿斯巴甜发生了还原氨化反应,其产物为N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯。
2.2 反应条件的优化与筛选
上述1.3.2及1.3.3的方法进行单因素试验,结果如图4 所示。
由图4(a)可知,当溶剂体积浓度为80%时,结果与文献[15]报道的一致,3-甲基-3-(3,4-亚甲二氧基苯基)丁酸的产率最高,可能是因为80%的丙酮溶液能够为Heck反应提供良好的反应环境。溶剂浓度过低,水分过多,对反应物有稀释作用,不利于反应的发生;浓度过高,水提供的质子太少,降低了反应效率。由图4(b)可知,随着催化剂Pd(OAc)2添加量的增加,产物出现先增加后平稳的趋势,可能是因为随着催化剂的增加,反应速率增大,随后催化剂达到饱和,催化速率趋于平衡,产物得率趋于平稳。如图4(c)所示,随着反应温度的升高,产率呈现先逐渐增加后降低的趋势,可能是因为随着温度的升高,Pd(OAc)2的催化活性逐渐提高,达到一定温度后,过高的温度会使催化剂活性降低,产率随之降低。随着反应时间的延长,产物得率先增加后降低,当反应时间为72 h时,反应产率急剧降低,可能是因为随着时间的延长,副反应增加,且催化剂的耗能增加,抑制了Heck反应的发生。
2.3 产物甜度
通过试验小组的感官评价得到数据,将各个浓度代入式(1)即可得到待测样品的相对甜度。以待测样品溶液浓度为横坐标,等甜度的蔗糖溶液、阿斯巴甜浓度为纵坐标,分别制得关系曲线,如图5所示。
由图5可知,N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯的甜度约为蔗糖的3万倍,阿斯巴甜的150倍,与专利[7]中报道的甜度一致。其甜味出现较蔗糖要缓慢,有一定的滞后性,但持续时间较长,甜味纯正,无糖精钠、AK糖等甜味剂的苦涩感和金属味。
3 结论
以3,4-亚甲基苯硼酸、3,3-二甲基丙烯酸为原料,通过Heck反应、酯化反应、DIBAL-H还原及氢气还原氨化4步反应,成功合成了二肽甜味剂N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯。用NMR、IR、HRMS等技术对中间产物及终产物进行结构分析,研究发现中间产物3-甲基-3-(3,4-亚甲二氧基苯基)丁酸甲酯为新化合物,终产物N-{N-[3-甲基-3-(3,4-亚甲二氧基苯基)丁基]-α-L-天冬氨酰}-L-苯丙氨酸甲酯的结构确证无误。经感官评价,验证其甜度约为蔗糖的3万倍。

图4 不同因素对3-甲基-3-(3,4-亚甲二氧基苯基)丁酸产率的影响

图5 蔗糖和阿斯巴甜质量浓度与产物质量浓度的关系
试验合成醛类的路线突破了以往难以在纽甜类似物的N-端引入苯丙基衍生基团的难点,为拓展二肽甜味剂的多样性提供了新思路。此外,试验所用原料经济易得,反应条件易控制,操作简单且产率较高,为合成高倍甜味剂提供了一种高效的方法。

