儿童急性淋巴细胞白血病中SOCS3通过STAT3信号通路调节Treg细胞表达
黄玲玲,王宁玲,吴正玉,刘亢亢,储金华,杨林海
近年来随着对急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)发生机制的深入研究,国内外学者[1-2]发现CD4+CD25+CD127low调节性T细胞高表达导致的免疫抑制与ALL细胞恶性克隆相关,调节性T细胞(regulatory T cells,Treg)与儿童ALL之间存在密切关系,控制ALL患者体内Treg细胞的数量和功能可以提高ALL患者的抗肿瘤免疫能力及白血病微小病变残留的清除能力。细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)能够通过抑制Janus蛋白质酪氨酸激酶/信号转导因子和转录激活子3(janus protein tyrosine/singal transducer and activator of transcription 3,JAK/STAT3)信号的行为间接参与到调控T淋巴细胞分化、成熟的过程,在调控体内Treg细胞表达中起到关键作用[3-4]。该研究测定儿童ALL中SOCS3与Treg细胞表达水平的关系, 探讨SOCS3在儿童ALL疾病状态和危险度评估、肿瘤免疫以及靶向治疗中的应用。
1 材料与方法
1.1病例资料研究对象:2015年1~12月在安徽医科大学第二附属医院儿科血液病区住院的新诊断ALL患儿。纳入标准:符合细胞形态学、免疫分型、遗传学及分子生物学诊断标准的ALL,入组年龄1个月~18岁,中位年龄5.8岁,排除以下情况:成熟B急性淋巴细胞白血病、混合表型的急性白血病、免疫缺陷性疾病、第二肿瘤、非初治的ALL。依据初治时疾病危险度将患儿分组,共分为低危(low risk, LR)、中危(moderate risk, MR)和高危(high risk, HR) 3组,化疗方案采用中国儿童ALL多中心治疗研究方案(急性淋巴细胞白血病-2015方案),该化疗方案包括三个阶段,分别为诱导缓解化疗、巩固化疗治疗、维持化疗治疗。儿童ALL染色体核型异常并形成融合基因包括TEL-AML基因、BCR/ABL基因、POX基因、MLL基因等。最终确定入组ALL病例45例,其中女性患者22例,男性患者23例,患儿年龄为8个月~14岁,中位年龄为5.8岁,入组患儿的相关临床特点见表1。同时设置正常对照组,正常对照组选择13名健康儿童,其中女孩7例,男孩6例,正常对照组儿童年龄3~14岁,中位年龄5.8岁。两组年龄、性别差异均无统计学意义(P<0.05)。所有确诊ALL的入组患儿和正常对照组健康儿童资料中均留存废弃标本用于科学研究知情同意书,该知情同意书由其监护人签署。

表1 45例ALL患儿的临床特点
1.2外周血单个核细胞和RNA的提取用无菌乙二胺四乙酸二钠盐(EDTA) 抗凝管留取ALL患儿和正常儿童外周血3 ml,加入Ficoll分离液(天津生物科技有限公司),按照说明提取外周血单个核细胞。按照TRIzol法(美国Invitrogen公司)提取RNA,提取后的RNA溶于10 μl DEPC水中,微量光度计测定所有RNA样本A260/A280为1.8~2.0。
1.3荧光定量PCR反应以Oligo d(T)为引物(美国Invitrogen公司),按照逆转录试剂(美国Themero Scientific 公司)说明书进行cDNA合成;按照SYBR-Green试剂(美国Themero Scientific公司)说明书进行荧光定量PCR反应。SOCS3前引物序列:5’-CAGCTCCAAGAGCGAGTACCA-3’;SOCS3后引物序列:5’-AGAAGCCGCTCTCCTGCAG-3;STAT3前引物序列:5’-AGGAGGAGGCATTCGGAAA-3’;STAT3后引物序列:5’-AGCGCCTGGGTCAGCTT-3’;内参基因GADPH前引物序列:5’-AATGGAAATCCCATCACCATCT-3’;GADPH后引物序列:5’-CGCCCCACTTGATTTTGG-3’。
1.4流式细胞术测定Treg细胞水平采用全血直接计数法,以CD4-异硫氰酸荧光素(FITC) 设门,固定、破膜,别藻青蛋白(APC) 标记的FOXP3抗体染色30 min,检测CD4+CD25+FOXP3+T淋巴细胞比例。

2 结果
2.1ALL患儿初诊时SOCS3mRNA表达水平测定45例初诊组ALL患儿初诊时SOCS3 mRNA水平和正常对照组13例健康儿童的SOCS3 mRNA水平,测定数据显示两组SOCS3 mRNA相对表达量分别为(0.62±1.04)和(4.25±2.37)。该结果表明,初诊组患儿在初诊时SOCS3 mRNA的表达水平明显低于正常对照组,差异有统计学意义(t=9.759,P<0.05)。
2.2ALL患儿初诊时STAT3mRNA表达水平测定45例初诊组ALL患儿初诊时和正常对照组13例正常儿童的STAT3 mRNA水平, STAT3 mRNA相对表达量分别为(3.11±1.17)和(0.87±0.14),初诊组患儿在初诊时STAT3 mRNA表达水平是增高的,与正常对照组比较,差异有统计学意义(t=12.54,P<0.05)。
2.3ALL患儿初诊时Treg细胞水平用流式细胞术检测了初诊组45例ALL患儿初诊时和13例正常对照组儿童的Treg细胞表达水平,见图1。对比数据结果可以看出,ALL患儿初诊Treg细胞水平增高,与对照组差异有统计学意义(t=-9.163,P<0.05),见表2。
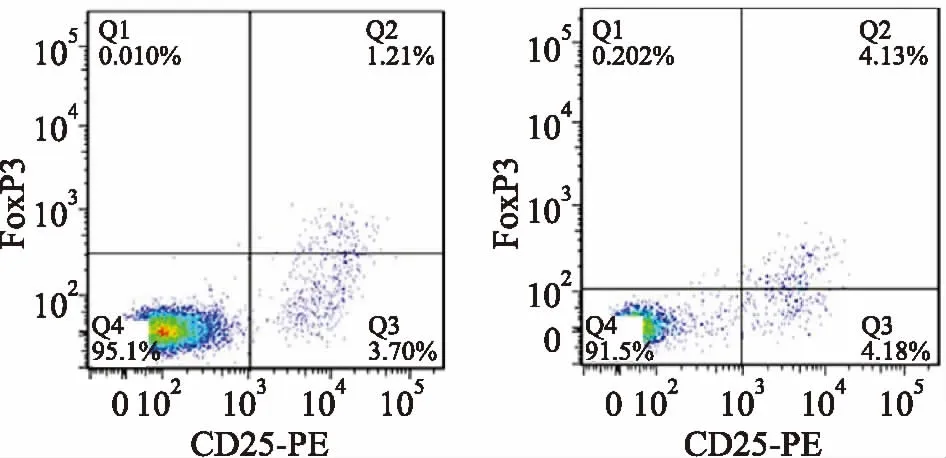
图1 初诊组ALL患儿与正常对照组儿童Treg细胞表达水平
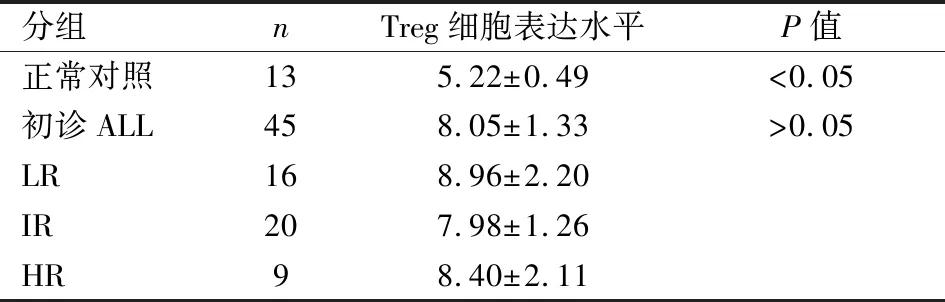
表2 初诊组ALL患儿与正常对照组儿童Treg细胞表达水平
2.4ALL患儿初诊时SOCS3、STAT3、Treg细胞表达相关性初诊组ALL患儿STAT3的表达水平与Treg细胞表达水平呈正相关性(Treg:r=0.751,P<0.05),而SOCS3的表达水平分别与STAT3、Treg细胞表达水平均呈负相关性(STAT3:r=-0.61,P<0.05; Treg:r=-0.558,P<0.05),见图2。
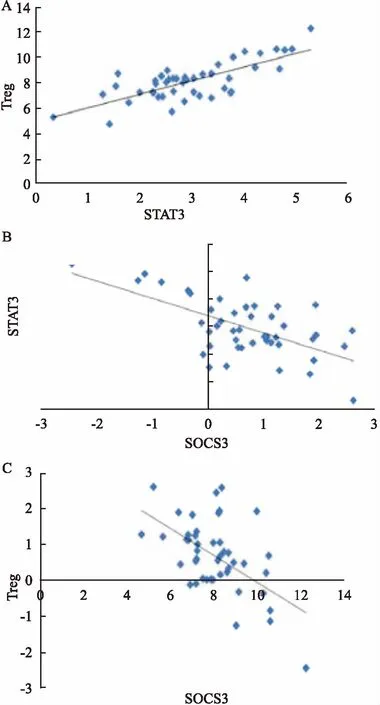
图2 初诊组ALL患儿STAT3、SOCS3、Treg细胞表达水平相关关系散点图
3 讨论
Treg细胞作为免疫抑制性细胞,在血液系统恶性肿瘤的发生、发展中起到重要作用[5-6],Treg细胞在血液系统肿瘤患者中表达水平增高、Treg细胞数量增加以及Treg细胞在肿瘤患者中功能增强都有利于肿瘤发展及生长,从而影响疾病的进展及进程。对于Treg细胞表达水平与儿童ALL之间存在的关系,以往的研究[1,7]表明在儿童ALL中存在Treg细胞表达水平增高的现象,本研究通过测定45例ALL患儿和正常对照组儿童Treg细胞表达水平,结果同样证实在儿童ALL中Treg细胞表达水平增高,然而引起ALL患儿Treg细胞表达水平增高的机制目前尚不清楚。
随着对Treg细胞表达调节机制的深入研究,STAT3在调节Treg细胞表达中起到了重要的作用[8],STAT3与CD4+T细胞上白介素-6受体结合,上调叉头蛋白-3的表达,促进了Treg细胞的活化。由此推论如果抑制了STAT3的表达,则可以直接或间接抑制Treg细胞的活化[9]。为探讨在儿童ALL中STAT3与Treg细胞表达水平的关系,本研究同时测定了儿童ALL中STAT3表达水平,结果显示儿童ALL中STAT3、Treg细胞水平明显增高,提示在儿童ALL中STAT3的异常表达可能是导致Treg细胞水平增高的原因之一。
SOCS3是SOCS家族中的重要一员,是负性调控JAK/STAT3信号通路中重要的一种分子,在某些类型白血病中发现SOCS3存在低表达的现象,SOCS3低表达可导致STAT3的持续磷酸化[10-11]。课题组前期曾探讨儿童急性淋巴细胞白血病SOCS3的表达水平与ALL临床特点和ALL早期治疗反应的相关性,相关数据可以证实:儿童ALL中存在SOCS3表达下调的现象,但SOCS3在疾病诱导缓解后能够恢复正常表达[11]。为了探讨在儿童ALL中SOCS3和STAT3两者的关系,本研究同时测定了急ALL患儿中SOCS3的表达水平,结果表明SOCS3的表达水平在ALL儿童中明显降低,提示在儿童ALL中SOCS3负性调节STAT3的表达,SOCS3的低表达导致STAT3的持续活化,从而引起Treg细胞的高表达。SOCS3对Treg细胞的调节作用,为白血病的免疫治疗提供了新思路。
近年来SOCS3得到了学者们广泛关注及深入研究,其作为可能的抑癌基因参与了各种肿瘤的发生、发展和转移,参与了肿瘤的进展及病程[12-14],课题组前期研究[11]揭示了SOCS3与儿童ALL发生、发展密切相关,SOCS3在ALL儿童中的低表达可以导致ALL中STAT3的持续活化,因此监测ALL患者中SOCS3水平可以了解疾病状态并可以评价危险度[10-11]。然而儿童ALL中SOCS3低表达的机制目前尚不清楚,SOCS3的低表达与儿童ALL长期无事件生存的关系以及STAT3的持续活化引起的CD4+CD25+CD127lowTreg细胞表达增高的具体作用机制还有待进一步研究。有学者在关于肝癌的研究[15]表明SOCS3基因的甲基化可以引起SOCS3的低表达,接下来本研究计划测定SOCS3基因甲基化水平,进一步探究SOCS3低表达的分子机制,同时继续跟踪随访入组研究对象的长期无事件生存情况。

