miRNA-21对宫颈癌Hela细胞顺铂化疗增敏作用的研究
徐文莉,李康,王娟,林燕华,廖长征,罗艺,张洪德
(深圳市龙岗中心医院中心实验室,广东 深圳518116)
宫颈癌是女性最为常见的恶性肿瘤之一,发病率在全球范围恶性肿瘤中位居第四位,死亡率在20~39岁妇女中高居第二[1]。85%的宫颈癌病例发生在发展中国家仅次于乳腺癌,我国子宫颈癌发病例数居世界国家第二位[2,3],在我国女性生殖系统肿瘤中居首位[4]。目前的主要治疗方式为手术、放疗、化疗和综合治疗[5],其中化疗在宫颈癌中的作用越来越受到国内外的重视,顺铂作为一线化疗药物用于治疗宫颈癌,但部分患者在数个化疗后,会产生耐药从而影响疗效导致高死亡率。因此,如何提高宫颈癌细胞对化疗药物的敏感性及抑制肿瘤细胞的侵袭转移是目前宫颈癌治疗中急需解决的问题。研究显示microRNAs在调节肿瘤细胞对化疗药物敏感性方面起着重要作用,miRNA-21是体内重要的miRNAs之一,与肿瘤化疗耐药密切相关。PTEN是一个抑癌基因,与细胞耐药密切相关。但是在宫颈癌铂类耐药相关的研究目前文献报道较少。本研究通过研究宫颈癌Hela/DDP在顺铂诱导的细胞凋亡中miRNA-21、PTEN的变化,探讨miRNA-21及PTEN在逆转宫颈癌Hela/DDP顺铂耐药的作用。
1 材料与方法
1.1 材料 人宫颈癌亲本细胞株Hela、耐药细胞株Hela/DDP购自中科院上海生化细胞所细胞库,总RNA提取试剂盒购自杭州博日科技有限公司,microRNA-21 siRNA 及阴性对照 (microRNA-21 neg)及U6引物购自广州锐博生物科技有限公司,PI及 Anexin-FITC Apop Detecter kit试剂盒购买于美国BD公司,MTT试剂盒购买于北京博奥龙免疫技术有限公司,DPP-顺氯氨铂 (美国sigma公司),MEM培养基(美国Hyclone公司),新生牛血清(美国Gibco公司),细胞培养瓶及培养板(美国Corning公司),PTEN抗体 (Abcam公司)。仪器:CO2培养箱购买于美国Thermo公司,FACSCanto流式细胞仪购自美国BD公司,VIIA7实时荧光定量PCR仪购买于美国ABI公司。
1.2 方法
1.2.1 实时荧光定量 PCR 收集培养 24h后的Hela细胞、转染24h后的Hela/DDP细胞,提取总RNA,Multiskan go酶标分析仪检测RNA纯度及浓度,OD260/OD280 吸光度比值在 1.8-2.0 间满足要求。以U6作为内参,逆转录引物5’CGCTTCACGAATTTGCGTGTCAT3’ 反应条件:95℃,5min;40个 PCR 循环 (95℃,10s;60℃,20s;72℃,20s;78℃,20s(收集荧光);为了建立PCR产物的熔解曲线,扩增反应结束后继续从72℃缓慢加热到99℃(每5s升高 1℃)。 miR-21 5’TGCGTGTCGTGGAGTC3,反应条件:95℃,5min;40 个 PCR 循环 (95℃,10s;60℃,20s;72℃,20s;78℃,20s(收集荧光))。 为了建立PCR产物的熔解曲线,扩增反应结束后继续从72℃缓慢加热到99℃(每5s升高1℃)。以U6为内参照, 以 2-ΔΔCt法表示相对表达量,ΔΔCt=(Ct实验-CtU6)实验组-(Ct对照-CtU6)对照组,CT 为每个反应管中的荧光信号达到所设定阈值时所经历的循环数。
1.2.2 MTT法检测细胞增殖 收集转染后的宫颈癌Hela/DDP细胞分别接种于96孔板,约5×103个/孔,置37℃、5%CO2温箱培养24h后,向每孔细胞中加入DDP10μg/ml,培养72h后每孔加入180μl新鲜DMEM培养液,再加入20μl MTT溶液(5mg/ml),继续培养4h后,去除孔内培养液。每孔加入DMSO 100μl,置摇床上低速振荡 10min,使结晶物充分溶解。在Multiskan go酶标仪570nm处测量各孔的吸光值。抑制率=(对照组OD值-实验组OD值)/对照组OD值。
1.2.3 PI法检测肿瘤细胞周期 胰酶消化细胞后,收集细胞悬液离心,弃去上清液,用PBS洗涤2次,调整细胞浓度在在1×105个/ml左右,加入碘化丙啶(PI),室温避光30min,流式细胞仪检测细胞周期。
1.2.4 流式细胞术检测肿瘤细胞的凋亡 细胞悬液处理同 1.2.3 步骤, 取 100μl细胞悬液与 7-AAD 5μl以及FITC AnnexinV 5μl混合充分混匀,置于室温 (20~25℃) 避光 15min, 加 400μl 1×Binding Buffer在1h内上机检测。
1.2.5 Western blot法检测细胞中 PTEN 蛋白的表达 收集转染后72h后的细胞,按照实际说明书操作步骤,提取细胞中总蛋白,进行聚丙酰胺凝胶电泳,后转移至醋酸纤维膜上,脱脂牛奶室温封闭。2h后加入PTEN及β-Actin抗体,置于摇床4℃孵育过夜,PBS洗膜后加入辣根过氧化酶抗体,用ECL化学发光试剂盒进行显影,凝胶成像分析系统进行分析。
1.3 统计学分析 应用SPSS 19.0软件进行统计学处理,计量资料符合正态分布的采用均数±标准差(x±s)x 表示,两组间比较采用 t检验,三组间两两比较采用单因素方差分析,P<0.05为差异有统计学意义
2 结果
2.1 实时荧光定量PCR检测人宫颈癌亲本细胞Hela组、耐药细胞株Hela/DDP组中miR-21表达差异 实时荧光定量PCR结果显示:miR-21在Hela/DDP 组中表达量 4.251±0.018,明显高于 Hela组1.000,差异具有统计学意义(P=0.041)。 见图 1。2.2 Real-timePCR 检测 Hela/DDP 组、 转染后Hela/DDP siRNA组及Hela/DDP阴性组中miR-21表达差异。
细胞转然后miRNA-21的表达,结果显示miR-21-siRNA 组表达量为 1.501±0.013,均低于空白对照组 4.251±0.018,P=0.041 及 miR-21-neg 组4.321±0.011,P=0.039,差异均有统计学意义,空白对照组与 miR-21-neg 组相比,P=0.752,差异无统计学意义。见图2。

图1 转染前miR-21在Hela/DDP及Hela中的表达
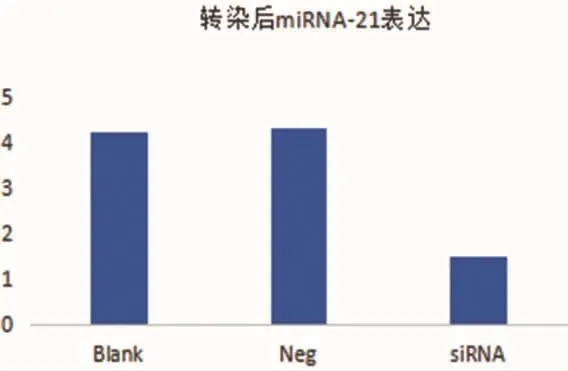
图2 转染后miR-21在空白对照组、miR-21-neg组及miR-21-siRNA组中的表达
2.3 MTT检测顺铂对 siRNA及阴性对照转染Hela/DDP和无转染Hela/DDP的抑制率。
pSIREN-miR-21干扰载体抑制Hela/DDP细胞的增殖, 抑制率为 58.458.4±1.41 明显高于空白对 照 组 34.2 ±1.11,P=0.038 和 miR -21 -neg 组35.3±1.32,P=0.039,差异均有统计学意义,空白对照组和 miR-21-neg 组比较 P=0.862, 差异无统计学意义。见图3。
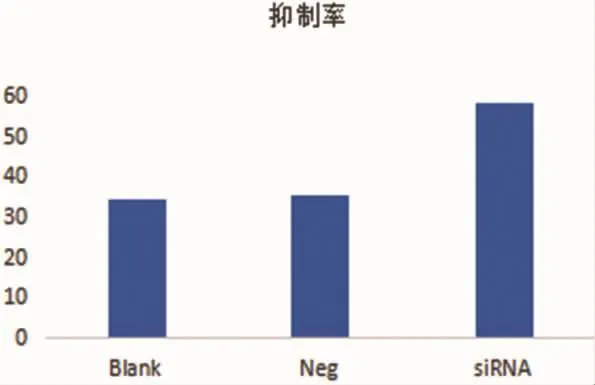
图3 DDP作用72h各组细胞的抑制率
2.3 流式细胞术分析细胞周期的变化 miR-21-siRNA组的G0/G1期细胞比例明显升高 70.12±2.17, 与空白对照组 46.51±2.14,P=0.035 及 miR-21-Neg 组 45.27±1.15,P=0.031,S 期及 G2/M 期细胞比例明显下降 21.54±2.11 vs 32.58±3.17、33.27±2.19 P=0.042,P=0.039;8.31±1.15 vs 21.15±2.87、22.58±3.19 P=0.022,P=0.019。 miR-21-neg 组与空白对照组相比,不同细胞周期间差异均无统计学意义(P>0.05)。 见图 4。
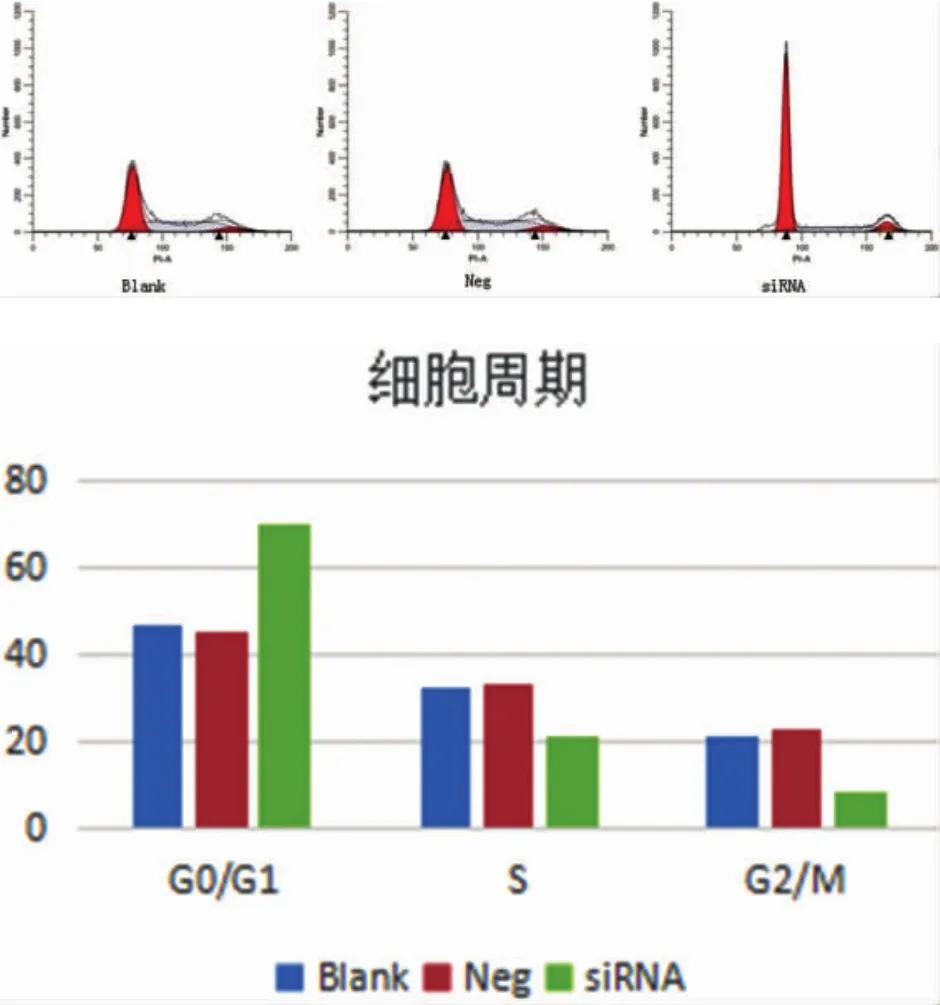
图4 DDP作用72h各组细胞周期
2.4 流式细胞术检测细胞凋亡率 流式细胞仪双染法检测结果显示,siRNA转染Hela/DDP组凋亡率 32.62±3.25 高 于 空 白 对 照 组 10.85±0.27,P=0.014 和 miR-21-neg 组 11.14±0.21,P=0.019,差异均有统计学意义。见图5。
2.5 PTEN蛋白的表达 Western blot检测各组细胞中PTEN蛋白的表达水平,发现siRNA转染组PTEN蛋白表达量为0.53±0.08明显升高空白对照组 0.28±0.02,P=0.025 和 miR-21 -neg 组 0.27 ±0.01,P=0.023。 见图 6。
3 讨论
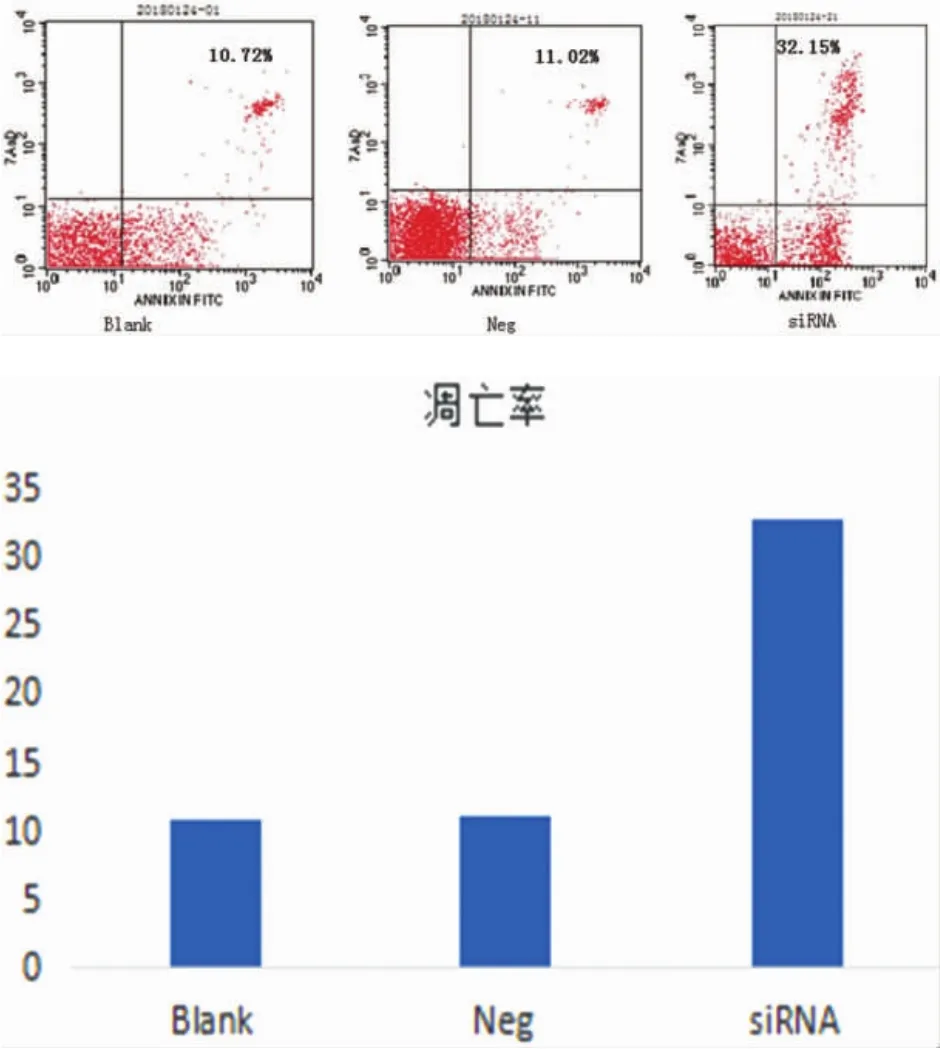
图5 DDP作用72h各组细胞的凋亡率

图6 DDP作用72h各组细胞的PTEN蛋白表达水平
顺铂临床上常用的一种肿瘤化疗药物,可以有效地抑制肿瘤,但在治疗过程中经常出现耐药显现,导致化疗不佳。研究发现肿瘤耐药与MicroRNAs(miRNAs)的异常表达有关。 miRNAs是一种长约22nt的非编码小分子单链RNA,在肿瘤的发生发展中起着重要角色,主要通过负向调控相关靶基因的表达在系列疾病病理生理过程中起着重要作用[6]。miR-21是体内重要的miRNAs之一,通过靶向调控多种细胞凋亡相关基因,促进细胞增殖,对抗细胞凋亡,不仅参与多种肿瘤的发生发展和侵袭转移过程,而且与肿瘤化疗耐药密切相关[7-10]。PTEN名为与张力蛋白同源,第10染色体丢失的硫酸酶基因,是迄今为止发现的第一个具有双特异性磷酸酶(DPS)活性的抑癌基因,能够通过复杂的信号转导通路调控细胞周期、肿瘤侵袭转移和细胞耐药等过程。前人实验证明,PTEN是miR-21的重要靶基因,miR-21通过PTEN调控宫颈癌细胞的恶性生物学行为,是宫颈癌发生发展及侵袭转移的重要调节机制。通过抑制Hela和caSki细胞中miR-21表达,能有效增加PTEN蛋白表达,抑制细胞增殖、促进细胞凋亡。由于PTEN介导的PI3K/AKT通路是体内重要的抗凋亡转导途径,其异常激活能够促进宫颈癌细胞对铂类耐药的发生。因此,我们有理由假设,miRNA-21在逆转宫颈癌耐药方面发挥重要的调控作用。
本研究结果显示,通过Hela/DDP细胞中的miRNA-21表达明显高于亲本细胞Hela,提示宫颈癌耐药与miRNA-21表达上调有关。通过siRNA干预Hela/DDP细胞后,miRNA-21表达下调,给予顺铂作用后,MTT结果显示Hela/DDP细胞增殖抑制率明显升高,流式细胞仪分析提示细胞凋亡率升高,同时影响细胞周期的进程,将细胞停滞于G0/G1期。从而证实下调Hela/DDP细胞miRNA-21后,对顺铂的敏感性增强,凋亡程度提高,逆转了宫颈癌Hela/DDP细胞对顺铂的耐药性。实验研究显示,siRNA转染Hela/DDP细胞并给于顺铂作用后,其PTEN蛋白表达明显提高,细胞增殖活性下降,这与文献报道一致[11-14]。实验证明,PTEN是miRNA-21的重要靶基因,miRNA-21通过PTEN调控宫颈癌细胞的恶性生物学行为,是宫颈癌发生发展及侵袭转移的重要调控机制[15,16]。本实验显示抑制miRNA-21的表达,PTEN蛋白表达上调,提高对顺铂化疗药物的敏感性,提示miRNA-21调控PTNE蛋白在逆转宫颈癌Hela/DDP细胞顺铂耐药中同样具有重要作用。
综上所述,抑制Hela/DDP细胞中miRNA-21表达,上调PTEN蛋白表达水平,增加宫颈癌Hela/DDP细胞对顺铂诱导的凋亡和敏感性。本研究为了解miRNA-21在逆转宫颈癌Hela/DDP细胞化疗药物中的作用提供了新的见解,为提高宫颈癌药物敏感性的靶向治疗提供了重要依据。

