反义寡核苷酸处理伊马替尼耐药慢粒细胞后Bcl-x剪接异构体的变化
张静,李书琪,黄波,闵清华,姜钰环,杨伟明,徐颜美,林晋,刘静,王小中
(江西省检验医学重点实验室,南昌大学第二附属医院检验科,江西 南昌330006)
伊马替尼(Imatinib,IM)耐药是慢性粒细胞白血病(chronic myeloid leukemia,CML)治疗失败的主要原因之一,其耐药机制十分复杂。众多研究报道,基因异常剪接是肿瘤出现化疗抵抗的重要分子基础[1-3]。Bcl-x基因是Bcl-2家族成员之一,其pre-mRNA通过选择性剪接(alternative splicing)主要生成两种剪接异构体,Bcl-xL和Bcl-xS。Bcl-xL是重要的抗凋亡蛋白,而Bcl-xS则是重要的促凋亡蛋白,两者生物功能相互拮抗,表达处于平衡状态[4]。当Bcl-x基因的剪接发生异常时,Bcl-xL/BclxS比值显著升高,现已证实这是乳腺癌等[5,6]肿瘤发生、发展的关键分子事件。所谓vMO技术是近年发展起来的一种能实现体内、外直接调控靶基因选择性剪接的高效方法,与培养的细胞共同孵育能高效转运至胞内,也可以经静脉、腹腔注射到体内后能高效转运至全身各组织器官,与靶基因前mRNA的特定核苷酸序列结合,从而调控选择性剪接。2016年Nature杂志报道应用Vivo-Morpholinos(vMO)在小鼠体内靶向调控内含子剪接位点,为我们提供了成功调控选择性剪接的例证[7]。目前,运用vMO技术处理IM耐药CML细胞后,观察Bclx剪接异构体变化的研究尚未见相关报道,本研究有望为临床治疗CML及其他伴Bcl-x剪接异常的肿瘤的化疗提供新靶点。
1 材料与方法
1.1 细胞及试剂 IM耐药CML细胞K562/G01(购自中国医学科学院天津血液研究所)。RMPI 1640培养基(Bioind)含10%FBS,青霉素和链霉素浓度均为100U/ml。Imatinib购自Sigma Aldrich公司,PrimeScriptTM RT Master Mix逆转录试剂盒(日本Takara 公司),2×Taq PCR Master Mix(北京全式金生物技术有限公司),Bcl-x抗体 (美国BD公司),β-actin抗体 (Proteintech中国分公司),vMO试剂盒(美国Gene Tools公司)
1.2 方法
1.2.1 vMO序列设计原理 我们检索相关文献发现,肿瘤细胞中调控Bcl-x基因外显子2b剪接的机制均为剪接增强调控,在Bcl-x基因的外显子2a、2b及内含子2中均存在相应的外显子增强子,使外显子2b的剪接得以增强,即促进Bcl-xL的形成,减少Bcl-xS的形成。反义寡核苷酸能通过与pre-mRNA上5’或3’剪接位点靶向结合从而阻止剪接体对该位点的识别,进而增加其他隐蔽剪接位点的使用,最终实现对基因的剪接调控。我们设计本项目的序列由Gene Tools公司合成。
1.2.2 总 RNA 提取及 Bcl-xL 和 Bcl-xS mRNA 表达水平检测 根据Bcl-x、GAPDH基因设计特异引物,引物序列见表1。
按照以下PCR扩增反应体系 2×Taq PCR Master Mix 10μl, 上下游引物各 1μl,cDNA 2μl及dH2O 6μl,总反应体积为20μl进行加样,点动混匀,离心后放入PCR扩增仪进行扩增,反应条件为:95℃ 5min;(95℃ 30s; 退火温度 (见表)35s;72℃ 30s)35 个循环;72℃延伸 5min;以 GAPDH 作为内参。反应结束后,取PCR产物10μl,进行2%琼脂糖凝胶电泳。利用BIO-RAO凝胶成像仪进行图像检测,并用其分析软件(Image Lab)进行定量分析。
1.2.3 Western-Blot检测 Bcl-xL 和 Bcl-xS 蛋白表达水平 细胞总蛋白提取和定量检测合格后,经SDS-PAGE电泳。孵育一抗:用一抗稀释液对一抗体进行稀释 (Bcl-x 稀释:1:4000; 内参稀释:1:1000),孵育二抗:用1×TBST或者封闭液稀释二抗(anti-rabbit:1:10000), 将 PVDF 膜完全浸没于二抗液中,洗膜后暗室曝光拍照存图,利用BIO-RAO凝胶成像仪进行图像检测,并用其分析软件(Image Lab)进行定量分析,实验重复三次。
1.3 统计学方法 运用SPSS 23.0对实验数据进行统计学分析,正态计量数据以均数±标准差(x±s)形式表示,两组间比较采用t检验,多组采用方差分析,P<0.05 为有统计学意义。
2 结果
2.1 K562/G01细胞对Imatinib化疗耐受作用 取对数生长期的K562/G01细胞A、B、C,调整每孔细胞密度均(2~3)×105,依次向每孔加 2μM imatinib(根据天津血液研究所建议耐药细胞稳定生存用量)作用0,24h,48h,镜下观察到细胞形态几乎无变化,提示K562/G01细胞对imatinib出现抵抗(图1)。
图 1 K562/G01细胞对 imatinib抵抗 (A,B,C:K562/G01细胞2μM imatinib 作用 0,24,48h)
2.2 合成靶向Bcl-x剪接调控位点的特异性vMO我们设计的靶向调控Bcl-x选择性剪接的vMO序列如下:5′-GCTTGGTTCTTACCCAGCCGCCGTT-3′(下划线处为外显子2b和内含子2交界处),对应Bcl-x 基因序列为:5′-CAGGAG[AACGGCGGCTGG gta aga acc aag c]cc ctt gtg tgt c-3′(大写字母表示外显子序列,小写字母表示内含子序列,中括号内为互补结合区)。
2.3 vMO能稳定高效转染K562/G01细胞 如前文所述,我们初步设计合成了靶向调控Bcl-x选择性剪接的vMO序列,将3′端以荧光素FAM标记,于饱和湿度条件下37℃,5%CO2,10%小牛血清,RPMI 1640培养基与耐药CML细胞株K562/G01共孵育 24h,48h,72h,96h,使用 imatinib 浓度1μM,取细胞以PBS洗至无游离荧光于倒置显微镜观察,流式细胞仪检测胞内荧光强度,得出阳性百分率。结果显示48h大量细胞发荧光(图2.A),同时流式细胞术检测vMO转染K562/G01细胞阳性率达77.74%(图2.B),说明vMO在48h后能成功高效的转染目的细胞。

表1 PCR反应引物序列

图2 倒置荧光显微镜观察荧光标记vMO在48h转染K562/G01细胞(A),流式细胞仪检测48h胞内荧光强度(B)
2.4 vMO有效调节Bcl-xL/Bcl-xS mRNA比值 按照上述条件同时提取4个不同处理组细胞的RNA,经过逆转录、PCR扩增和琼脂糖电泳,最终在紫外灯下观察条带结果。PCR琼脂糖电泳条带显示:与单独IM和单独vMO组处理K562/G01细胞相比,IM+vMO组的Bcl-xL mRNA表达量显著降低,同时Bcl-xS mRNA表达量明显升高。Bcl-xL和Bcl-xS mRNA进行灰度值半定量分析,则BclxL/Bcl-xS比值下降更明显。见图3。
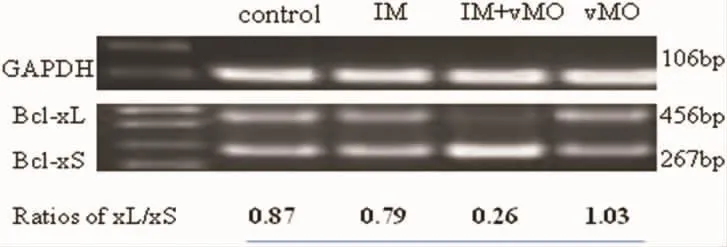
图3 vMO处理前后细胞胞内Bcl-xL和Bcl-xS mRNA比值的表达变化
2.5 vMO有效调节Bcl-xL/Bcl-xS蛋白比值 以相同的条件提取4个实验组细胞的总蛋白,按照上述相同条件提取4个不同处理组细胞的总蛋白,通过相关软件分析,经过蛋白电泳、转膜、孵抗体和曝光后,最终得到蛋白条带结果。Bcl-xL在vMO联合IM处理之后表达量明显降低,同时Bcl-xS表达量明显升高。说明,IM联合vMO转染K562/G01细胞影响Bcl-xL/Bcl-xS比值。见图4。
3 讨论

图4 Western blot检测不同处理组对Bcl-xL和Bcl-xS蛋白表达的影响
人类凋亡相关基因Bcl-x会通过选择性剪接产生Bcl-xL和Bcl-xS两种异构体,它们在维持细胞生存上分别起抑制或促进凋亡的作用。近年发现异常选择性剪接在多种不同类型白血病患者体内普遍存在,与白血病的发生、发展及化疗抵抗等密切相关[8]。研究报道,剪接体Bcl-xL在CML中高表达,其作用不是引发CML或维持CML状态,而是促进CML向加速期或急变期发展,并且可以提高CML细胞对TKIs等化疗药物的抗性[9]。另有研究证实,高浓度的Bcl-xL是维持CML干细胞生长的重要因素之一,而CML干细胞的增殖、衍变则是CML进展的根本和耐药的源泉[10]。本研究结果发现,Bcl-xL在IM耐药CML中高表达,而Bcl-xS显著低表达,提示Bcl-x基因异常选择性剪接是导致CML进展和化疗抵抗的关键分子基础,与文献报道一致。综合分析其机制主要涉及两个方面:一方面,Bcl-xL抗凋亡剪接体的过量表达能抑制化疗药物诱导的死亡受体和(或)线粒体凋亡通路的激活;另一方面,Bcl-xS促凋亡剪接体的表达水平和活性的降低,则能致正常浓度的化疗药物不能诱导凋亡信号的传播[11,12]。
vMO技术是一种能体内外直接调控靶基因选择性剪接的新方法。本研究在对CML的研究基础上,以耐药CML(K562/G01)细胞为模型,利用特殊设计的vMO技术与K562/G01细胞进行共培养,结果显示单独IM组和单独vMO租对K562/G01细胞Bcl-x基因选择性剪接模式的调控是有限的,产生此研究结果的可能原因是与耐药细胞中存在维持Bcl-x发生异常剪接的机制有关。IM药物作用的发挥在很大程度上是通过对细胞凋亡的诱导实现的,而在药物选择压力条件下,细胞可能通过抑制凋亡通路实现对IM耐受作用。因此,我们推测IM联合vMO在K562/G01中能有效纠正Bcl-x基因的剪接模式,这一变化可能与两者明显协同作用有关,进而激活凋亡相关信号通路,诱导耐药CML细胞凋亡,仍需后续实验进一步探讨。其调控机制是:当反义寡核苷酸靶向与Bcl-x基因外显子2b和内含子2交界处结合后,该5’剪接位点不能被剪接体识别,将迫使剪接体与外显子2a处5’剪接位点结合,最终导致外显子2b被切除,在减少Bcl-xL的生成的同时增加BclxS的生成,显著降低Bcl-xL/Bcl-xS比值,实现双向调控,这才是靶向Bcl-x基因治疗的最优策略。

