优秀长跑运动员NADPH氧化酶p22phox亚基基因多态性分子标记的探讨*
周文婷,胡 扬
(1. 遵义师范学院体育学院,贵州 遵义 563006;2. 哈尔滨体育学院学术理论研究部,黑龙江 哈尔滨 150001; 3. 北京体育大学科学研究中心,北京 100084)
生物体内的能量代谢将氧气作为生物氧化中的电子受体,从而产生化学性质较活泼的活性氧ROS,一方面发挥生物学功能,另一方面则表现细胞毒性[1]。正常生理条件下,体内ROS的生成与消除呈动态平衡,故并不对机体造成严重损害[2],但当ROS水平超过机体的清除能力时,就会发生氧化应激,最终导致细胞凋亡或坏死[3]。NADPH氧化酶是高度表达于内皮细胞和血管内平滑肌细胞中的一种超氧化物代谢酶,也是吞噬细胞、纤维原细胞、血管平滑肌细胞及内皮细胞内ROS的主要来源[4]。 与骨骼肌安静时相比,长时间大强度运动所需能量巨大,因此运动时大量氧气进入线粒体产生大量的ROS。而在此情况下,机体的抗氧化能力不足以平衡ROS的产生,导致机体氧化应激的出现,引发氧化应激与线粒体功能丧失的恶性循环,从而造成骨骼肌及脂质、蛋白质、DNA的氧化损伤[1],影响运动能力[5]。为适应氧化应激,ROS可诱导机体通过多条信号通路产生一系列的抗氧化酶,进而加快ROS的消除[6]。研究发现,NADPH氧化酶系统除诱导产生ROS外,在活化NF-κB信号通路的过程中亦发挥了关键作用,故推测该氧化酶系统可能在耐力运动中发挥潜在调节机体氧化应激水平的效应[4]。
NADPH氧化酶系统由6个亚单位组成,其中较大的亚单位gp91phox与较小的p22phox相结合,形成与膜相连的异二聚体细胞色素b558,作为NADPH和氧之间最终的电子传递 体[7],而细胞质蛋白 p47phox、p67phox、p40phox与Rac1则可调节gp91phox和p22phox的活性,并参与活性复合体b588的装配[8]。研究表明,p22phox亚单位与NADPH氧化酶的酶活性相关,是该氧化酶生成ROS的关键部位,其mRNA表达的上调可增加该氧化酶的活性[9]。人p22phox的编码基因CYBA位于染色体16q24,大小为8.5 kb,由6个外显子和5个内含子组成,多个位于外显子和启动子区的SNP位点被报道可影响基因表达和NADPH的氧化活性[10]。其中,C242T、A930G和A675T多态位点被研究最多。
C242T多态性发生于第4外显子,C→T多态可使第72位his被tyr取代,产生一个RsaⅠ酶切位点,而该部位是2个潜在的血红蛋白结合位点之一,故C→T突变会降低p22phox与血红素结合的能力,从而降低NADPH氧化酶的活性[11]。目前国内外对C242T多态性的研究多限于心、脑血管等大血管病领域,但不同种族、不同研究间得出的结论差别迥异[12]。Feairheller等[13]研究了有氧运动、高血压及CYBA多态性间的关系,发现氧化应激敏感指标——尿8-iso-PGF2α的基础水平在该位点不同基因型携带者间差异显著,其中TT型基础水平最低,CC型基础水平最高,且TT型比TC型和CC型携带者的血浆总抗氧化能力更好,表明T等位基因具有保护性作用。
多态位点A930G位于CYBA基因启动子区的一个CCAAT/增强子连接蛋白(C/EBP)转录因子潜在结合位点上。目前已知,该多态性可导致p22phox亚基的基因转录活性增加,且G等位基因的转录活性比A等位基因高30%[14]。研究发现,在西班牙、日本和巴西人中,A930G多态与原发性高血压患病风险显著相关[7],在中国人中该多态则被发现与缺血性脑血管疾病[15]相关,而与Ⅱ型糖尿病易感性间未见关联[13]。
多态位点A675T同样位于CYBA的启动子区[16],由于该位点位于一个潜在的HIF-1α转录因子结合位点,过量表达的HIF-1α可提高T等位基因的转录活性,由此推测T等位基因携带者的HIF-1α对p22phox氧化活性发挥了重要作用[17],TT基因型则被发现与原发性高血压及噬菌细胞内p22phox活性均显著相关[18]。
综上,鉴于大量研究已证实NADPH氧化酶系统在运动氧化应激中的作用,以及CYBA基因的C242T、A930G和A675T位点对NADPH氧化酶活性具有影响[3],故本研究选择这3个位点为目标SNP,通过比较优秀长跑运动员与普通人群中上述基因多态的分布特征,探讨其作为我国优秀长跑运动员选材用分子标记的可能性。
1 对象与方法
1.1 研究对象
本研究分为运动员组和对照组;运动员组选取优秀长跑运动员123人(年龄23.1±5.1 岁,身高169.3±7.5 cm,体重55.5±7.5 kg),均为汉族,运动专项分别为5 km/10 km或马拉松,运动等级均为健将以上级,来自东北三省、华北五省、河南、山东及安徽北部等地的平原地区。
对照组招募普通大学生127名(年龄21.5±1.3岁,身高173.4±4.8 cm,体重64.0±11.6 kg),均为汉族,均未经任何专业训练,正常参加体育活动,并体检合格,来自我国东北三省、华北五省、河南、山东等地平原地区。
为探索性别的影响,将运动员与对照组继续分为男性与女性亚组,其中男运动员组62人(年龄24.3±11.9岁,身高175.0±5.1 cm,体重61.5±4.8 kg),女运动员组61人(年龄20.8±5.3 岁,身高163.5±4.6 cm,体重49.5±4.0 kg),男对照组71人(年龄20.3±1.3 岁,身高175.0±5.5 cm,体重 69.2±11.2 kg),女对照组56人(年龄20.0±1.4 岁,身高163.0±5.1 cm,体重57.0±7.7 kg)。为探索运动专项的影响,将运动员分为5 km/10 km与马拉松组,其中5 km/10 km组31人(年龄22.3±8.6岁,身高170.1±6.3 cm,体重56.2±4.4 kg),马拉松组92人(年龄23.5±7.4岁,身高169.0±6.2 cm,体重54.5±6.8 kg),所有测试对象均知情同意。
1.2 静脉取血及全基因组DNA提取
常规方法取外周静脉血3 ml,分装后-20℃保存。采用Promega公司基因组DNA纯化试剂盒提取全血基因组DNA。
1.3 基因多态分析
根据文献研究报道[5,7-9]和SNP数据库资料,通过HapMap和Haploview软件分析,选取CYBA基因区的3个标签SNP位点:C242T、A930G和A675T。
SNP分型由上海邃志生物科技有限公司采用Sequenom公司的Mass ARRAY系统完成。PCR引物和单碱基延伸引物均由Assay Designer(Sequenom)软件包设计。以PCR扩增目的片段,采用针对SNP的单碱基延伸引物进行单碱基延伸反应。将终止反应物脱盐后点样到芯片上,并采用基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF)进行解析,最终结果由 Mass ARRAY RT软件系统(版本号 3.0.0.4)实时读取,并由Mass ARRAY Typer软件系统(版本号 3.4)完成基因的分型分析。
PCR反应体系为:DNA样本1 μl(5 ng/μl);PCR引物1 μl;dNTP 1 μl(2.5 mmol/L);MgCl20.325 μl(25 mmol/L);HotStar Taq酶 0.1 μl;PCR缓冲液0.625 μl;H2O 0.95 μl。PCR反应条件:94℃ 15 min;94℃ 20 s,56℃ 30 s,72℃ 1 min,共45个循环;最终72 ℃ 3 min。
PCR扩增后,剩余的dNTP被去磷酸。反应体系为:H2O 1.53 μl;SAP缓冲液0.17 μl;碱性磷酸酶(Sequenom) 0.3 U。反应条件:37℃ 40 min,85℃ 5 min。
单碱基延伸反应体系为:H2O 0.755 μl;10×iPLEX缓冲液0.2 μl;终止混合物0.2 μl、iPLEX酶0.041 μl;延伸引物 0.804 μl(10 μmol/L)。单碱基延伸反应条件:94℃ 30 s;94℃ 5 s,52℃ 5 s,80℃ 5 s,共40个循环;最后72℃ 3 min。
1.4 统计学处理
本研究的数据统计分析由SPSS 13. 0和SHEsis在线软件[10]完成。其中,采用χ2检验来检测每个位点的等位基因和基因型频率,并对运动员组和对照组进行哈温平衡检验。单个SNP在运动员组与对照组分布频率的差异采用χ2检验,不同位点进行两两间的LewontinD'和r2计算,并推算位点间连锁不平衡紧密程度。采用SHEsis软件对位于强连锁不平衡区的位点进行单体型频率分析。
2 结果
2.1 CYBA基因多态位点基因型解析结果
本研究采用MALDI-TOF技术对CYBA基因的SNPC242T、SNPA930G和SNPA675T位点基因型分型,检测成功率在运动员组和对照组中分别为100%及100%、98.4%及100%和100%及100%,取得了良好的分型结果。
2.2 CYBA基因多态位点的基因型频率和等位基因频率分布
经检测,优秀运动员组和对照组在SNPC242T、SNPA930G和SNPA675T位点的基因型分布均符合H-W平衡(P>0.05),表明本研究的各组研究对象均具有群体代表性。CYBA基因C242T和A930G单核苷酸多态位点的基因型和等位基因分布频率见表1、表2。运动员组与对照组在这两个多态位点的基因型和等位基因分布与对照组相比均无显著性差异(P>0.05)。性别分层统计结果显示,在不同位点上,男、女运动员组与男、女对照组间的基因型和等位基因分布也均无显著性差异(P>0.05)。
将运动员按不同运动项目进行分组并与对照组进行比较,结果发现在C242T多态位点,基因型和等位基因在对照组与5 km/10 km组间(χ2=4.71,P=0.03;χ2=4.29,P= 0.04)有显著性差异,基因型在5 km/10 km组与马拉松组间(χ2=4.09,P=0.04)也差异显著,而等位基因在上述二组间虽然差异不显著,但均有非常显著的变化趋势(χ2=3.67,P=0.06)。在A930G位点,各组间的基因型和等位基因频率则无显著性差异(P>0.05)。

Tab. 1 The distribution of genotype and allele frequencies of C242T polymorphism in CYBA gene
CG: Controlgroup; EEA: Elite endurance athletes
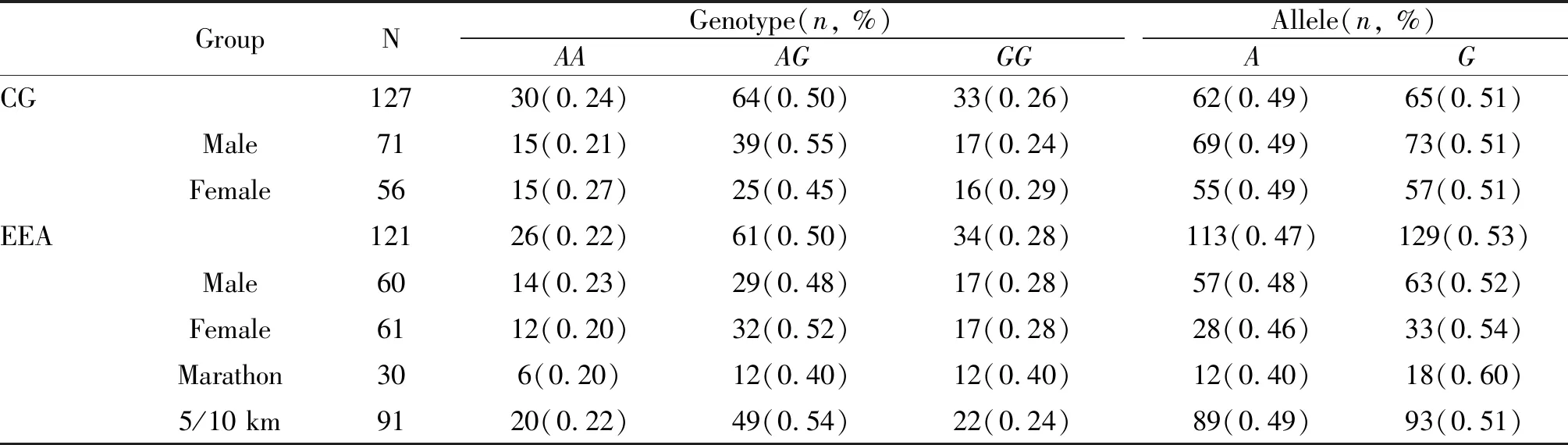
Tab. 2 The distribution of genotype and allele frequencies of A930G polymorphism in CYBA gene
CG: Controlgroup; EEA: Elite endurance athletes
在A675T位点,运动员组均为AA基因型和A等位基因携带者,对照组基因型分布为AA(99%)和AT(1%),等位基因分布为A(99.6%)和T(0.4%),各组间无显著性差异(P>0.05)。
2.3 连锁不平衡和单体型分析
对C242T和A930G位点进行D'和r2计算,结果显示,D'和r2值分别为0.309和0.006。经计算,主要存在4种单体型(小于0.03的基因型被忽略)。其中,各单体型在男、女对照组、男、女运动员组、男对照组与男运动员组及女对照组与女运动员组间的分布均无显著性差异(表3)。但单体型TC在对照组与健将组、对照组与5 km/10 km组的分布频率有显著性变化趋势(表4)。
Tab. 3 The distribution of haplotype frequencies ofCYBAgene in EEA and CG of different gender

C242TA930GCGMaleFemaleEEAMaleFemaleCC0.4860.4640.4290.406CT0.4510.4820.7410.504TC0.0000.0270.0460.053TT0.0630.0270.0540.037
CG: Controlgroup; EEA: Elite endurance athletes
Tab. 4 The Distribution of Haplotype Frequencies ofCYBAGene in EEA and CG

CGEliteInternationale EliteMarathon5 km/10 km groupCC0.4680.4220.4050.3830.435CT0.4730.4570.5480.5830.449TC0.0200.052∗0.0480.0170.054∗TT0.0390.068-0.0170.062
CG: Controlgroup
*P<0.10 TC haplotype in CGvsElite group and in CGvs5 km/10 km group
3 讨论
NADPH氧化酶是一类位于内皮细胞及血管内平滑肌细胞等细胞膜上的电子传递复合物,对体内信号通路的活化具有一定效应,同时也是ROS的主要产生来源,p22phox亚单位则与该氧化酶的酶活性息息相关[10]。NADPH氧化酶p22phox亚单位由基因CYBA编码。由于多项研究证实多态位点C242T、A930G和A675T可影响NADPH氧化酶的活性,因此本研究以这3个多态位点为研究对象,首次探讨了它们与优秀有氧耐力间的关联性。结果发现,优秀长跑运动员与普通人中A930G和A675T位点基因型和等位基因的分布频率均无显著性差异(P>0.05),将运动员按性别和运动项目分组后与对照组比较也未出现显著性差异,表明这两个位点与优秀有氧耐力素质无关,不能作为优秀长跑运动员的分子选材标记。而在C242T位点,基因型和等位基因的分布频率在对照组与5 km/10 km运动员组间差异有显著性(χ2=4.71,P=0.03和χ2=4.29,P=0.04)。在该项目运动员中,CC基因型和C等位基因均显著低于普通人,与“T等位基因具有保护性作用”[11]的结论一致,表明该等位基因携带者在运动中受到的氧化应激更轻微,抗氧化能力也更好,故可能更利于有氧耐力素质的提高。研究还发现,该位点各基因型分布频率在不同运动项目的运动员间差异显著,5 km/10 km组运动员中CC基因型分布频率显著低于马拉松组(77%vs94%),虽然等位基因在上述二组间的分布频率无显著性差异,但表现出非常显著的变化趋势(P=0.06),说明T等位基因对马拉松运动员的保护作用有限,该多态位点的基因型分布具有明显的项目差异,T等位基因可能是优秀5 km/10 km运动员成才的优势遗传标志,故可以考虑将等位基因T作为优秀5 km/10 km运动员分子选材的标记。但遗憾的是,尽管该结论与以往研究中关于T等位基因的保护效应相符,但本研究中所有受试者(对照组与运动员组)中均未发现TT纯合子表达,因此认为TC基因型才是北方汉族人中优秀5 km/10 km运动员的分子选材标记。有研究表明,跑距是影响马拉松运动员肌肉与淋巴细胞损伤的重要因素,由于马拉松运动员在一次训练或比赛中摄入的氧气约为安静时的10~15倍,因此产生的ROS比5 km/10 km运动员更多,造成的氧化应激也更严重[17],故推测T等位基因的保护性作用难以平衡长期大强度耐力训练对马拉松运动员造成的伤害,因此,该组运动员与对照组在该位点的基因型分布无显著性差异。
此外,本研究还发现,各单体型在对照组与运动员组中的分布频率差异不显著。事实上,由于样本量有限,本研究难以对不同项目、不同等级的运动员群体继续分级,因此无法确认单体型的分布频率是否对上述运动员亚群的精准选材具有实际意义,故未来需要进一步增加样本量,尤其是对照组的样本量来进行确认。特别需要说明的是,本研究与国内外多项研究结果进行了对比,发现本研究中的C242T、A930G和A675T位点不同基因型和等位基因频率与部分研究结果间均存在显著差异[7,14,15,18],但与其他以中国人特别是汉族为研究对象的研究则差异并不显著[16,19]。有研究者在近期的多项Meta分析中报道称,C242T多态性的T等位基因只在亚洲人中与较低的心血管疾病和急性冠脉综合征风险有关,对欧美人则无保护效应,表明种族差异可能是导致各研究结果间巨大差异的主要因素,而细胞学研究则证实C242T多态性并未造成蛋白质局部构象的改变,因此该多态对b558活性复合体的影响并非功能性的改变,而是通过影响其蛋白成熟度来调控ROS的生成数量。此外,鉴于T等位基因在不同种族间分布频率的巨大差异,迄今为止的相关meta分析结论也并不一致,从而表明研究策略、有效样本量、所研究的多态位点在目标人群中的分布频率——特别是次要等位基因频率(minor allele frequency,MAF)及研究人群的类型(即是否明确研究基于特定人群)等因素均会在一定程度上影响对多态性确切生物学效应的判断。而在本研究中,上述因素也可能是未发现这3个多态位点与有氧耐力间确切关联的原因。因此,要解决以上问题,就需要进一步丰富优秀耐力运动员的数量并优化基因位点的选择。而在现阶段,本研究的结论虽然尚未经更多研究的检验,但CYBA基因作为影响运动员在运动氧化应激中适应性的重要因素,其多态性与优秀有氧运动能力间的潜在关联值得关注。鉴于TC基因型对优秀5 km/10 km运动员的潜在选材价值与已知C242T多态性在功能和效应机制等方面的自洽,因此有理由相信该多态与运动员的杰出有氧耐力素质相关,而在更大优秀耐力运动员样本中对TC基因型显著性的验证及其选材效果的实证检验将是我们未来研究的主要方向。
综上所述,NADPH氧化酶p22phox亚单位基因的A930G和A675T位点不能作为我国汉族优秀长跑运动员的分子选材标记,C242T位点的TC基因型可用于优秀5 km/10 km运动员的分子选材。

