复合菌种发酵法提高发芽糙米中γ-氨基丁酸
范媛媛 丁俊胄,2 熊善柏 许绰微 赵思明
(华中农业大学食品科学技术学院1,武汉 430070) (美国伊利诺伊大学香槟分校食品科学与人类营养学系2,厄巴纳 61801)
γ-氨基丁酸(Gamma Aminobutyric Acid, GABA)作为人体内重要的抑制性神经递质,在降低心血管疾病[1-2]、高血压[3]、缓解焦虑[4],改善神经感知功能、延缓记忆力衰退等方面具有功效[5-7]。
通过谷物种子萌发及对新鲜植物幼芽、叶片进行缺氧处理可生产出高GABA浓度的天然食品。糙米在发芽3 d后GABA含量得到显著提升,在发芽后期进行缺氧胁迫处理则使含量进一步提高[8-10]。除此以外,化学合成法和微生物发酵法均可制备高纯度的GABA。采用微生物制备GABA反应条件易于控制,目前已有用大肠杆菌[11-15]、乳酸菌[13-14]、酵母[15]以及霉菌[16-17]等微生物发酵制备GABA的报道。利用微生物体内代谢的谷氨酸脱羧酶(Glutamate decarboxylase, GAD; EC 4.1.1.15)为催化酶,以食品级谷氨酸或谷氨酸钠盐作为主要底物经谷氨酸脱羧反应制备GABA。
糙米中内源性淀粉酶和蛋白酶在发芽过程被激活,将淀粉和蛋白质等大分子水解[18],水解产生的小分子糖等营养组分可以被乳酸菌和酵母菌利用[19]。已有研究发现乳酸菌与酵母菌之间存在代谢产物共生与互补效应,酵母菌代谢产物可以刺激乳酸菌活动,为乳酸菌提供营养物质,乳酸菌水解产物则为酵母菌提供丰富的营养来源[20-22]。
本实验采用发芽糙米为发酵底物,以短乳杆菌、卡斯特酒香酵母为发酵菌种,研究初始pH、接种量、发酵温度、发酵时间,及菌株配比对GABA发酵产量的影响,优化了复合发酵法强化GABA的工艺条件,并初步探究乳酸菌和酵母菌的共生现象,为利用糙米发芽与发酵制备高浓度GABA食品提供工艺参考。
1 材料与方法
1.1 材料与试剂
短乳杆菌(Lactobacillusbrevis)L2,由中国科学院微生物研究所提供。
卡斯特酒香酵母(Brettanomycescustersii)ZSM-001,本实验室从米浆的发酵液分离得到,其保藏号为CCTCC NO: M207150。
稻谷原料为“黄花占”水稻品种:湖北黄冈东坡粮油集团有限公司。
L-谷氨酸、L-亮氨酸葡萄糖、蛋白胨、酵母膏、琼脂、柠檬酸二胺、乙酸钠、壳聚糖。
1.2 仪器与设备
植物气候培养箱;FE20型实验室pH计;台式离心机;722型分光光度计;JMS-50胶体磨。
1.3 方法
1.3.1 发酵液的制备
将活化菌种接种到液体培养基中,培养24-48 h,得到菌种的扩大培养液,按所需体积比加入发酵培养基,得到发酵液。分别取不同发酵时间的发酵液,发酵液经过高速离心机离心,收集清液,向清液中加入0.25 g/L的壳聚糖,搅拌后得絮凝液,将所得的絮凝液过滤,得过滤液,即发酵液粗液。
发酵液粗液中加入1 %(质量比)活性炭,混合均匀后于70 ℃下搅拌30 min,过滤后得到未纯化的GABA溶液,将未纯化的GABA溶液于25 kPa压力下浓缩60 min,使浓缩液体积约为浓缩前的1/3,得浓缩的GABA溶液,将浓缩的GABA溶液于90 ℃下灭菌40 min,得高浓度液态GABA。
1.3.2 发芽糙米的制备
选择实验用小型垄谷机去掉谷壳制备糙米,参考丁俊胄等[8]报道的发芽条件并采用课题组自行设计改装的水雾供湿通气培养装置[23]制备发芽糙米。
1.3.3 乳酸菌发酵培养基
菌株的活化培养基(即:改良MRS培养基,以g/L计):蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L,琼脂15 g/L,葡萄糖5 g/L,乙酸钠2 g/L,柠檬酸二胺2 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.05 g/L,用于菌种的活化。
发酵种子培养基(即GYP种子培养基,以g/L计):胰蛋白胨5 g/L,葡萄糖10 g/L,酵母膏5 g/L,丁二酸钠5 g/L,用于菌种发酵种子的制备。
发酵培养基(以g/L计):将发芽糙米加水,使谷物与水的体积比为1∶10,用胶体磨磨浆,在浆液中加入L-谷氨酸钠60 g/L、葡萄糖50 g/L,用于发酵合成GABA。
1.3.4 酵母菌发酵培养基
菌株的活化培养基(即YEPD培养基,以g/L计):葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,用于菌株的活化。
发酵种子培养基(以g/L计):葡萄糖30 g/L,蛋白胨30 g/L,硫酸铵3 g/L,KH2PO41 g/L,用于菌株发酵种子的制备。
发酵培养基(以g/L计):将发芽糙米加水,使谷物与水的体积比为1∶10,用胶体磨磨浆,在浆液中加入L-谷氨酸钠60 g/L、葡萄糖50 g/L,用于发酵合成GABA。
1.3.5 GABA含量的测定
根据Berthelot显色反应原理,参考姚森等[24]报道的比色法测定GABA含量。
1.3.6 GAD活性的测定
按照1.3.1中描述的菌种发酵的工艺流程,分别取不同发酵时间的发酵液,将发酵液在4 000 r/min下离心10 min,过滤后的上清液即为粗酶液。参考丁俊胄等[8]报道的方法测定GAD活性。
取0.3 mL粗酶液与0.2 mL底物反应液(含50 mmol/L的磷酸缓冲液(pH 5.7)、0.2 mmol/L 磷酸吡哆醛(Pyridoxal phosphate,PLP),100 mmol/LL-谷氨酸)置于10 mL比色管中,于30 ℃水浴锅里保温2 h后迅速冰浴终止反应,同时取0.3 mL蒸馏水与0.2 mL底物反应液做空白对照,采用1.3.5中比色法测定GABA的含量。
酶活计算方法为:(酶反应生成的GABA含量-空白中GABA含量)/反应时间。
以每分钟生成1 μmol GABA所需要的酶量为一个谷氨酸脱羧酶活力单位(U)。
1.3.7 适宜培养基初始pH的确定
设定培养基初始pH,按体积比4%的接种量接入种子液,乳酸菌在30 ℃下发酵培养60 h(酵母菌发酵培养96 h),测定不同pH下发酵液中GABA的含量。
1.3.8 适宜接种量的确定
乳酸菌设定培养基初始pH 4.5(酵母菌设定培养基初始pH 5.5),分别按不同体积比接入种子液,于30 ℃温度下发酵培养60 h(酵母菌发芽培养96 h),测定不同接种量下发酵液中GABA的含量。
1.3.9 适宜发酵温度的确定
乳酸菌设定培养基初始pH 4.5(酵母菌设定培养基初始pH 5.5),按体积比4 %的接种量接入种子液,分别在不同发酵温度下发酵培养60 h(酵母菌发酵培养96 h),测定不同发酵温度下发酵液中GABA的含量。
1.3.10 适宜发酵时间的确定
乳酸菌设定培养基初始pH 4.5(酵母菌设定培养基初始pH 5.5),按体积比4%接种量接入种子液,于30 ℃下发酵培养,测定不同发酵时间下发酵液中GABA的含量。
1.3.11 发酵法条件的正交实验设计
根据单因素实验结果,选取接种量、发酵培养时间和培养温度3个因素,每个因素确定3个水平,不考虑交互作用,选用L9(34)进行正交实验,见表2。
1.3.12 复合菌种对发酵的影响
将发芽糙米加水(发芽糙米∶水=1∶10,V/V)磨浆,向浆液中加入L-谷氨酸钠60 g/L、葡萄糖50 g/L,按体积比为4%的接种量向浆液中接种复合菌种(乳酸菌和酵母菌),乳酸菌∶酵母菌(数量比)=1∶1时,搅拌混匀后于30 ℃下密封发酵90 h,得含GABA的发酵液。在用复合菌种发酵富集GABA过程中设计了不同的菌种和配比,以探索复合菌种对发酵液GABA含量的影响。按待发酵浆液体积为1 L,实验设计见表1。

表1 菌种配方设计
1.3.13 数据处理
各组实验重复3次,用SAS 8.1统计软件(SAS Software Institute, Cary, NC,USA)进行统计分析,显著性差异检测限设定为P=0.05。
2 结果与分析
2.1 发酵过程GABA的累计
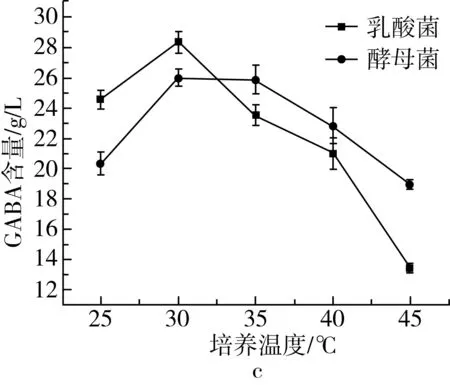
不同培养条件下,发酵过程GABA的积累曲线见图1。由图1a可知,乳酸菌在培养基初始pH为4.5时,发酵液中GABA的含量达到最大值。而酵母菌在培养基初始pH 5.5时,菌种发酵制备的发酵液中GABA的含量达到最大值。由于GAD蛋白分子上含有许多酸性或碱性的侧链基团,较高或较低的pH都可能影响GAD蛋白分子的构象,使侧链基团电解,降低GAD的活性,从而对GAD与L-Glu结合的能力产生影响[25],使GABA累计量降低。接种量对乳酸菌和酵母菌产GABA的影响结果见图1b。随着接种量的增加,微生物代谢产生的GAD活性增强,GABA累积量逐渐增加。当乳酸菌和酵母菌接种量均大于4%时,随着底物的减少,接种量增大并没有显著增加发酵液中GABA的含量。发酵培养温度对乳酸菌和酵母菌产GABA的影响结果见图1c。当乳酸菌和酵母菌发酵温度为30 ℃时,发酵液中GABA的含量最高。
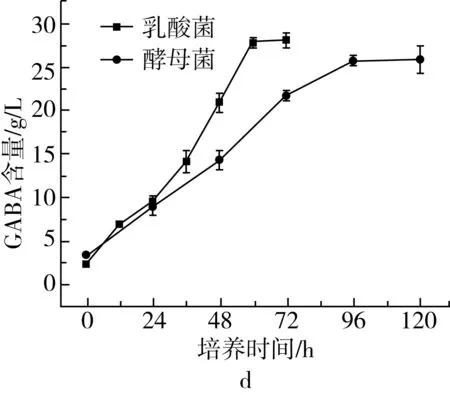
发酵培养时间对乳酸菌和酵母菌产GABA的影响结果见图1d。随着培养时间的延长,GABA累积量逐渐增加。乳酸菌发酵法制备 GABA的最适发酵时间为60 h,酵母菌最适发酵时间为96 h。
发酵制备GABA的正交实验结果及分析见表2、表3。影响乳酸菌发酵液中GABA含量的因素主次为B(培养时间)>C(培养温度)>A(接种量),接种量的3个水平对菌种发酵制备的发酵液中GABA的含量有影响(0.05 影响酵母菌发酵液中GABA的含量的因素主次为C(培养温度)>B(培养时间)>A(接种量),接种量的3个水平对发酵液中GABA的含量有影响(0.05 图1 培养条件对GABA积累量的影响 由表2和表3可知,乳酸菌发酵制备GABA的最佳工艺组合为A2BR2C1,即乳酸菌的接种量为4%,于30 ℃温度下发酵60 h。而酵母菌发酵制备GABA的最佳工艺组合为A2BJ2C1,即接种量为4%,于30 ℃温度下发酵培养96 h。由于乳酸菌和酵母菌的共生作用,本实验所制备的发酵液中,GABA的含量高于现有报道中采用酵母菌发酵制备的GABA产品浓度(3~5 g/L)[26]。 表2 正交实验设计及结果 注:BR代表乳酸菌,BJ代表酵母菌。 表3 正交实验方差分析表(F/P) 乳酸菌和酵母菌复合菌种的配比对菌种发酵产GABA的影响如图2所示。随着酵母菌的增加,GABA含量呈现先增加后逐渐降低的趋势。在复合菌种各配比中又以乳酸菌和酵母菌复合菌种的体积比为2∶1时(乳酸菌液27 mL,酵母菌液13 mL),发酵液中转化富集所得的GABA的含量最高,为33.25 g/L,而使用单一菌种乳酸菌或酵母菌发酵制备的发酵液中GABA的含量分别为27.79 g/L和22.04 g/L。由此可见,复合菌种发酵法比单独使用乳酸菌或酵母菌发酵制备GABA分别提高了19.6%和50.8%。 由图3可知,乳酸菌发酵48 h时,GAD活性达到了峰值,发酵培养48 h后,GAD活性开始下降(图3a)。在发酵0~60 h范围内,GABA的生成量大于消耗量,因此GABA含量不断地积累,直到60 h达到最高值。随着底物的不足,GABA生成量和消耗量达到平衡,GABA含量趋于平衡(图3b)。 酵母菌发酵72 h时,GAD活性达到最大值,此后继续发酵,GAD的活性随着发酵时间的延长显著降低。在发酵时间为24~96 h范围内,发酵液中GABA的含量随着发酵时间的延长显著增加,在发酵时间为96~120 h范围内,随着发酵时间的延长,发酵液中GABA的含量并没有显著性变化。 乳酸菌和酵母菌共生发酵72 h时,GAD活性达到最大值。在发酵72 h后,GAD活性显著降低,在发酵时间为24~96 h范围内,发酵液中GABA含量显著性增加,但在96~120 h间并没有显著变化(图3b)。乳酸菌和酵母菌之间存在的代谢产物互补效应[21,27],使得发酵液中产GABA含量比单独使用乳酸菌或酵母菌高。 图2 菌种配比对菌体产GABA的影响 注:乳酸菌培养条件:pH 4.5,接种量4 %,温度30 ℃;酵母菌培养条件:pH 5.5,接种量4%,温度30 ℃;复合菌种培养条件:复合菌种比例:2∶1,接种量4%,温度30 ℃。图3 发酵过程中GABA(a)的累计及GAD(b)酶活性的动态变化 发芽糙米经短乳杆菌L2和酵母菌(ZSM001)复合发酵,比单用短乳杆菌和卡斯特酒香酵母发酵分别提高19.6%和50.8%,本研究表明,将乳酸菌和酵母菌复配具有良好的协同共生效应,适宜的发酵工艺为:当短乳杆菌和卡斯特酒香酵母复合菌种的体积比2∶1,接种量4%,于30 ℃温度下培养90 h,发酵转化所得GABA的含量最高达33.25 g/L。乳酸菌和酵母菌以适当比例在发酵液中共生时,代谢过程呈现一定互补,微生物体内谷氨酸脱羧酶的活性增强,促进了GABA积累。


2.2 发酵液乳酸菌和酵母菌的共生效应



3 结论

