高效降解茶皂素菌株的分离鉴定及其发酵优化研究
任泽文 肖志红 吴 红 张爱华 赵梦瑞 彭映辉 黎继烈
(中南林业科技大学生物技术湖南省重点实验室1,长沙 410004) (湖南省林业科学院2,长沙 410004) (湖南粮食集团有限责任公司3,长沙 410083) (南开大学化学院4,天津 300071)
油茶(Camelliaoieifera),山茶科山茶属,为常绿小乔木或灌木,是我国南方主要的一种木本食用油料树种[1]。油茶加工后产生了大量的油茶饼粕,未能得到充分的利用[2]。油茶饼粕营养丰富,蛋白质质量分数大于15%,适合作为微生物发酵的基质[3-5]。油茶饼粕中的茶皂素质量分数一般在15%~25%,还存在少许的单宁、植酸等抗营养成分,导致其在饲料方面的应用受到一定的限制[6]。因此,寻求一种高效、安全的降解油茶饼粕中茶皂素的新方法尤为重要。利用微生物降解油茶饼粕中的茶皂素具有安全、高效、环保的优点,因此越来越受到研究人员的关注。目前,国内已有部分细菌和真菌被应用于茶皂素的降解研究上,如地衣芽孢杆菌(Bacilluslicheniformis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、枯草芽孢杆菌(Bacillussubtilis)、铜绿假单胞菌(Pseudomonasaeruginosa)和桔青霉(Penicilliumcitrinum)等菌种,降解率在60%~75%之间[7-11]。本研究旨在筛选到能够更高效降解茶皂素的菌株,探究其固态发酵降解油茶饼粕中茶皂素的条件,为提高油茶饼粕的利用提供参考。
1 材料与方法
1. 1 材料
油茶饼粕:湖南省林业科学院提供,105 ℃烘干粉碎后过40目筛,茶皂素含量为13.8%;
1.1.1 培养基
真菌分离培养基[12]:葡萄糖2%,琼脂2%,KH2PO40.1%,MgSO4·7H2O 0.1%,链霉素30μg/mL,pH自然。
PDA培养基:去皮马铃薯200 g, 葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL,pH自然。
PDA液体培养基:去皮马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,pH自然(添加20颗小玻璃珠)。
油茶饼粕发酵培养基:30 g油茶饼粕,24 mL蒸馏水,pH自然。做法:30 g油茶饼粕添加24 mL蒸馏水在不锈钢盆子里拌匀并覆盖一层保鲜膜,静置30 min,使油茶饼粕与水混合均匀后装进组培瓶中,121 ℃灭菌20 min。
1.1.2 试剂与仪器
无水乙醇、香草醛、浓硫酸、氯化钠等均为分析纯;真菌DNA试剂提取盒;CJ-1D洁净工作台;高速万能粉碎机;SPX智能型培养箱;电热鼓风干燥箱;自动高压灭菌锅;PHS-3C精密酸度计;V-5100型紫外可见分光光度计。
1.2 实验方法
1.2.1 茶皂素含量及其分析方法
茶皂素的提取方法采用微波辅助法[13],测量方法采用香草醛-浓硫酸显色法[14]。
1.2.2 降解茶皂素菌种的筛选
初筛:取自然发酵的油茶粕,准确称取10 g样品用90 mL无菌水稀释并震荡20 min,梯度稀释涂布到分离培养基上,30 ℃培养3 d,根据单菌落大小、表面结构、质地、光泽和颜色等特征,挑选形态特征差异明显的单菌落进行划线纯化,编号并保存。
复筛:将实验所得菌株接种于PDA液体培养基中,30 ℃培养1 d后接种至油茶饼粕培养基中,30 ℃固态静置发酵,发酵72 h后测量茶皂素的含量,计算其降解率,并判断菌株降解茶皂素能力的强弱。
1.2.3 菌株的鉴定
1.2.3.1 菌株的形态学鉴定
按照《真菌鉴定手册》[15]和《中国真菌志》[16]的方法,将L-2菌株的孢子接种于PDA培养基平板上,30 ℃培养,分别于第 5天和第 10天观察菌落的颜色、质地、表面纹饰和生长速度等特征。
1.2.3.2 菌种的ITS鉴定
从 PDA培养基上轻轻刮取培养5 d左右的菌落边缘菌丝体5 mg,将其用液氮研磨成粉末状。采用真菌DNA提取试剂盒提取供试菌株DNA,引物:ITS1(5′-TCCGTAGGTGA ACCTGCGG-3′)和 ITS4(5′-TCCTCCGCTTATTGAT ATGC-3′)扩增产物由上海生工生物工程有限公司测序,测序结果在GenBank 中进行 BLAST 相似性比对,最后用MEGA 6.0的Neighbor-Joining构建系统发育树。
1.2.4 培养条件优化的单因素实验
1.2.4.1 种子液的培养
将筛选出的菌种接种至PDA液体培养基中,培养温度为30 ℃、转速为180 r/min,恒温摇床培养18 h,作为发酵种子液备用。
1.2.4.2 固态发酵的初始条件
将油茶饼粕培养基进行灭菌处理后,接种10%的种子液,发酵温度为30 ℃,发酵时间为72 h。
1.2.4.3 发酵时间选择
在其他条件不变的情况下,设置发酵温度为30 ℃,初始含水量为80%,设置不同的发酵时间分别为12、24、36、48、72、96、120 h,之后检测茶皂素的降解率。期间每隔12 h摇瓶翻样1次,每个处理重复3次。
1.2.4.4 发酵温度选择
在其他条件不变的情况下,选择最优的发酵时间,其他条件与处理同1.2.4.3,设置发酵温度为24、26、28、30、32、34、36 ℃。
1.2.4.5 初始含水量选择
在其他条件不变的情况下,选择最优的发酵时间和发酵温度,其他条件与处理同1.2.4.3,设置初始含水量分别为为60%、70%、80%、90%、100%、110%、120%。
1.2.4.6 初始加酸量选择
在其他条件不变的情况下,选择最优的发酵时间、发酵温度和初始含水量,其他条件与处理同1.2.4.3,设置不同的初始加酸量分别为0.01 mol/L的HCl 2、4、6、8、10 mL。
1.2.5 黑曲霉降解油茶饼粕中茶皂素的条件响应面优化
在单因素实验基础上,采用Box-Bnhnken响应面法进行优化分析,设计温度、时间和初始加酸量3个因素,每个因素取3个水平,以(-1,0,1)编码,根据相应的实验后,运用Design Expert 软件对所得的数据进行二次回归拟合后得到二次回归方程,然后对各因素的主效应和交互效应进行分析,得到最优解,优化发酵条件并进行验证,最终确定利用黑曲霉降解茶皂素的最优的发酵条件。
2 结果与分析
2.1 样品的筛选结果
通过初筛得到6株目标菌种,经过复筛后得到目的菌株的降解率,目的菌种对油茶饼粕中的茶皂素的降解率如图1所示,各菌株的降解率有较大的差异。

图1 目的菌种对油茶饼粕中的茶皂素的降解率
本研究中的菌株来源于自然筛选,对于油茶饼粕中的茶皂素具有天然的降解优势,黑曲霉L-2在自然条件下的降解率达到了60%以上,对比其他的菌种来说,菌种具有一定的优势性;固态发酵相比于液态发酵在降解油茶饼粕中的茶皂素更具有优势,推测可能的原因是黑曲霉L-2是丝状真菌,在固态发酵中能够使油茶饼粕起到蓬松多孔的状态,增大了菌种接触营养和氧气的作用,液态发酵对于不溶于水的油茶饼粕的传质传氧有一定的限制作用。因此选取降解率最高的L-2作为后续实验的菌种。
2.2 苗种的形态学和分子鉴定
菌株L-2的平板培养正面形态图(左)和平板反面形态图(右)如图2所示。0 ℃恒温培养L-2,培养初期,培养基表面长出质地疏松的较干燥的白色菌落,外观形如丝状小绒毛,与培养基的结合比较紧密。5 d后,表面开始出现黑色孢子,均匀分布在菌落中间成熟部分。菌株L-2 rDNA-ITS序列同源性系统发育树如图3所示,菌株L-2的rDNA-ITS序列与黑曲霉AspergillusnigerHQ305563.1相似性达到了99%,结合形态学特征鉴定为黑曲霉Aspergillusniger。

图2 菌株L-2的平板培养正面形态图(左)和平板反面形态图(右)
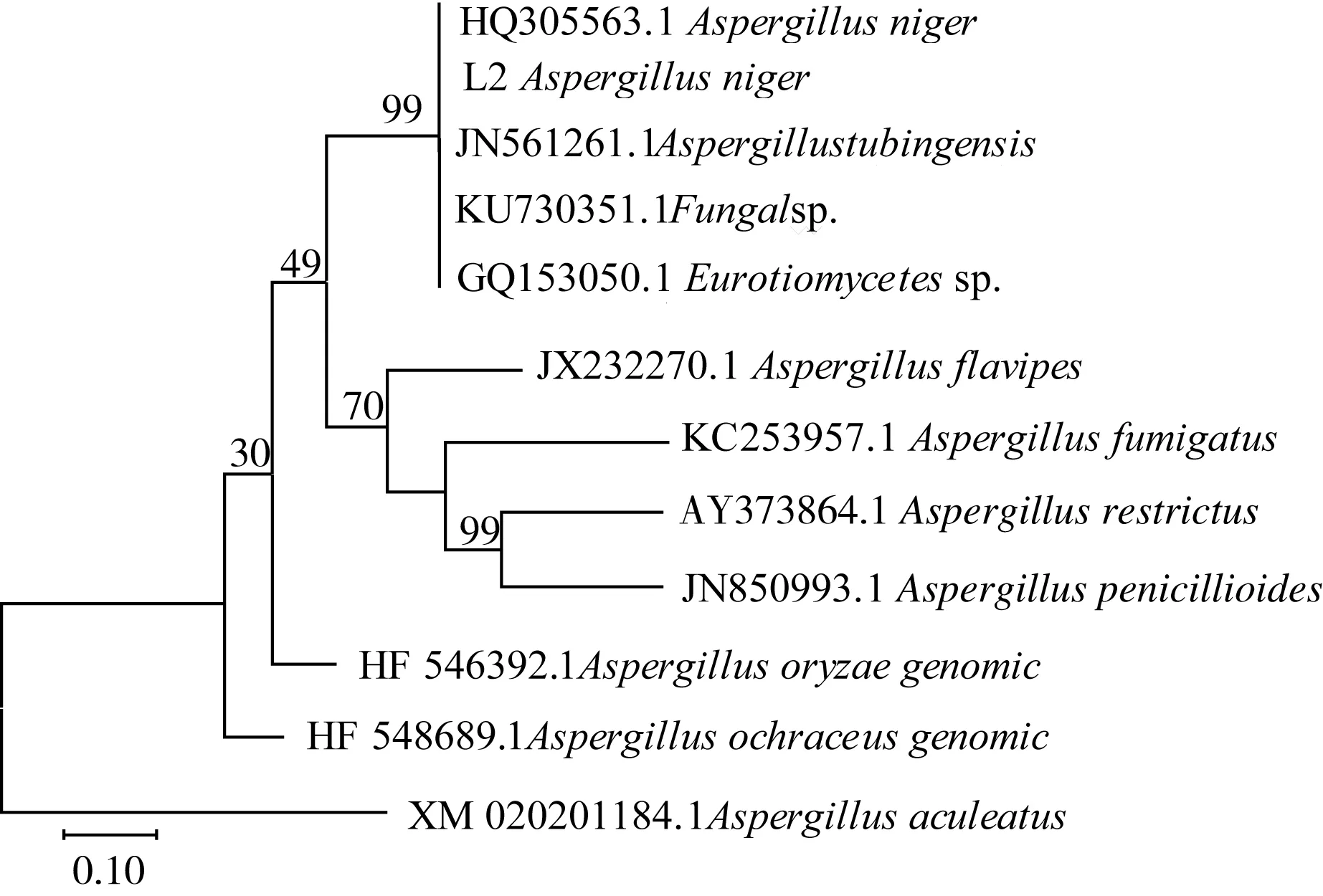
图3 菌株L-2 rDNA-ITS序列同源性系统发育树
2.3 培养条件的优化
2.3.1 发酵时间对菌种降解茶皂素的影响
发酵时间对菌种降解茶皂素的影响如图4所示。发酵前期,随着时间的推移,降解率在逐步提高;96 h后,茶皂素的降解率趋于稳定,达到88.33%。在油茶饼粕发酵初期,由于黑曲霉可以产生一些活性酶,如蛋白酶、脂肪酶、淀粉酶以及纤维素酶等,可以利用其产生的酶对油茶饼粕中大分子的营养物质进行降解,有助于黑曲霉L-2的生长。发酵中期由于营养物质的消耗,茶皂素作为营养物质提供菌体生长的需要,因此发酵中期茶皂素的降解率在不断的上升。发酵后期,油茶饼粕中的营养物质由于大量消耗,不足以为黑曲霉L-2的生长提供保障,茶皂素的降解率也趋于稳定的状态。

图4 发酵时间、发酵温度、初始含水量以及初始加酸量对于茶皂素降解率的影响
2.3.2 发酵温度对菌种降解茶皂素的影响
发酵温度对菌种降解茶皂素的影响如图4所示,随着温度的升高,茶皂素的降解率一直在升高,在32 ℃时,茶皂素的降解率达到了最大值86.12%。温度高于32 ℃后,茶皂素的降解率下降的趋势很明显。温度对于菌株降解茶皂素的影响比较显著,因此选择最佳的降皂温度为32 ℃。
2.3.3 初始含水量对菌种降解茶皂素的影响
初始含水量对菌种降解茶皂素的影响如图4所示,随着含水量的不断增加,茶皂素的降解率在不断的升高,在含水量在80%的时候达到最大88.15%。在含水量超过80%以后,茶皂素的降解率持续降低。固态发酵中,氧传递对于菌体的生长有至关重要的作用。含水量在80%以下,油茶饼粕培养基呈现一种疏松、多孔的状态,这对于氧气的传递有一定的促进作用;而随着含水量的升高,固体培养基越来呈现一种紧密的状态,影响氧的传递。含水量太低也会导致菌体生长缺水分而不能大量的生长,进而影响茶皂素的降解。因此选择80%的含水量作为最适含水量。
2.3.4 初始加酸量对菌种降解茶皂素的影响
初始加酸量对菌种降解茶皂素的影响如图4所示,随着加酸量的不断增加,茶皂素的降解率在不断的升高,在加酸量在4 mL的时候达到最大89.31%。在加酸量超过4 mL以后,茶皂素的降解率持续降低。霉菌的最适生长环境为酸性条件,因此,添加一定的酸可以促进黑曲霉的生长,同时可以抑制其他有害微生物的生长,提高了茶皂素的降解率。初始加酸量超过4 mL以后,降解率随着酸的量的增加而降低,推测降解茶皂素的酶最适pH在加酸量4 mL附近,此时的pH=4.58。
2.3.5 响应面分析方案和实验结果
单因素实验分别从发酵时间、发酵温度、初始加酸量和含水量分析了不同的因素对于黑曲霉L-2降解油茶饼粕中的茶皂素的影响,为了更加准确简便地分析不同因素对降解茶皂素的交互影响,结合单因素实验的结果进行分析,选取对结果影响较大的3个因素发酵温度(A)发酵时间(B)初始加酸量(C)进行Box-Bnhnken实验设计,以茶皂素的降解率(Y)为响应值在全局范围内进行寻优,实验设计及结果,Box-Behnken实验因素与水平表见表1和Box-Behnken实验设计与结果见表2。

表1 Box-Behnken实验因素与水平表
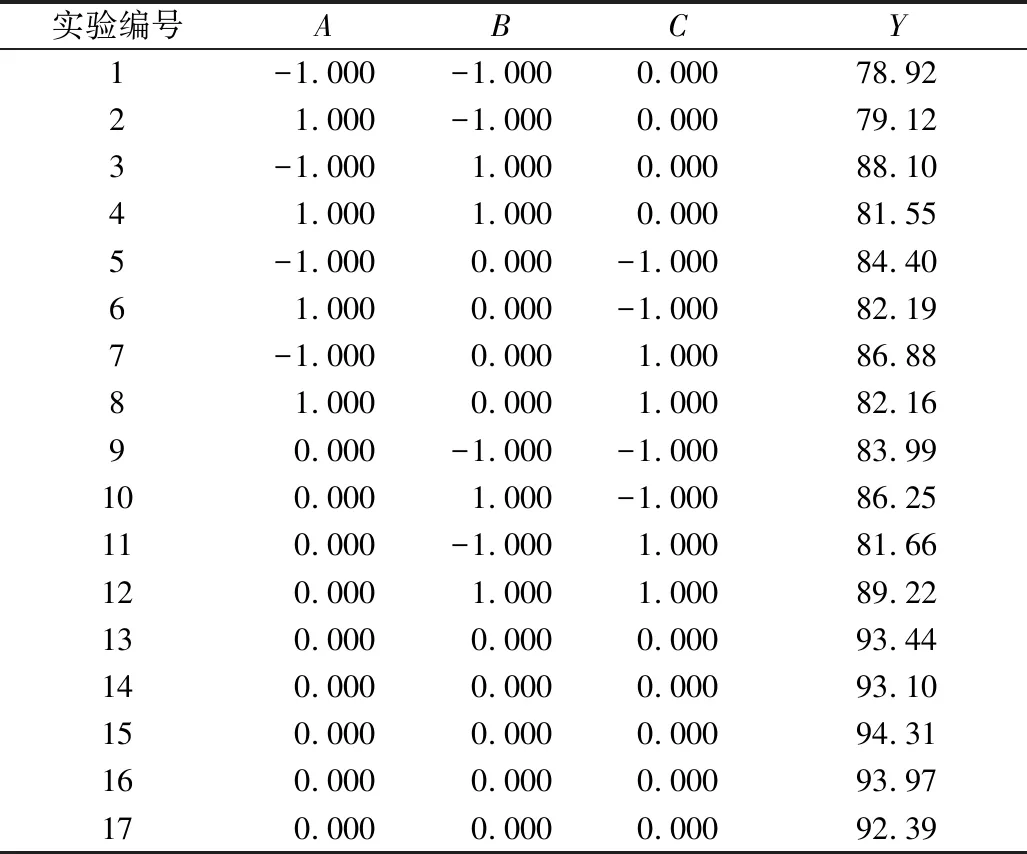
表2 Box-Behnken实验设计与结果
回归模型方差分析见表3。应用Design-Expert 10.0.8软件对表2和表3中的结果进行二次回归分析,得到降解茶皂素的二次回归方程模型。由表3可知,从各个因素的显著性水平差异可知,对茶皂素的降解率的影响次序为B>A>C;二次项A2、B2、C2对茶皂素的降解率的影响都达到了极显著水平(P<0.001)。模型P<0.000 1,表明回归模型极显著,其校正决定系数AdjR2=98.46%表明仅有总变异的1.54%不能由该模型进行解释。相关系数R2=99.33%,表明该模型拟合程度较好,实验误差较小,失拟项不显著,回归方程可以较好地描绘各因素与响应值之间的真实关系。

表3 回归模型方差分析
注:**为极显著(P<0.01),*为显著(P<0.05),R2=99.33%,AdjR2=98.46%。
所得的二次多项回归拟合方程为:
茶皂素降解率=93.44-1.66A+2.678B+0.39C-1.69AB-0.63AC+1.32BC-6.45A2-5.07B2-3.09C2
根据方程得到的模型极值点取值为A=-0.177B=-0.313C=0.147,此时响应值Y的取值为最大值94.036%,即发酵温度31.293 ℃,发酵时间103.507 h,初始加酸量4.574 mL,为方便操作,发酵时间取31.3 ℃,发酵时间取103.5 h,初始加酸量为4.57 mL。
2.3.6 验证实验
利用正交实验所得到的数据进行培养基的配制,用响应面实验的结果作为发酵条件,重复3组实验进行茶皂素的降皂实验,实际测得降解率为93.96%,与预测值接近,说明回归模型真实可靠。
3 结论
单因素和响应面的分析结果表明:发酵温度、发酵时间、初始加酸量3个主要因素对黑曲霉L-2降解油茶饼粕中茶皂素有显著的影响,影响的大小为:发酵时间>发酵温度>初始加酸量。黑曲霉降解油茶饼粕中茶皂素的最佳条件为发酵时间取31.3 ℃,发酵时间取103.5 h,初始加酸量为4.57 mL,此条件下可使黑曲霉L-2对于油茶饼粕种的茶皂素有最佳的降解率,达到93.96%。

