Skp1蛋白在非小细胞肺癌组织和外周血中的表达水平及其临床意义
朱嘉微,胡 箫,王希君,王雅茹,冯 林,肖 汀*
(国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室,癌发生及预防分子机理北京市重点实验室,北京 100021)
目前肺癌仍是世界上癌症死亡的主要原因,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%。虽然目前针对肺癌的早期筛查手段越来越多,但多数NSCLC患者(约占75%)在确诊时已经处于中晚期,其癌组织已经发生转移,即使通过手术切除,患者预后仍不乐观[1]。研究显示,大部分中晚期NSCLC患者的中位生存期为8~12个月[2]。因此,我们需要综合评估中晚期NSCLC患者的预后,找到中晚期NSCLC发生发展的相关基因,从而筛选出潜在的预后评估指标。
在过去的十年间,泛素蛋白酶体系统已经成为开发新型抗癌疗法的有效药物靶点[3-5]。泛素蛋白酶体途径是蛋白质水解的主要途径。泛素级联反应由一系列酶如E1、E2和E3催化而成,其中E3泛素连接酶负责靶蛋白的选择[6-7]。泛素连接酶复合物(Skp1-Cullin-F-box,SCF)是由稳定亚基Skp1、Cul1、环指蛋白ROC/Rbx1和可变F-box共4部分组成[8]。S期激酶相关蛋白1(S-phase kinase-associated protein 1,Skp1)是SCF泛素连接酶复合体的特异性底物识别亚单位F-box家族的成员之一,在胚胎、宫颈、淋巴细胞、成骨细胞等不同类型的细胞和组织中普遍表达[9]。Skp1可以稳定F-box蛋白、增强底物结合能力[10]、参与细胞周期调控[11],与肿瘤的发生发展密切相关[12]。已有研究证明SCF复合物在肿瘤的发生中起着关键作用,并且一些F-box蛋白已被证明是治疗人类癌症的潜在靶点[13]。然而,关于Skp1在NSCLC中的研究还比较少,其是否可以作为肺癌治疗靶点仍待进一步研究。因此,本研究通过检测Skp1在NSCLC组织和外周血中的蛋白水平,分析其与NSCLC临床病理指标及患者预后的关系,为Skp1在临床上的应用提供一定的理论依据。
1 材料与方法
1.1 临床样本
本研究所用组织芯片共包含非小细胞肺癌及其癌旁组织样本各86例,其中用于Western blot检测的NSCLC及其配对的癌旁样本各34例。本研究用于ELISA实验的NSCLC血浆样本39例。上述样本均来自于中国医学科学院肿瘤医院胸外科2014年7月—2016年10月收治的患者,随访时间截止为2018年12月。本研究中ELISA试验所用健康人血浆样本共27例,来自中国医学科学院肿瘤医院体检人群。所有样本均取得研究对象的知情同意。
1.2 主要试剂
Skp1小鼠单克隆抗体购于美国Santa Cruz公司;β-actin小鼠单克隆抗体购于英国Abcam公司;山羊抗鼠IgG HRP二抗(Western blot)、蛋白提取试剂盒购于北京普利莱基因技术有限公司;蛋白定量试剂盒(BCATMprotein Assay Kit)购于Thermo Fisher公司;山羊抗鼠IgG HRP二抗(免疫组化用)、20×DAB显色试剂盒购于MaxVision公司;封闭用正常山羊血清购于北京索莱宝科技有限公司;10×柠檬酸盐抗原修复液(pH=6.0)、苏木素染料均购于北京中杉金桥生物技术有限公司;H2O2和氨水购于北京化工厂;Skp1 ELISA试剂盒购于Aviva Systems Biology公司。
1.3 Western blot实验
取NSCLC组织及相应癌旁组织样本各34例置于蛋白提取液(RIPA裂解液∶蛋白酶抑制剂∶PMSF=100∶1∶1)中,用匀浆器搅碎,使其充分裂解,离心,收集上清蛋白;蛋白浓度测定,绘制标准曲线;蛋白变性、定量后电泳(80 V,30 min;120 V,溴酚蓝指示);转膜(250 mA,120 min);封闭(3%脱脂牛奶,2 h);孵育一抗(Skp1小鼠单克隆抗体,1∶200稀释;β-actin小鼠单克隆抗体,1∶4 000稀释)作用2 h;洗脱,孵育二抗(山羊抗鼠,1∶5 000)作用1 h;曝光成像。
1.4 免疫组化实验及结果判定
将86例NSCLC组织及相应癌旁组织芯片置于烤箱中,65℃、烘烤5 h;组织芯片经脱腊、水化后置于3%H2O2溶液中,室温、避光孵育10 min以去除细胞内源性过氧化物酶的活性;后经1×柠檬酸盐进行抗原修复,正常山羊血清室温封闭15 min,弃去封闭液,用一抗工作液(Skp1小鼠单克隆抗体,1∶100稀释)4℃孵育过夜;之后,二抗室温孵育20 min;DAB显色,在显微镜下观察染色强度;苏木素染色;脱水;中性树脂封片,显微镜下扫描观察。
结果判定:免疫组化染色结果由两位临床病理医师独立判读,根据细胞染色强度和阳性细胞所占比例进行综合分析。其中细胞染色强度的评分标准为:0分(无黄棕色颗粒),1分(淡黄色颗粒),2分(棕黄色颗粒),3分(褐色颗粒);阳性细胞比例的评分标准为:0分(阳性细胞比例≤5%),1分(5%<阳性细胞比例≤25%),2分(25%<阳性细胞比例≤50%),3分(50%<阳性细胞比例≤75%),4分(75%<阳性细胞比例≤100%)。结果取两者之积,分4个等级:0分记为(-),1~4分记为(+),5~8分记为(++),9~12分记为(+++)[14]。最终将(-)和(+)定为蛋白低表达,将(++)和(+++)定为蛋白高表达。
1.5 ELISA方法
按照Skp1 ELISA试剂盒说明书来操作,包括梯度稀释标准品;加样:分别设标准孔、待测样品孔、空白孔,依次加入100μL不同浓度的标准蛋白、血浆样品、标准蛋白稀释液;37℃孵育1 h;弃去液体;每孔加入100μL Biotinylated Skp1 Detector Antibody工作液,37℃孵育1 h;弃去液体,每孔加入300μL洗涤液洗涤,重复3次;每孔加入100μL Avidin-HRP结合工作液,37℃孵育30 min;弃去孔内液体,洗涤液洗板5次;每孔加底物溶液90μL,37℃避光显色30 min;每孔加入终止液50μL,终止反应,用酶标仪检测各孔的D(450)值。
1.6 数据分析
使用Image J 1.8.0图像软件进行Western blot条带灰度值处理;采用SPSS 20.0和GraphPad Prism 7.0软件进行数据统计分析。本研究中,患者的预后(disease-free survival,DFS)随访期为患者首次手术日期至发生复发、转移或随访结束日期,用月计算。分别采用卡方检验和非配对T检验分析肺癌组织和外周血中Skp1的表达与各临床指标之间的关系;采用Kaplan-Meier方法绘制肺癌患者的生存曲线,并进行Log-rank检验;采用多因素Cox回归分析研究风险因素。以α=0.05为检验水准。
2 结果
2.1 Western blot检测Skp1蛋白在NSCLC组织中的表达
Western blot检测34例NSCLC组织及相应癌旁组织样本中Skp1蛋白的表达水平如图1A所示,结果显示Skp1蛋白在NSCLC组织中的表达水平明显高于癌旁组织,差异均具有统计学意义(P<0.001),见图1B。

图1 Western blot检测Skp1蛋白在NSCLC组织和癌旁组织中的表达
2.2 免疫组化法检测Skp1蛋白在NSCLC组织中的表达
免疫组化法检测86例NSCLC组织及癌旁组织样本中Skp1蛋白的表达水平,结果显示Skp1阳性表达主要定位于NSCLC细胞的细胞浆,呈棕黄色颗粒弥漫分布在细胞浆中(图2)。Skp1蛋白在NSCLC组织中呈阳性高表达,阳性表达率为47.7%(41/86),Skp1蛋白在癌旁组织中低表达,阳性表达率为10.5%(9/86),差异具有统计学意义(P<0.001)。Skp1蛋白在NSCLC组织中的表达与肿瘤的临床分期、病理类型、淋巴结转移、分化程度等因素无显著相关关系(P>0.05),见表1。

图2 免疫组织化学染色检测Skp1蛋白在NSCLC组织及癌旁组织中的表达
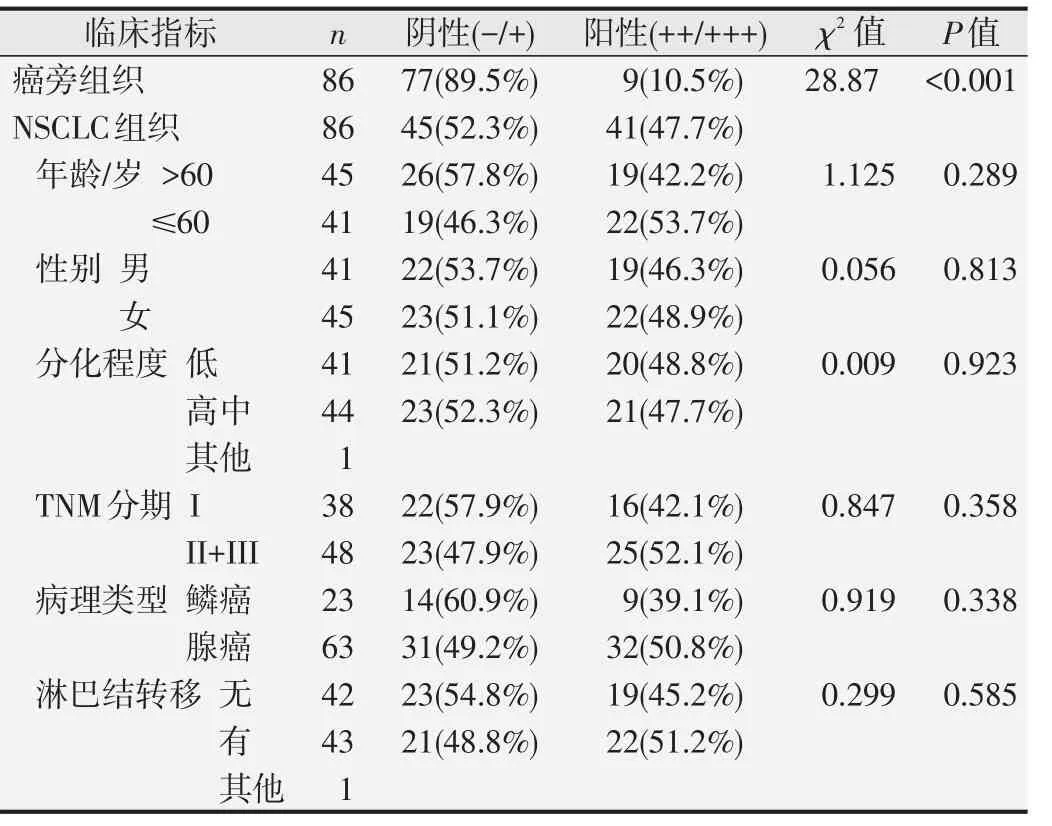
表1 NSCLC组织中Skp1蛋白的表达水平与临床指标之间的关系
2.3 ELISA检测Skp1蛋白在NSCLC患者血浆中的表达水平
ELISA检测Skp1在39例NSCLC患者血浆及27例健康人血浆中的蛋白水平,结果显示Skp1在NSCLC患者血浆中的蛋白浓度显著高于健康人群(P=0.003)(图3)。以所有受试人群外周血中Skp1蛋白浓度的中位数(90.65 pg/mL)为临界点,将受试人群分为两组,分别为:Skp1低水平组(<90.65 pg/mL)和Skp1高水平组(≥90.65 pg/mL)。统计学分析显示Skp1蛋白在非小细胞肺癌外周血中的表达水平与肿瘤的临床分期、病理类型、淋巴结转移、分化程度等因素无显著相关关系(P>0.05)。Skp1蛋白在NSCLC患者外周血中的表达水平与各临床参数之间的关系见表2。

图3 ELISA检测Skp1蛋白在NSCLC患者血浆中的表达水平

表2 NSCLC患者外周血中Skp1蛋白的表达水平与临床指标之间的关系
2.4 Skp1蛋白在NSCLC组织中的表达与患者预后的关系
本研究中共79例NSCLC患者有相应的预后信息(复发转移及生存情况),其中包含35例早期(I)患者,44例中晚期(II+III)患者;37例低分化患者,42例高中分化患者。随访时间3~54个月,中位随访时间34个月。用Kaplan-Meier预后分析表明,在早期(I)NSCLC患者中,Skp1蛋白高表达和低表达患者间预后差异不显著(P=0.140,图4A),而在中晚期(II+III)患者中,Skp1蛋白高表达的NSCLC患者预后显著差于Skp1低表达的患者(P=0.001,图4B)。在分化程度比较低的NSCLC患者中,Skp1蛋白高表达的NSCLC患者的预后显著差于Skp1低表达的患者(P=0.004,图4C)。而在分化程度比较高的NSCLC患者中,则差异不显著(P=0.699,图4D)。多因素Cox回归分析结果显示,Skp1蛋白可以作为判断中晚期(II+III)NSCLC患者预后的独立危险因素(P=0.006,表3)。

图4 Kaplan-Meier生存分析组织中Skp1蛋白表达水平与NSCLC患者预后的关系(n=79)
3 讨论
非小细胞肺癌是一种高发病率、高致死率的恶性肿瘤。尤其处于中晚期的肺癌患者,即使通过手术切除,患者复发转移、死亡的几率依旧很高。因此,我们需要进一步找到中晚期NSCLC发生发展的相关基因,从而筛选出潜在的预后指标,为临床评估提供一定的理论依据。
近几年的研究发现,SCF泛素连接酶复合体(Skp1-Cullin-F-box)可以通过泛素依赖的蛋白水解途径降解细胞周期相关蛋白,参与细胞增殖与凋亡的调控,进而影响肿瘤的发生发展[15]。Yu等[16]研究发现Skp1/Skp2/Cul1复合体可以选择性的靶向p21和cyclin D蛋白,并进行泛素化降解,该复合体的异常表达可能会调控G1期细胞周期调控因子的蛋白表达水平,进而参与肿瘤的形成过程。Hussain等[5]在肺癌中的研究结果表明干扰Skp1基因的表达能明显抑制肺癌细胞的生长、增殖、克隆活性和G2/M期阻滞,表明Skp1与肺癌发生发展和患者生存密切相关。此外,将Skp1从F-box中分离出来会引起F-box相关蛋白(ALK/NIPA、Skp2和TRCP)的降解,进一步表明Skp1表达水平的升高可能会促进SCF连接酶的致癌活性。Cul1在黑色素瘤、乳腺癌和肺癌中高表达,促进癌细胞的增殖,并且Cul1的高表达与肿瘤患者的不良预后有关[17-18]。含β-转导素重复的E3泛素蛋白连接酶(betatransducin repeat containing E3 ubiquitin protein ligase,β-TRCP)通过介导泛素化途径降解IkBα从而激活核因子κB(nuclear factor kappa B,NF-κB),增强β-catenin转录活性[19]。大量研究发现Skp2基因与肺癌的侵袭、浸润、淋巴结转移和患者预后显著相关。Wang等[20]在黑色素瘤细胞中的研究显示Skp2能通过介导MutT同源物1(MutT homolog 1,MTH1)的稳定性,抑制氧化应激引起的DNA损伤和细胞凋亡,进而促进黑色素瘤细胞的生存。Takanami等[21]用RT-PCR和免疫组织化学染色方法研究了79例NSCLC组织标本Skp2的表达水平与临床参数及预后的关系,发现Skp2与病理分期、组织学亚型、血管侵袭、淋巴结转移等因素显著相关,并且Skp2高表达的NSCLC患者生存率显著偏低。此外,多因素COX分析表明Skp2是肺癌患者预后的独立危险因素,提示其可作为NSCLC侵袭性强和不良预后的潜在指标。Zhang[22]和Ding等[23-24]研究发现Skp2是骨肉瘤的一个潜在治疗靶点,Skp2在骨肉瘤细胞中高表达,并且其高表达与骨肉瘤患者的不良预后有关,干扰Skp2基因表达能够减少骨肉瘤细胞的增殖和侵袭,降低体内肺转移。Wang等[13]研究发现致癌性E3连接酶通过降解肿瘤抑制因子使细胞无限增殖、基因组不稳定,从而发生细胞恶性转化。

表3 多因素Cox回归分析临床指标和Skp1蛋白表达水平与中晚期(II+III)NSCLC患者预后的关系
越来越多的实验和研究证明,在人类多种癌症中,SCF复合物,包括核心组分(Cul1和Rbx1)和受体组分(Skp2和β-TRCP等)的差异过表达与肿瘤发生、发展和患者不良预后密切相关[25-27]。然而,关于Skp1在NSCLC中的研究还比较少,其是否和SCF其他组分一样与肺癌患者预后相关,以及是否可以作为肺癌治疗靶点仍有待研究。因此,本研究通过检测Skp1在NSCLC组织和外周血中的蛋白表达水平,分析探索其与NSCLC临床病理指标及患者预后的关系,为Skp1在临床上的应用提供一定的理论依据。我们本次的研究发现Skp1也有类似的现象,本研究通过Western blot、免疫组化和ELISA分别检测了Skp1在NSCLC和正常人组织及外周血中Skp1蛋白的表达水平,发现Skp1蛋白在NSCLC中显著高表达(P<0.01)。Kaplan-Meier单因素生存分析显示,在中晚期(II+III)NSCLC患者以及低分化NSCLC患者中,Skp1蛋白高表达的NSCLC患者的预后均显著差于Skp1低表达的患者(P<0.01),多因素Cox回归分析显示Skp1蛋白可以作为判断中晚期(II+III)NSCLC患者预后的独立危险因素(P<0.01)。这提示着Skp1基因可能作为癌基因参与到NSCLC的进程,并且NSCLC恶性程度越高Skp1影响越显著。虽然研究已经发现Skp1在NSCLC患者中异常表达,并且可能作为癌基因参与NSCLC发生发展的进程,但仍有很多生物学功能方面的问题需要解答:Skp1是通过什么信号传导机制结合到F-box蛋白上,其异常表达又是如何影响SCF复合体的致癌性;Skp1在机体又是受什么信号诱导发生异常表达,进而参与癌症进程等,有待进一步的细胞功能学实验验证和研究。相较于其他分子而言,目前对于Skp1的研究却很少,值得我们进一步探索。
综上所述,本研究发现Skp1蛋白在NSCLC患者组织和外周血中显著高表达,并且其在NSCLC组织中的高表达与患者的不良预后显著相关,是恶性肿瘤发生发展中的关键分子,这提示Skp1蛋白有望成为中晚期(II+III)NSCLC患者诊断和预后的生物标志物和治疗靶点。

