食品添加剂与蛋白质相互作用的研究方法及进展
段 然,吴 笛,胡 霞,梅 森,杨 浩
(成都大学 药学与生物工程学院,四川 成都 610106)
0 引 言
蛋白质在我们日常的饮食结构中占重要地位,是人体中不可缺少的物质.目前,有关蛋白质和食品活性小分子相互作用的研究,一直是食品科学、药学与化学等领域的热门研究课题.已报道的相关配体包括药物活性组分、食品添加剂、表面活性剂等类型,而相关的受体蛋白主要集中在卵清蛋白、人血清白蛋白、溶菌酶及牛血清白蛋白等.该研究领域的主要研究方法包括滴定法、荧光分析法、圆二色谱法、紫外线光谱法、核磁共振法、傅立叶红外光谱法以及计算机模拟分子对接法等.
1 相关研究内容
1.1 蛋白质
胃蛋白酶是一种对人体很重要的消化蛋白酶,主要由胃黏膜主细胞分泌,其功能是将食物中的蛋白质分解成短肽片段.胃蛋白酶的最佳pH环境在1.5~2.0之间,且能够与芳香族氨基酸或酸性氨基酸的氨基的肽键相互作用.Li等[1]在利用光谱技术研究β-胡萝卜素和虾青素与胰蛋白酶和胃蛋白酶的相互作用时,以胃蛋白酶为受体,证明了β-胡萝卜素和虾青素与胃蛋白酶的相互作用,得出了完整且准确的数据,有助于了解胡萝卜素与虾青素对蛋白质功能及其对人体内生物活性的影响.
人血清白蛋白(Human serum albumin,HSA)在体液中可以运输氨基酸、脂肪酸、类固醇激素、胆色素、金属离子和一些治疗分子等,同时维持血液正常的渗透压,其包含585个氨基酸,分子量为66 000 Da.在人血浆中HSA浓度为42 g/L,约占血浆总蛋白的60%.Pan等[2]利用多光谱法研究了柠檬黄(Tartrazine,TZ)与HSA的相互作用,结果表明TZ可导致HSA的构象和一些微环境变化,这可能影响HSA的生理功能,研究结论为柠檬黄在生物体内的毒性机制提供了重要的依据.
牛血清白蛋白(Bovine albumin,BSA)是牛血清中的一种球蛋白,其包含607个氨基酸残基,分子量为66446 Da,理化性质接近HSA,且价格相对HSA有很大优势,因此也常被用作相互作用的配体以替代HSA.Jahanban-Esfahlan等[3]研究了BSA与功能性食品基料谷胱甘肽(glutathione,r-glutamyl cysteingl+glycine,GSH)的相互作用,证明了GSH作为内源性抗氧化剂的食品基料可以有效地结合BSA并在血浆中转移.
卵清蛋白(Ovalbumin,OVA)主要来源于蛋清当中,也是蛋清的主要蛋白成分,其相对分子量为44 500 Da,含有4个自由巯基及385个氨基酸残基.其中,氨基酸残基相互缠绕折叠形成球形二级结构,大部分为α螺旋和β折叠,是蛋白质与小分子相互作用领域中应用较广的受体.Ognjenovic等[4]在研究食物过敏原OVA与茶多酚的主要成分表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)的相互作用时,发现EGCG与OVA相互作用时OVA结构发生变化,进一步证实了EGCG与食物过敏原OVA相互作用可促进其多种生物活性并可能损害抗原呈递细胞对抗原的摄取机制.
溶菌酶(Lysozyme,LYZ)是一种能水解致病菌中黏多糖的碱性酶.LYZ作为无毒、无副作用的蛋白质具有一定的溶菌作用.根据此特性,LYZ常用作天然的食品防腐剂,现已广泛应用于各类食品中起防腐作用.其相对分子量为14 000 Da,由18种129个氨基酸残基构成的单一肽链,富含碱性氨基酸,有4对二硫键维持酶构型,是一种碱性蛋白质,其N端与赖氨酸相接,C端与亮氨酸相接.Zhang等[5]研究了柚皮苷棕榈酸酯与LYZ的结合,证明了二者的相互作用.其研究发现,柚皮苷棕榈酸酯的添加没有导致LYZ发生结构变化,LYZ的生理效应保持完整,但柚皮苷棕榈酸与LYZ则呈现更好的结合效果.该研究对添加柚皮苷棕榈酸酯于溶菌酶复合物功能性食品的开发具有指导意义.
此外,随着蛋白质与小分子相互作用研究的深入,其他蛋白质诸如唾液蛋白、胰蛋白酶、麦谷蛋白、醇溶蛋白等大分子也逐渐被用作相互作用的受体而应用于本领域的相关研究中.
1.2 食品添加剂
食品添加剂作为改善食品的色、香、味等品质,以及为防腐和加工工艺的需要而加入食品中的人工合成或者天然的物质,具体有防腐剂、着色剂、抗结剂、酸度调节剂、消泡剂、增味剂等.在现有报道的相互作用研究中,配体小分子以食品抗氧化剂、食品防腐剂、食品着色剂为主,最多为食品着色剂与蛋白质的作用研究.现有柠檬黄、苋菜红、胭脂红、诱惑红、偶氮玉红、纳他霉素、乳酸链球菌素等约几十种食品添加剂的相关研究.
2 主要研究方法
2.1 荧光分析法
目前,荧光分析法是相互作用领域研究中用得最多的研究方法,其基本原理是分子吸收光能之后发射出波长在紫外、红外区的荧光光谱,可以根据光谱所显示的结果进行定性和定量分析.在蛋白质与活性小分子的相互作用领域中,荧光滴定常用来测定结合常数,通过时间分辨来判断荧光猝灭类型,以及利用同步荧光/三维荧光测定酪氨酸和氨基酸残基的变化[6-7].
荧光滴定法利用荧光分光光度计记录数据,图1是Wu等[8]在研究食品抗氧化剂丁基化羟基茴香醚(BHA)及其代谢产物(TBHQ、TBQ)与LYZ的结合时滴定记录测得数据后制作的荧光猝灭图谱.在其研究中,用不同量的BHA、TBHQ和TBQ滴定LYZ,观察到荧光信号的明显收缩和最大LYZ波长的红移,并用Stern-Volmer方程(见式1)进行定量分析计算Ksv值并画出线型图,通常,Ksv随温度升高而降低,表明相互作用的猝灭机制,BHA/TBHQ/TBQ和LYZ之间发生静态猝灭.
F0/F=1+Kq·τ0[Q]=1+Ksv[Q]
(1)
式中,F0为加入猝灭剂前物质的荧光强度,F为加入猝灭剂后物质的荧光强度,Kq为生物分子猝灭速率常数,τ0为无猝灭剂时荧光物质的平均寿命,[Q]为猝灭剂浓度,Ksv为猝灭常数.

(a)BHA对LYZ的荧光猝灭图谱;(b)TBHQ对LYZ的荧光猝灭图谱;
(c)TBQ对LYZ的荧光猝灭图谱
图1 3种荧光猝灭图谱
同时Wu等[8]还利用时间分辨法以不同浓度的TBHQ与LYZ结合制成TBHQ对应的LYZ的荧光衰减曲线图(图2),进行荧光寿命分析,结果显示TBHQ对LYZ内源荧光的猝灭遵循静态猝灭机理,TBHQ通过与LYZ结合形成了复合物.

图2不同浓度TBHQ对应的LYZ的荧光衰减曲线
Lelis等[9]用荧光分析法研究了诱惑红(Allura red AC)与牛血清白蛋白(BSA),同样通过观察红移和荧光发射峰以及测定Kb值等方法证明了诱惑红(Allura red AC)与牛血清白蛋白(BSA)的相互作用.根据Ksv值随温度的升高而降低,判断猝灭类型为静态猝灭.并利用双对数曲线测定了其结合常数,并且在蛋白质变性时,Allura red AC与一个非特异性BSA点位结合.
Basu等[10]在研究食品着色剂偶氮玉红(Carmoisine)对LYZ淀粉样纤维形成的相互作用及抑制作用时用同步荧光法所做的同步荧光光谱如图3所示.当Δλ为60 nm时,LYZ的同步荧光光谱将提供有关氨基酸(Trp)残基周围环境的信息;当Δλ为15 nm时,同步荧光光谱将提供有关酪氨酸(Tyr)残基周围环境的信息.从荧光猝灭曲线上看出,当Δλ=60 nm时,LYZ的同步荧光显著猝灭,该猝灭伴随着发射最大值为6 nm的红移,推测为氨基酸残基转移到更亲水的环境当中导致;当Δλ=15 nm时,LYZ的同步荧光在加入Carmoisine时显著猝灭,但发射最大值的位置没有变化,表明没有发生微环境的变化.Carmoisine的加入使该相互作用的位置更加靠近Trp残基,证明了Carmoisine和LYZ的结合.

图3 Carmoisine对LYZ曲线(1,10 μM)的同步荧光光谱
荧光分析法是较平衡透析、电子探针法、二极管阵列检测等方法更为先进的一种相互作用分析方法,具有设备简单、分析灵敏度高、选择性强、使用简便及可提供丰富准确的物理参数等优点,其可测定的参数包括发射光谱、激发光谱、荧光强度、荧光寿命、荧光偏振及量子产率等.但荧光分析法也存在易受干扰且只可以表征有荧光的物质等缺点.
2.2 圆二色谱法
圆二色谱法(Circular dichroism,CD)是研究蛋白质与食用性小分子相互作用的一种典型方法.该方法用于研究蛋白质的二级结构,其原理是基于物质的圆二色性来探究物质的空间结构.圆二色性的产生是由于发射平面偏振光通过具有旋光活性的介质时,由于此介质对所发射的光分解成的右旋和左旋圆偏振光吸收不同,出射时电场矢量的振幅不同,再次合成后的光是椭圆偏振光,由此产生圆二色性.一般蛋白质的CD光谱在远紫外CD区208 nm波长和222 nm波长处显示2个负峰,表示α螺旋向肽键n-π*的跃迁,通过计算波长208 nm处的平均残基椭圆率θ,并结合相应数学公式,可对蛋白质二级结构的α螺旋进行定性、定量分析,也可采用在线分析软件Dichroweb进一步定量分析α螺旋、β折叠、β转角和无规卷曲各自的含量变化[11].
Panja等[12]在研究柠檬黄(Tartrazine,TZ)与人溶菌酶(HLZ)和鸡蛋清溶菌酶(CEWLZ)的相互作用时利用CD光谱研究了TZ加入后两种溶菌酶的二级结构的变化(见图4),并且计算得到HLZ和CEWLZ的α螺旋含量估计值分别为25.45%和29.32%,通过调整配体浓度,实时监测α螺旋的含量,证明了当TZ与HLZ相互结合时,蛋白质二级结构发生了改变.但在与CEWLZ结合的情况下,α螺旋含量受TZ浓度增加的影响要小得多.百分比的改变是由于TZ与氨基酸残基作用致使溶菌酶蛋白质的结构更疏松.
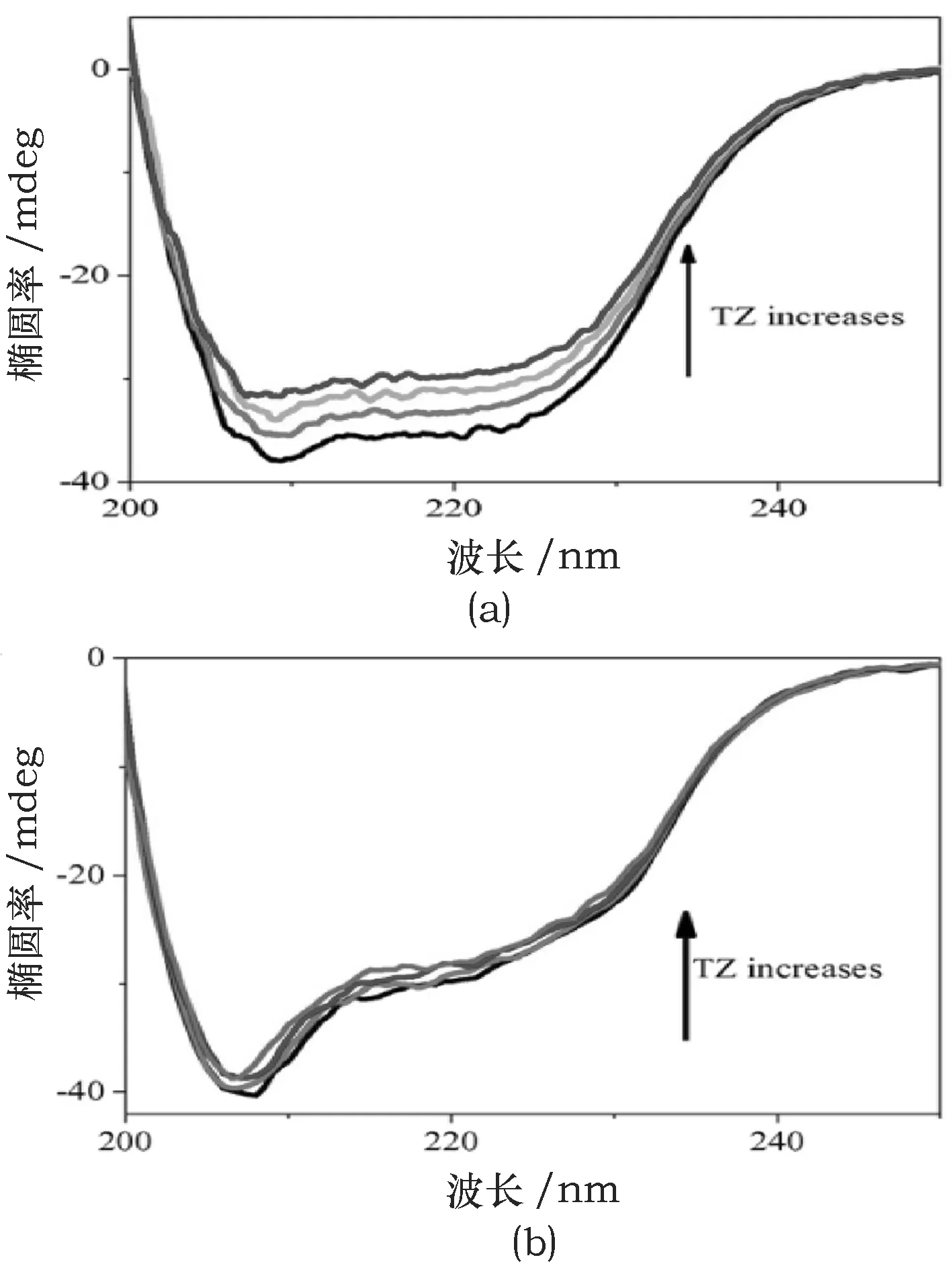
图4 TZ加入后的HLZ(a)和CEWLZ(b)的远紫外CD光谱
利用圆二色谱法不仅可以计算蛋白质的二级结构,而且还非常适合研究蛋白质构象的变化,圆二色谱法仪器组成相对来说比较复杂、精密,但操作简单,认可度高,因此被广泛应用.但其对样品要求较高,必须保持相对稳定的纯度且不含光吸收杂质.因此,圆二色谱法光谱测量一般都在离子浓度很低的稀溶液中进行.
2.3 紫外光谱法
紫外线光谱(Ultraviolet-visible spectroscopy,UV-vis)同样用于研究蛋白质的相互作用,原因是蛋白质中的色氨酸、酪氨酸与苯丙氨酸等某些芳香性氨基酸基团在紫外区存在吸收峰,其残基在波长190~310 nm的范围内有吸收,蛋白质中色氨酸和酪氨酸的残基吸收峰出现在波长280 nm附近,肽键的吸收峰出现在波长210 nm附近.根据这样的特性,利用小分子与生物大分子相互作用前后吸收光谱的差异来研究二者间的结合情况[13].
吴克刚等[14]通过紫外可见分光光度计测了芳樟醇和BSA的结合,得到紫外吸收光谱如图5所示.

图5加入BSA前后芳樟醇的紫外光谱(a)及加入芳樟醇前后BSA的紫外光谱(b)
可以看出,BSA在207.50 nm和277.00 nm处有2个紫外特征吸收峰,随着BSA浓度的增加,芳樟醇的吸收峰强度降低,随着配体芳樟醇浓度的增加,在波长207.50 nm处发现红移且BSA吸收峰强度明显减弱,说明了BSA的α螺旋结构变得更加松散了.波长277.0 nm处的吸收峰强度降低说明BSA微环境疏水性的增加,证明了芳樟醇和BSA的相互作用.
紫外光谱法操作简便且灵敏度高,但其能提供的信息有限,在相关研究中多用来作为辅助手段.
2.4 核磁共振波谱法
核磁共振波谱法(Nuclear magnetic resonance spectroscopy,NMR)一般用来确定蛋白质的三维结构[15],其原理是通过在强磁场中,原子核发生自旋能级分裂,当吸收外来电磁辐射时,将发生核自旋能级的跃迁,产生核磁共振信号.NMR能够提供蛋白质分子的结构信息.在相互作用的领域中,现有研究主要集中在H谱、F谱、及饱和转移差谱法(Saturation Transferred Difference,STD)方面.1H-NMR通过将分子中的1H的核磁共振效应体现于1H-NMR谱,通过分析谱图中的含氢基团的化学位移、裂分情况及耦合常数等信息分析物质结构.
Dantas等[16]用1H-NMR技术确定了小分子和蛋白质相互作用的优先区域,19F-NMR可以确定含氟小分子和蛋白质大分子是否存在结合作用,通过比较原含氟小分子及小分子和蛋白质结合后的19F-NMR谱可分析二者的相互作用.陈瑶[17]的研究发现,STD-NMR技术可以直观地显示蛋白质—配体复合物的结合特征峰,结合部位的构效信息,以此反应其相互作用的机理.从STD-NMR谱中,可观察到化学位移及峰型的变化,还有结合部位发生的动力学过程如苯环的转动、骨架和侧链的柔性和刚性的变化等动力学信息.
目前,核磁共振波谱法因其具有分辩率较高,可分析的分子量大,固体液体样品均可使用且不需要结晶等优点而被广泛应用于测定蛋白质的分子结构领域.但NMR缺点也很明显,如所需样品含量较大,受分子量的限制,需要提前标记等[18].
2.5 傅里叶红外分析
傅里叶红外分析(Fourier transform infrared,FTIR)用来研究分子的结构及化学键,在蛋白质与活性小分子的相互作用的研究中,利用傅里叶红外光谱仪,通过制备固体样品粉末并设置相关参数后对粉末进行扫描获得数据制成傅里叶红外变换光谱图,进而分析结果.FTIR之所以被广泛应用于测定蛋白质二级结构相对含量,主要是因为蛋白质在红外光谱中有很多特征吸收带,其中酰胺I带(1 600~1 700 cm-1),包含了非常丰富的蛋白质二级结构信息,如α螺旋、β折叠、β转角、无规则卷曲结构等,因此酰胺Ⅰ带常用来解析蛋白质的二级结构及蛋白质分子的振动和转动能级等.此外,Zhang等[19]用傅里叶红外光谱技术证实了苋菜红与人血清白蛋白相互作用会引起人血清白蛋白构像的改变.
与红外光谱分析相似的还有拉曼光谱分析,两者都可以反应蛋白质的结构信息,某些峰的红外吸收波数和拉曼位移完全相同,但其产生机理不同,红外光谱是吸收光谱,拉曼光谱是散射光谱.红外光谱有着很多优点,例如红外光谱容易测量,信号好,特别是在鉴定有机化合物中可以得到较多的信息,但对水溶液,单晶和聚合物的检测相对困难.拉曼光谱则更像是红外光谱的互补手段,例如它对样品要求就没有红外光谱那么高,几乎可以不必特别制备样品就可以开始进行分析,适合检测无机化合物,但操作等较为复杂.
2.6 计算机模拟方法
通过计算机模拟的分子对接实验常用于研究蛋白质与活性小分子的相互作用,其利用牛顿力学模拟蛋白质与小分子体系的运动,通过计算机软件对已知三维结构的受体和配体进行实时计算与优化,最终找到配体和受体在活性区域结合时能量最低的构像,即为最优构像.在最终构像中可以观察到小分子在蛋白质分子中的结合点位,同时也可以显示最接近小分子的蛋白质残基.目前,分子对接实验常用的软件有FlexX、Yasara、AutoDock、Discovery studio、Grid等,对接方法也分为刚性对接、半柔性对接、柔性对接[20],不同的对接方法适用于不同的配体和受体.
Peng等[21]在研究食品偶氮染料和溶菌酶的结合模式和结构中,以酸性红(C.I Acid Red 2)为配体,鸡蛋溶菌酶为受体,借助相关软件进行了分子对接实验,模拟了溶菌酶和酸性红的结合模式,从结果中可以看到二者的结合点位(图6(a)),以及最接近受体的蛋白质残基(图6(b)),也就是参与结合的氨基酸残基.同时,通过对对接结果图进行分颜色标注来更加清楚地展示实验结果,球棍模型表示配体(酸性红),粉红色棒模型显示Trp-63和H2O-221与配体之间的氢键,绿色棒模型解释了Trp-62和C.I Acid Red 2之间的π-π和阳离子-π相互作用.

图6酸性红与鸡蛋溶菌酶的结合模式和结构
分子对接实验因为能够相对准确清楚地看到活性小分子在蛋白质大分子处的结合点位且操作简单,而成为本领域中研究蛋白质与小分子结合后构型的一种常用工具.
2.7 等温滴定热量法
等温滴定热量法(Isothermal titration calorimetry,ITC)同样可以用于研究蛋白质与小分子的相互作用,其通过功率补偿原理,无损地研究物质的热力学,具有灵敏度高、准确度高与操作简便的优点.使用该方法无需对结合配体进行特定的修饰和荧光标记,便可以测定结合配体在自然状态下的亲和力.测量结合过程中的热传递后计算可提供相互作用时的多种热力学信息(结合常数、反应化学量、焓和熵等),不但可以提供结合强度,还可以了解到热力学参数相关的作用机制,其应用前景良好.
2.8 其他相关研究方法
随着化学分析研究的深入以及相关仪器设备的不断更新和提升,相关研究手段也在不断完善,除上述几大研究方法之外,还有许多非常规的研究方法,诸如X-晶体衍射[22]、质谱法[23]、液相色谱法[24]、毛细管电泳法[25]、共振光散射技术[26]、平衡透析法[27]、二极管阵列检测[28]、电化学以及动物实验[29]等也不断出现在相关的研究当中.
例如,Shi等[29]在研究卵清蛋白与丹参素的相互作用时用到了动物实验,具体设置6组对照组,观察有炎症的小鼠的肺部切片,加入了丹参素—卵清蛋白复合物的实验组的小鼠炎症明显降低,证明了丹参素与卵清蛋白相互作用可以降低卵清蛋白的过敏反应.Gnanamani等[30]研究直接黑38、直接棕1和酶相互作用促进了致癌胺的释放,用高效液相色谱分析法确认了致癌氨的产生,用质谱法确认了释放的胺联苯胺、4-氨基联苯和2,4,5-三甲基苯胺的结构.Zhong等[31]利用了共振光散射技术,证明了牛血清白蛋白与胭脂红的相互作用,并根据此特性,提出了一种新的纳米级痕量蛋白质的测定方法.
3 总结与展望
随着对蛋白质与小分子的相互作用的研究的深入,相关的分析方法和技术也在不断发展.今后,在该领域一定不会是某个单一的研究方法或者是传统固定的方法,因为蛋白质在研究期间所处的生理环境的不同,导致了相对的不精确性,因此就要求综合运用多种方法来精确展现蛋白质与小分子作用的各种结果.
研究食品小分子与蛋白质的相互作用也有很重要的现实意义.随着消费者对食品安全问题的重视,需要研究如某些食品着色剂、防腐剂等食品添加剂与食品蛋白质相互作用是否会对人体产生毒副作用.与此同时,深入分析食品小分子与人体内某些运输蛋白质如HSA等的相互作用,可以判断毒性物质的作用机理等信息,以指导食品添加剂的添加的限定值确认.除此之外,研究某些诸如功能类食品小分子与蛋白质的相互作用,不仅可以揭示食品营养及其功能的作用机制,还可以建立食品组分与蛋白质的相互识别模型,结合光调控蛋白质构像等研究,了解小分子在生物体内的吸收、分布、代谢、消除过程.这些研究都为食品添加剂的合理应用提供了有价值的信息.
综上所述,蛋白质与食源性小分子的相互作用研究价值较大,在食品科学领域有着广阔的应用前景.

