基于PEG和不同盐的双水相体系萃取牛血清白蛋白研究
唐 媛,时羽杰,龙晓明,余海萍,邬晓勇
(1.成都大学 农业农村部杂粮加工重点实验室,四川 成都 610106;2.成都大学 药学与生物工程学院,四川 成都 610106)
0 引 言
双水相,即聚合物的不相容性.目前,双水相萃取技术因具有条件温和、容易放大及可连续操作等特点,已在生物物质的分离纯化中得到广泛应用[1-2].研究表明,影响双水相分配系数的因素有很多,包括成相聚合物的相对分子质量、聚合物的浓度、盐的种类与盐的浓度等[3].对此,科研人员对其进行了大量研究,并取得了一系列成果[4-6],但对不同双水相体系的萃取能力的研究比较少.因此,本实验构建了两种无机盐与PEG4000的双水相体系,通过对牛血清白蛋白的萃取过程的分析得到所建立萃取体系的最佳质量分数,并分析了其最佳萃取条件.
1 材料与方法
1.1 材料与仪器
1.1.1 材 料.
实验所用材料包括:PEG4000(批号,20160422)、NaH2PO4(批号,20150511)、(NH4)2SO4(批号,2018010501)、考马斯亮蓝G-250(批号,20170522)、0.1 mg/mL牛血清白蛋白(批号,20161206),均购自成都市科隆化学品有限公司.
1.1.2 仪 器.
实验所用仪器包括:CPA22-D型电子天平(赛多利斯科学仪器(北京)有限公司),UV-2600A型紫外—可见分光光度计(龙尼柯(上海)仪器有限公司)、IKA VORTEX GENIUS 3型漩涡振荡器(艾卡(广州)仪器设备有限公司).
1.2 方 法
1.2.1 牛血清白蛋白标准曲线.
利用文献[7]中的方法制备标准曲线.取6支刻度试管分别加入0.1 mg/mL牛血清白蛋白0.00 、0.20、0.40、0.60、0.80、1.00 mL,用蒸馏水全部稀释至1.0 mL,然后分别加入5.00 mL考马斯亮蓝G-250,立即于595 nm波长处测定吸光度.以标准蛋白浓度为横坐标,相应的吸光度值为纵坐标,绘制标准曲线.
1.2.2 PEG4000/NaH2PO4和PEG4000/(NH4)2SO4双水相体系的相图.
参考文献[8]中的相关方法制备相图,采用浊点法进行,稍加改动.先配制质量分数为30%的NaH2PO4溶液和(NH4)2SO4溶液并分别测定其密度.精密称取0.2 g PEG4000于大试管中,按文献[8]中的方法依次操作,制作出2条双曲线的相图.为便于计算,每次加水量固定为0.3 mL.之后,以PEG4000的质量分数为纵坐标,分别以NaH2PO4和(NH4)2SO4的质量分数为横坐标作图,制得到2条相图.
1.2.3 确定PEG4000/ NaH2PO4与PEG4000/(NH4)2SO4最佳体系.
1)确定PEG4000质量分数.根据上述相图,准备14支刻度试管,7支为一组,共2组.一组加入一定量的NaH2PO4,另一组加入(NH4)2SO4,之后分别加入PEG4000,双蒸水定容至10 mL.然后每组分别加入1 mL牛血清白蛋白,摇匀,并静置至分层,分别取各刻度试管上相、下相溶液测蛋白含量.计算出各组的分配系数K,取最小值作为最适PEG4000的质量分数.
2)确定NaH2PO4和(NH4)2SO4的质量分数.同上操作,每支试管按照上述确定的PEG4000质量分数,分两组分别梯度加入NaH2PO4和(NH4)2SO4,之后定容至10 mL.每组分别加入1 mL牛血清白蛋白,摇匀,并静置至分层.分别取各刻度试管上相、下相溶液测蛋白含量.计算出各组的分配系数K,取最小值作为最适的两种无机盐的质量分数.
1.2.4 蛋白起始浓度对两种双水相系统萃取的影响.
设置蛋白浓度最大为3 mg/mL,然后经过稀释,获得6个浓度分别为0.05 mg/mL、0.1 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL、3 mg/mL的系列蛋白溶液.根据上述确定的最佳的PEG4000/NaH2PO4和PEG4000/(NH4)2SO4组合,分别构建6个双水相体系并编号,各刻度试管依序加入各浓度蛋白溶液1 mL,摇匀,并静置至分层,分别取各刻度试管上相、下相溶液测定蛋白含量.同时观察记录上下相体积等,通过计算得到各组的分配系数K和回收率Y上、Y下.
1.2.5 双水相体系蛋白质的相关计算公式.
1)分配系数.
K=C1/C2
2)相比.
R=V1/V2
3)回收率.
Y上=C1V1/(C1V1+C2V2);
Y下=C2V2/(C1V1+C2V2)
式中,C1、C2分别为上相、下相中蛋白的总浓度,mol/L;V1、V2分别为上相、下相的体积,mL;Y上、Y下分别为上相、下相的回收率,%.
2 结果与分析
2.1 牛血清白蛋白标准曲线
根据“1.2.1”项下方法所得到的牛血清白蛋白的标准曲线为,Y=0.341 8X-0.013 1,R2=0.995 2.结果表明,蛋白浓度与吸光度间线性关系良好,可以用于后续蛋白含量的测定.
2.2 双水相体系的相图
根据“1.2.2”项下方法得到PEG4000/NaH2PO4和PEG4000/(NH4)2SO4两种双水相体系的相图如图1所示.

图1两种双水相体系相图
从图1可以看出,同样条件下PEG4000/NaH2PO4体系的成相所需浓度要比PEG4000/(NH4)2SO4体系的成相浓度更低.
2.3 最佳萃取体系的确定
2.3.1 确定PEG4000/NaH2PO4的最佳萃取体系.
按照“1.2.3”项下“1)”中的方法,待每支试管萃取平衡后,先读取上、下相的体积,之后分别取上、下相溶液检测蛋白含量,按照公式计算分配系数K,结果见表1.

表1 PEG4000/NaH2PO4最佳萃取体系的确定
由表1可知,分配系数K值最小时PEG4000/NaH2PO4体系的最佳PEG4000质量分数11.50%,此时分配系数K值最小为0.44;而最佳NaH2PO4的质量分数20%,此时分配系数K值最小为0.45.因此,PEG4000/NaH2PO4最佳萃取体系为11.5% PEG4000/20% NaH2PO4.
2.3.2 确定PEG4000/(NH4)2SO4的最佳萃取体系.
同上,待每支试管萃取平衡后,先读取上、下相的体积,之后分别取上、下相溶液检测蛋白含量,按照公式计算分配系数K,结果见表2.
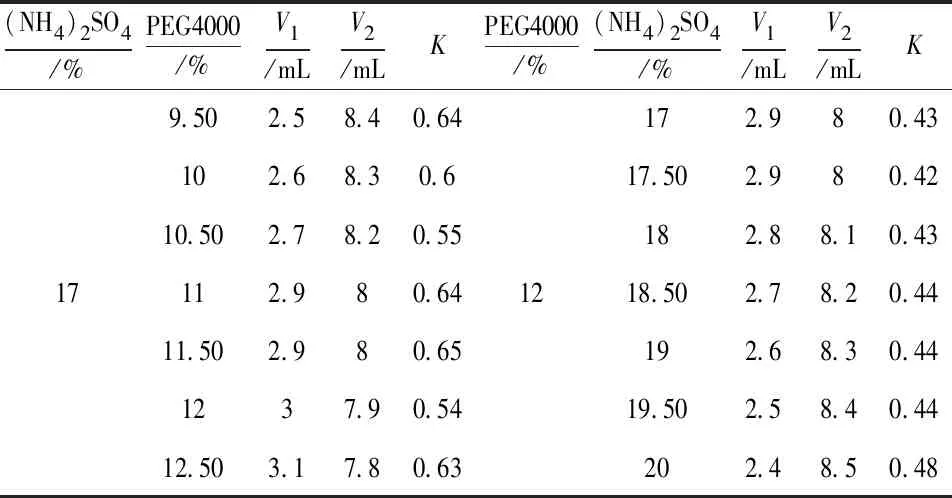
表2 PEG4000/(NH4)2SO4最佳萃取体系的确定
由表2可知,分配系数K值最小时PEG4000/(NH4)2SO4体系的最佳PEG4000质量分数为12%,此时分配系数K值最小为0.54;而最佳(NH4)2SO4的质量分数17.5%,此时分配系数K值最小为0.42.因此,PEG4000/(NH4)2SO4最佳萃取体系为12%PEG4000/17.5%(NH4)2SO4.
2.4 不同浓度牛血清白蛋白在双水相体系中的萃取
2.4.1 PEG4000/NaH2PO4体系中牛血清白蛋白的萃取行为.
按照“1.2.4”项下的方法,将梯度浓度的蛋白溶液加入到优化后的11.5% PEG4000/20% NaH2PO4体系中,待萃取平衡后,进行测定,结果见表3.

表3 不同起始蛋白浓度在11.5% PEG4000/20% NaH2PO4体系中的萃取行为
由表3可得,当牛血清白蛋白浓度为2 mg/mL时,分配系数K值为0.38最小,而下相回收率Y下为89.4%,达到最大.
2.4.2 PEG4000/(NH4)2SO4体系中牛血清白蛋白的萃取行为.
同上操作,结果见表4.

表4 不同起始蛋白浓度在12% PEG4000/17.5% (NH4)2SO4体系中的萃取行为
由表4可知,当牛血清白蛋白浓度为2 mg/mL时分配系数K值为0.29最小,而下相回收率Y下=91.5%,达到最大.
3 讨 论
从相图结果可以看出,同样条件下PEG4000/NaH2PO4双水相体系成相所需的PEG4000质量分数和盐的质量分数都比较少,产生这一现象的原因可能是由于两种体系的盐的种类不同,使得两种盐的无机离子在两相中分配系数不同,从而导致两种体系成相的差异[9].
萃取蛋白时,上相是PEG4000,蛋白在PEG4000中不易分离;下相是无机盐溶液,萃取蛋白后容易分离纯化,而分配系数K是体现蛋白在上下两相中分配情况的关键,所以取K值最小时,下相中分配蛋白最多,更利于蛋白后续的分离纯化[10].
在不同的牛血清白蛋白起始浓度实验中,两种体系相比,可以得出PEG4000/(NH4)2SO4双水相体系的分配系数K更小且回收率Y更高.其原因可能是因为磷酸盐体系中的无机盐NaH2PO4电离出氢离子使得体系的pH值更接近牛血清白蛋白的等电点4.7,从而使得蛋白的带电更少,导致磷酸盐体系的分配系数更大,回收率更小[11].而当两种体系的牛血清白蛋白起始浓度由2 mg/mL升至3 mg/mL后,两种体系的分配系数K值都增大,且回收率变小.这可能是由于蛋白浓度增大使得两相黏度尤其是下相的黏度增加,并且可能会不同程度地扰乱成相系统,使得上下相体积比降低,从而影响蛋白质回收率[12].
本研究认为,在PEG4000和NaH2PO4及(NH4)2SO4组成的双水相体系中,两种体系均对牛血清白蛋白有较好的萃取率.本实验结果可为后续利用双水相萃取技术分离纯化活性蛋白提供相关数据.

