陆地棉GhLEA3基因的克隆及其响应低温胁迫表达分析
王俊娟,陆许可,阴祖军,王德龙,王帅,穆敏,陈修贵,郭丽雪,樊伟丽,陈超,叶武威
(中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南安阳455000)
干旱、低温和高盐分等非生物胁迫严重影响作物生长发育,是造成世界范围内作物减产的主要因素[1]。这些非生物胁迫也是制约棉花生产的主要逆境因子。植物在长期的进化过程中,形成了各种不同的适应性生理生化机制,在遭遇逆境胁迫时细胞内会发生一系的生理、生化以及基因表达的变化[2],会产生一系列具有保护功能的蛋白来维持其正常代谢活动。挖掘与棉花非生物逆境胁迫相关的功能基因,对开展棉花抗逆分子育种具有重要意义。
胚胎发育后期丰富蛋白(Late embryogenesis abundant proteins,LEA 蛋白) 是1 类重要的植物细胞脱水保护蛋白[3-4],是1 种水溶性蛋白,最早在棉花中被发现[5-6],1986年首次被Galau 等[7]命名。根据LEA 蛋白保守结构域可以将其分为不同的家族,其中第3 组LEA 蛋白家族(LEA3)具有多拷贝11 个氨基酸(TAQAAKEKAGE)重复基元序列特征[8]。LEA3 蛋白通过这11 个氨基酸残基序列形成的两性α- 螺旋与其他蛋白质或细胞膜结合,从而保护蛋白或细胞膜的活性,减缓逆境胁迫对细胞的伤害[9];还可以作为分子伴侣阻止因水分胁迫导致的蛋白间的变性聚集[10]。同时,低温、干旱和高盐分等非生物胁迫均可以显著诱导LEA3 蛋白的积累。近年来,对LEA3 在多种植物中的功能已有大量报道:在干旱胁迫条件下,LEA3 可以保护乳酸脱氢酶的活性[11];在缺少LEA3 蛋白的情况下,小麦根系受到干旱胁迫伤害后无法恢复正常[12];在耐盐性较强的印度水稻中LEA3 蛋白的积累量显著高于盐敏感型植株[13];小麦与黑麦中叶绿体中LEA3 蛋白的积累可以明显提高植株抗冷性[14]。转基因研究表明,在水稻中过量表达大麦的LEA3 蛋白(HVA1)可以显著提高其耐盐性和抗旱性[15];在酵母中过量表达小麦TaLEA3 等基因可提高酵母耐高渗透胁迫、耐盐和抗冻能力[16];等等。但有关LEA3 在棉花抗冷中的作用报道相对较少。因此,本研究拟克隆棉花GhLEA3 基因,并分析其编码蛋白的结构特性,对其进行系统进化分析;检测其在受低温胁迫前后叶片中的表达量;构建植物表达载体,进行亚细胞定位,并对转GhLEA3 基因拟南芥后代的抗冷性进行研究,预测其在抗冷性中的可能功能。
1 材料与方法
1.1 陆地棉试验材料及其培养和逆境处理
本试验所用棉花材料为陆地棉遗传标准系TM-1,由中国农业科学院棉花研究所抗逆鉴定课题提供。2017年5 月在中国农业科学院棉花研究所抗逆鉴定实验室恒温光照生长箱中进行育苗,采用沙培法育苗(28 ℃,光照14 h、黑暗10 h),正常水分条件(沙土相对含水量约为23.00%)下进行棉花的培养。
1.2 拟南芥试验材料
本试验所用拟南芥野生型(Col-0 生态型)由中国农业科学院棉花研究所棉花抗逆鉴定课题保存。
1.3 棉花RNA的提取和GhLEA3基因克隆
利用北京艾德莱生物科技有限公司生产的EASYspinPlus 植物RNA 快速提取试剂盒对以上所取材料进行RNA 提取,利用Nanodrop2000 核酸分析仪测定总RNA 的浓度和纯度,同时用10 g·L-1琼脂糖凝胶电泳检测RNA 的完整性。利用PrimeScript RT reagent kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,China)将RNA反转录合成第1 链cDNA,以反转录获得的棉花cDNA 为模板,利用Primer Premier5.0 软件设计特异引物,上游引物为GhLEA3-F:5′-ATGGCGACAAGGCAAGAGAA-3′,下游引物为GhLEA3-R:5′-TCACAGATTGGTTTTGTCCGA-3′,扩增GhLEA3 全长cDNA 序列。将目的基因与载体连接、 转化培养以及进行聚合酶链式反应(Polymerase chain reaction,PCR),并且测序验证。所用的PCR 程序、 扩增产物检测和纯化均参考王俊娟等[17]的方法。测序由苏州金唯智科技有限公司北京分公司完成,其他试验均在棉花生物学国家重点实验室完成。
1.4 棉花GhLEA3基因的生物信息学分析
1.4.1棉花GhLEA3 蛋白质的等电点、相对分子质量、磷酸化位点分析和功能结构域的预测。利用在线蛋白质结构域数据库SMART(http://smart.embl-heidelberg.de/)、InterPro(http://www.ebi.ac.uk/interpro/)对GhLEA3 蛋白质结构域进行预测;利用Protparam(http://web.expasy.org/protparam/) 分析蛋白质的相对分子质量和等电点;利用ProtScale(http://web.expasy.org/protscale/)预测亲疏水性,利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白的二级结构,利用NetPhos2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/) 程序预测磷酸化位点。
1.4.2棉花GhLEA3 与其他几个物种LEA3 的进化树分析。在NCBI 上查找胡萝卜(Daucus carota,P20075.1,DcLEA3),野生大豆(Glycine soja,A0A0B2SLH4,GsLEA3),葡萄 (Vitis vinifera,XP_002284002.1,VvLEA3),小麦(Triticum aestivum,AAA34267.1,TaLEA3),欧洲白桦(Betula pendula,CAA79329.1,BpLEA3),肾豆(Phaseolus vulgaris,ABA26579.1,PvLEA3),拟南芥(Arabidopsis thaliana,AAD20140.1,AtLEA3),大豆(Glycine max,AAD01431.1,GmLEA3),毛柽柳(Tamarix hispida,AHJ78644.1,ThLEA3),可可(Theobroma cacao,EOY08068.1,TcLEA3)10 个物种的LEA3 蛋白序列,括号里依次为物种的拉丁文、该物种LEA3 蛋白的GenBank 登录号以及本研究对各物种LEA3 的统一命名。其中AtLEA3 是拟南芥中具有LEA3 典型结构,且在抗逆中起作用的1 个成员。
利用软件MEGA6.06 对棉花GhLEA3 和前述10 个物种的LEA3 蛋白质序列进行聚类分析,使用邻接法(Neighbor-Joining,NJ)构建、绘制系统进化树。
1.5 GhLEA3亚细胞定位分析
利用网站(http://bioinfo.clontech.com/infusion)在线设计In-Fusion 引物(上游引物为InGh-LEA3-F:5'-CACGGGGGACTCTAGAATGGCGACAAGGCAAGAGAA-3',下游引物为InGhLEA3-R:5'-AGGGACTGACCACCCGGGTCACAGATTGGTTTTGTCCGA-3',下划线标识酶切位点),以pBI121-GhLEA3 质粒为模板进行扩增。选择限制性内切酶XbaⅠ和SmaⅠ对植物表达载体pBI121-GFP 进行双酶切,采用In-Fusion 连接技术构建融合蛋白瞬时表达载体35S ∷Gh-LEA3-GFP,转化至大肠杆菌DH5α 感受态细胞,挑选阳性克隆进行测序,同时选用限制性内切酶BglⅡ和EcoRⅠ验证插入位点后提取质粒。选用这2 个酶是因为BglⅡ酶切位点在目标基因Gh-LEA3 上没有,而在表达载体上有,而EcoRⅠ酶切位点在表达载体上没有,而在目标基因上有。亚细胞定位分析参考赵小洁等[18]的方法。
1.6 三叶期棉花幼苗低温胁迫后GhLEA3的实时荧光定量分析
在三叶期对棉苗进行4 ℃处理(24 h),以仍在28 ℃条件下正常培育为对照(CK)。取倒一叶(3 个生物学重复),剪碎,放入液氮中速冻,-80 ℃保存备用。
利用Primer Premier5.0 设计GhLEA3 的荧光定量聚合酶链式反应 (Real time quantitative polymerase chain reaction,qPCR)引物(上游引物GhLEA3-F:5'-TGGAATTGGGTTTGGAGCCG-3',下游引物GhLEA3-R:5'-TCGCATGGTAATCGCCTCAC-3'),以Gossypium hirsutum Histone3(Accession No.:AF024716) 作为内参基因进行qPCR。PCR 程序:94 ℃30 s;94 ℃5 s,55 ℃34 s,72 ℃34 s,共40 个循环。所用仪器为ABI 7500 Real Time PCR System(ABI,美国)。qPCR 结果分析参考Afrin 等[19]报道的2-ΔΔCt方法。每个处理设3 个生物学重复、3 个技术重复。
1.7 转GhLEA3基因拟南芥的遗传转化、检测和抗逆性分析
遗传转化及后代检测:采用农杆菌介导的花序浸染法[20],用外源基因表达载体35S∷GhLEA3-GFP 转化拟南芥野生型,利用含有卡那霉素的1/2 MS 培养基种植筛选转基因种子;按张天豹[21]方法进行培养和繁殖,对获得的T3拟南芥种子按单株收获,种植,采用CTAB 法[22]提取转基因拟南芥和野生型拟南芥叶片的DNA。
利用Primer Premier5.0 软件,在35S 启动子序列设计上游引物(35S-F:5'-CCGGAAACCTCCTCGGATTC-3'),利用GhLEA3 基因设计下游引物(GhLEA3-R:5'-TGGTTTTGTCCGATCGATCA-3'),以野生型拟南芥(WT)作为阴性对照,含有GhLEA3 基因片段的质粒作为阳性对照,同时利用拟南基因Atactin2 为内标基因(上游引物Atactin2-F:5'-TTCCTCATGCCATCCTCCGTCTT-3',下游引物Atactin2-R:5'-CAGCGATACCTGAGAACATAGTGG-3') 对转GhLEA3 基因拟南芥T3和野生型拟南芥叶片所提取的DNA 进行PCR 扩增。所用程序为94 ℃,5 min;94 ℃45 s,58℃45 s,72 ℃30 s,40 个循环;72 ℃10 min。利用10 g·L-1琼脂糖凝胶电泳,观察条带并照相。
低温萌发试验:将转GhLEA3 基因拟南芥T3种子和野生型(WT)在25 ℃(CK)常温条件下和4 ℃低温条件下分别进行萌发试验。参考张天豹[21]方法进行,将T3种子和WT 种子分别均匀点播于同一培养皿上,每板各播50 粒T3种子和WT 种子,共播6 板,其中3 板放入25 ℃恒温培养箱中作为对照处理,另外3 板放入4 ℃冰箱中作为低温处理,20 d 后调查萌发数,以拟南芥种子发白为萌发标准,计算萌发率。
转基因拟南芥苗期叶片细胞膜透性测定:拟南芥苗移栽后在20 ℃条件下正常培养14 d,此时尚未抽薹。对其进行低温处理:4 ℃处理24 h,并以处理0 h (仍为20 ℃条件培养) 为对照(CK),取全部叶片,剪碎,每重复称2 g 左右,3个重复,放到5 mL 离心管中,加入2 mL 去离子水,混匀,测其电导率,具体测定方法参考王俊娟等[23]的方法。
1.8 数据分析
采用MS Excel 2003 进行数据处理和作图;利用Stata 11.0 软件进行方差分析。
2 结果与分析
2.1 GhLEA3 基因克隆
在前期的陆地棉低温转录组试验中,发现1个功能注释为LEA3 蛋白的基因受4 ℃低温胁迫后在棉花叶片中上调表达,推测其与棉花的抗冷性有一定的相关性。依据文献报道[24-25],在NCBI中搜索已知的拟南芥 (AAD20140.1)、 胡萝卜(P20075.1)的LEA3 蛋白质序列,在棉花基因组计划(Cotton Genome Project,CGP)网站(http://cgp.genomics.org.cn/page/species/index.jsp) 进行blastp 比对,搜索到相似的蛋白序列,同时查找其对应的编码序列,设计引物,以棉花TM-1 叶片的cDNA 为模板,扩增出完整的编码序列(图1),得到的阅读框长度为1 218 bp,测序结果正确。

图1 GhLEA3在陆地棉中的PCR扩增产物Fig.1 Products of PCR amplification of GhLEA3 gene from Gossypium hirsutum L.
2.2 棉花GhLEA3蛋白质的等电点、相对分子质量及二级结构域的预测和功能结构域分析
GhLEA3 蛋白质包含405 个氨基酸,预测相对分子质量为44.5 kDa,等电点5.88。对其序列进行分析,发现GhLEA3 蛋白中富含丙氨酸(15.8%)、赖氨酸(13.8%)和谷氨酸(12.1%),含少量色氨酸和异亮氨酸(0.5%),不含半胱氨酸、吡咯赖氨酸和硒半胱氨酸(图2A);蛋白呈酸性,带负带荷,带负电荷的残基总数(Asp+Glu)为84个,带正电荷的残基总数(Arg+Lys)为79 个;预测半衰期约为30 h,不稳定指数为29.37,为稳定蛋白。蛋白的亲疏水性分析发现,蛋白中亲水性氨基酸明显多于疏水性氨基酸(图2B),亲水性平均系数为-1.302,属亲水性蛋白。SOPMA 分析结果(图2C)表明:GhLEA3 蛋白的二级结构α螺旋 (Alpha helix) 包含286 个氨基酸残基,占70.62%,组成该蛋白的主体结构;无规则卷曲(Random coil) 的氨基酸残基有86 个,占21.23%;延伸链(Extended strand)包含17 个氨基酸残基,占4.27%;β- 转角(Beta turn)包含16 个氨基酸残基,占3.95%。推测该蛋白的功能结构域主要由α 螺旋构成。

图2 GhLEA3蛋白结构分析Fig.2 Protein structure analysis of GhLEA3 protein
SMART 和InterPro 分析表明,该氨基酸序列含有5 个功能结构域PF02987(LEA_4),分别位于第111 ~152、143 ~184、165 ~201、198 ~241、271~314 个氨基酸,表明该蛋白拥有LEA家族中第3 组成员的典型结构[26-27],属于LEA3类蛋白,命名为GhLEA3。
2.3 棉花GhLEA3蛋白的磷酸化位点预测
GhLEA3 基因所编码蛋白共含有83 个磷酸化位点,其中含有36 个丝氨酸(Serine)磷酸化位点、31 个苏氨酸 (Threonine) 磷酸化位点、16个酪氨酸(Tyrosine)磷酸化位点(图3)。由此推测,GhGLEA3 蛋白的活性与其磷酸化调控关系密切。

图3 棉花GhLEA3蛋白的磷酸化位点预测Fig.3 Protein phosphorylation sites prediction of GhLEA3 protein
2.4 棉花GhLEA3蛋白与其他植物LEA3蛋白的进化关系分析
对棉花GhLEA3 基因编码的蛋白序列与其他物种LEA3 蛋白序列的进化树分析结果(图4)表明,11 个LEA3 蛋白质被分为2 类,小麦和肾豆LEA3 蛋白单独聚为一类,其余9 个物种聚为第二类。第二类又可分为2 个亚类:棉花与拟南芥LEA 遗传距离最近,同时与大豆、可可、欧洲白桦、胡萝卜、葡萄LEA3 遗传距离亦较近,为一个亚类;野生大豆、毛柽柳与棉花LEA3 遗传距离比较远,聚为另一个亚类。进一步分析表明,GhLEA3 与AtLEA3 的氨基酸序列相似性为52.6%,一致性为41.6%。
2.5 35S∷GhLEA3-GFP荧光表达载体的酶切验证和亚细胞定位分析
挑选阳性克隆进行测序,目标序列比对结果正确。表达载体酶切验证结果(图5)表明,表达载体构建成功,将其命名为35S∷GhLEA3-GFP。

图4 棉花GhLEA3蛋白与10个植物LEA3蛋白的进化树分析Fig.4 Phylogenetic tree analysis of GhLEA3 protein and 10 LEA3 proteins of other plants

图5 35S∷GhLEA3-GFP表达载体酶切验证Fig.5 Enzyme digestion of expression vector 35S∷GhLEA3-GFP
通过瞬时表达系统对GhLEA3 蛋白的亚细胞定位显示,对照pBI121-GFP 的绿色荧光分布在整个细胞中 (图6A ~C),而35S ∷Gh-LEA3-GFP 融合蛋白的绿色荧光信号大多分布在液泡和小泡里(图6D~F),推测GhLEA3 蛋白可能在液泡和小泡里发挥作用。这也说明该基因能够正常表达,为下一步使用基因枪活体转化拟南芥和棉花材料提供了理论依据。
2.6 低温胁迫条件下GhLEA3基因在三叶期棉苗叶片中的表达
qPCR 分析结果(图7)表明,与CK(28 ℃培养)相比,4 ℃低温胁迫处理24 h 后,GhLEA3 基因在三叶期棉苗叶片中的表达水平提高近10倍,说明GhLEA3 基因在棉苗叶片响应低温胁迫过程中起正调控作用。
2.7 转GhLEA3基因拟南芥的抗卡那霉素筛选与分子检测结果

图6 棉花GhLEA3蛋白的亚细胞定位Fig.6 Sub-cellular localization of GhLEA3 protein
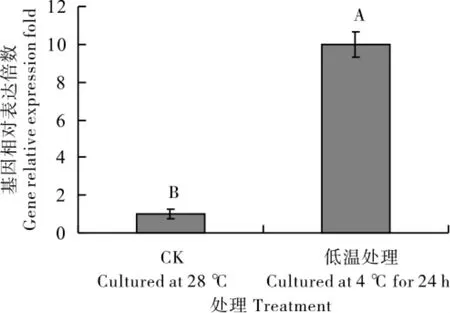
图7 低温胁迫条件下GhLEA3基因在三叶期棉苗叶片中实时荧光定量分析Fig.7 Expression of GhLEA3 gene in cotton leaf at the three-leaves stage under low temperature stress treatment by qPCR method
对收获的20 个转GhLEA3 基因拟南芥T1阳性植株后代分别进行抗卡那霉素筛选,至T2时黄化苗(野生型)已占很小比例,到T3时已无黄化苗,表明得到了纯合的T3阳性植株(图8),可以利用它们进行下一步的分子检测和抗逆性试验。
对转GhLEA3 基因的拟南芥T3植株、 野生型拟南芥、pBI121-GhLEA3 质粒等进行扩增并检测,发现转基因植株T3-1、T3-2、T3-3、T3-9 和T3-11有明显的大约1 218 bp 的特异条带,在单株T3-7中该条带稍弱,但也显示正常,与阳性对照质粒中扩增出的目标条带大小一致,在阴性对照野生型拟南芥植株中则无条带(图9),表明获得了稳定的转GhLEA3 基因的阳性拟南芥植株。该结果证明抗卡那霉素筛选结果是可靠的。
2.8 转GhLEA3基因拟南芥T3种子在低温条件下的萌发试验结果
在正常温度(25 ℃)下,转GhLEA3 基因拟南芥T3与野生型(WT)种子发芽率均达100%,没有差异。4 ℃处理20 d 后转GhLEA3 基因拟南芥T3种子的发芽率为95.92%,显著高于野生型的(78.31%),说明转GhLEA3 基因提高了拟南芥种子在低温条件下的萌发能力。
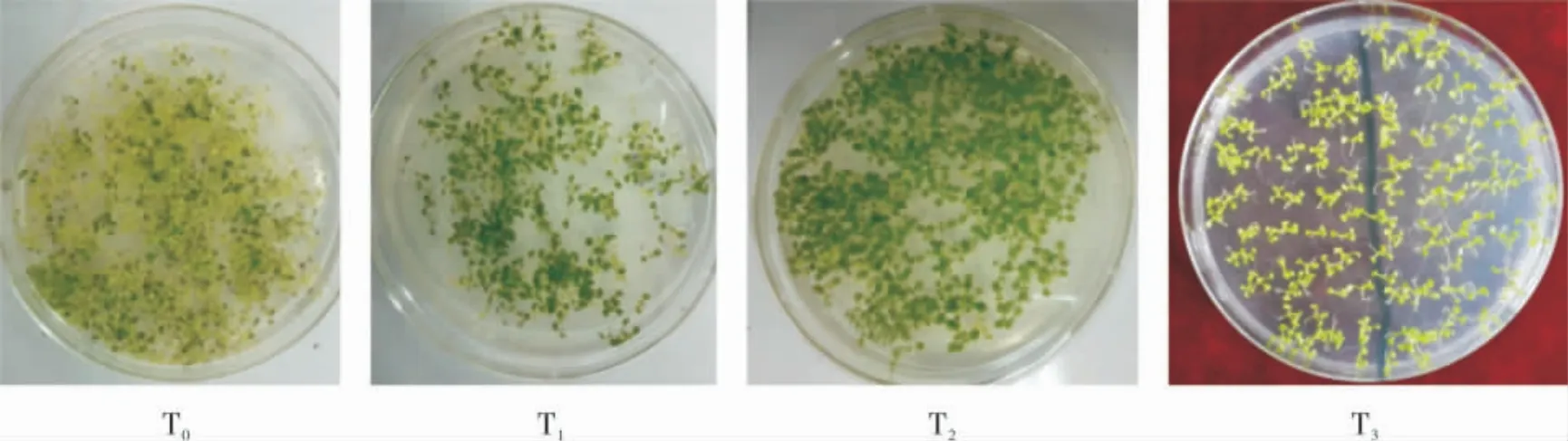
图8 卡那霉素对转GhLEA3基因拟南芥的有效筛选Fig.8 Effective screening of transgenic Arabidopsis thaliana by GhLEA3 gene in kanamycin culture medium

图9 转GhLEA3基因拟南芥T3植株的PCR检测Fig.9 PCR production detection of transgenic Arabidopsis T3 plants with GhLEA3 gene
2.9 转GhLEA3基因拟南芥T3苗期叶片细胞膜透性
电导率测定结果(图10)表明,野生型拟南芥(WT)叶片受低温胁迫后,电导率比CK(20 ℃培养)极显著上升,说明其叶片受低温胁迫后细胞膜破裂,电解质大量渗漏;而转GhLEA3 基因拟南芥T3叶片电导率与CK 差异不显著,说明其细胞膜在低温胁迫时受到了保护。由此推测,Gh-LEA3 蛋白在低温胁迫条件下可能对叶片细胞膜起保护作用。
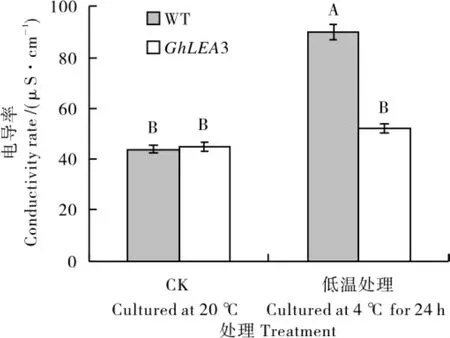
图10 转GhLEA3基因拟南芥T3和野生型叶片的电导率对比Fig.10 The conductivity rate of leaves from transgenic Arabidopsis thaliana T3 plants with GhLEA3 gene and its wild type
3 讨论
GhLEA3 蛋白中富含丙氨酸、赖氨酸和谷氨酸(12.1%),色氨酸和异亮氨酸含量较少(0.5%),不含半胱氨酸,这与LEA3 蛋白由高度亲水性氨基酸组成、富含赖氨酸和甘氨酸,缺乏半胱氨酸和酪氨酸的特征相似[28],这种亲水性使LEA3 蛋白可能保持细胞水分和防止其他蛋白凝聚或脱水[29]。但GhLEA3 蛋白中甘氨酸含量较少,很可能是物种间差异造成的。也可能正是LEA3 基因家族编码产物结构的多样性,造成了LEA3 基因家族功能的多样性。二级结构预测显示,GhLEA3蛋白的二级结构主要由α- 螺旋组成,高比例的α- 螺旋二级结构保障蛋白具有高度的柔性和流动性,可以在逆境条件下进行结构变异[9],从而保护细胞结构,特别是严重脱水或冰冻时使膜系统免遭伤害,推测正是GhLEA3 蛋白的这些结构特点为其在低温条件下提高转基因拟南芥的萌发能力和叶片抗冷性奠定了结构基础。
不同植物中LEA3 蛋白的亚细胞定位不同,如小麦中LEA3 定位于细胞质或细胞核[16];拟南芥中的LEA3 蛋白COR15A 被定位于叶片的叶绿体基质中[30];禾本科作物如黑麦、小麦、大麦中的类似LEA3 蛋白含有分类信号,使其易于定位叶绿体或线粒体中[14];桑树的LEA3 蛋白WAP27位于内质网中[31],玉米的ZmLEA3 蛋白在细胞质和细胞核中发挥作用[32];胡萝卜中LEA3 蛋白DC8位于成熟种子的内膜系统、 细胞壁和液泡中[25]。LEA3 不同的亚细胞定位为LEA3 蛋白功能的多样性提供了有力的证据。在本试验中,亚细胞定位结果表明,GhLEA3 蛋白定位于液泡和小泡中,这与大麦的LEA3(HVA1)[33]、胡萝卜LEA3蛋白DC8 定位相似[25]。Marttila 等[33]研究表明HVA1 定位在细胞质和液泡中,且HVA1 蛋白不能被糖基化,所以有可能利用1 种可变的、非内质网依赖的液泡途径,促使液泡中的离子重新分配以阻止蛋白在胁迫条件下沉降;同时,冷处理或干旱胁迫能显著增加发芽的大麦种子中HVA1 基因的表达。由此推测GhLEA3 蛋白在液泡中积累也有类似的功能,需要进一步挖掘验证。虽然胡萝卜中LEA3 蛋白DC8 的N 段没有明显的疏水结构,但试验证明DC8 蛋白通过内质网- 高尔基体途径运输,随后沉积在液泡或细胞壁中[25]。推测GhLEA3 蛋白有可能与大麦的HVA1 和胡萝卜的DC8 有相似的功能,本试验已初步验证了GhLEA3 在抗冷方面的功能,其在抗旱中的作用还需进一步验证。
聚类分析表明,GhLEA3 与拟南芥LEA3 蛋白AtECP63[24]亲缘关系最近,同时与大豆、可可、欧洲白桦、胡萝卜、葡萄的LEA3 蛋白亲缘关系亦较近,推测它们可能有相似的功能。研究表明,AtECP63 参与拟南芥种子成熟和种子脱水胁迫过程[24];而拟南芥中另一个LEA3 基因COR15A属于冷诱导基因[4],其在低温条件下表达量与拟南芥品种的抗冻性呈正相关[34],具有保护细胞膜的功能[35],与棉花的LEA3 基因功能相似;另据Hsing 等[36]报道,大豆叶片组织中LEA3 的RNA水平在干旱或低温胁迫条件下明显提高,其功能也与棉花的LEA3 基因有部分相似之处;Goupil等[37]研究表明,胡萝卜的LEA3 基因DC8 受脱落酸诱导。GhLEA3 是否具有其他功能还需进一步深入研究。
转LEA3 基因可以显著提高植物的耐低温能力[16,32]。受低温胁迫后,GhLEA3 基因在棉花叶片中上调表达,且转GhLEA3 基因拟南芥叶片电导率比野生型极显著降低。这些研究结果暗示GhLEA3 可能在响应低温胁迫过程中保护叶片的细胞膜,这与玉米ZmLEA3 的功能有相似的地方。Liu 等[32]研究表明,过表达ZmLEA3 可以提高转基因烟草和酵母的耐低温能力,通过保护功能蛋白质结构以及与重金属离子结合来保护植株。由此推测GhLEA3 基因所表达的蛋白在低温条件下也有稳定和保护细胞结构的功能。GhLEA3基因的抗冷功能还需在转基因棉花上进行进一步的验证。
4 结论
陆地棉GhLEA3 属于典型的LEA3 家族成员,其编码的蛋白质具有亲水性;与拟南芥亲缘关系最近,响应低温胁迫,属于冷诱导型基因。转基因试验证明GhLEA3 可以提高拟南芥在低温条件的萌发能力及叶片的抗冷能力,推测Gh-LEA3 基因的表达对细胞膜起保护作用,是棉花适应低温环境的重要调控因子。

