陆地棉HRD转录因子基因原核表达与亚细胞定位分析
陈琴,曲延英,倪志勇,韩玉慧,程浩然,陈全家
(新疆农业大学农学院/ 新疆农业大学农业技术重点实验室,乌鲁木齐830052)
我国新疆及长江流域夏秋季节常晴热少雨,严重影响棉花的产量和品质。为了抵抗干旱(盐)胁迫,棉花进化出了响应胁迫的复杂代谢通路,从而实现抗(耐)逆反应[1-2],而大部分胁迫应答基因的转录激活和抑制是通过转录因子的调控实现的[3]。对棉花转录因子的研究有助于揭示棉花应对非生物胁迫的生理和分子机制[4-5]。
AP2 (Apetala 2)/ERF 转录因子家族是1 个庞大的家族,参与了植物细胞的生长发育以及逆境胁迫等多个代谢过程的调节[6-7]。该家族基因首先于1994年在拟南芥中被分离,参与拟南芥花和种子的发育调控[8]。随后在烟草中也发现了4 个可以结合GCC-box 的蛋白,可以受到乙烯的诱导,因此被命名为乙烯反应元件结合蛋白(Ethylene-responsive element binding proteins,EREBPs),也称为乙烯响应因子(Ethylene response factors,ERF)[9]。在棉花中,Shaheen 等[10]研究表明,GaDREB基因在水分胁迫90 min 后表达量最高,并能够与NAC、MYB、AREB、ABRE 和DRE/CRT 相互作用,它们通过脱落酸途径参与棉花各种干旱胁迫反应。HRD基因是AP2/ERF转录因子基因家族的成员。据Karaba 等[11]研究发现,在干旱胁迫下,过表达拟南芥HRD基因可以增加水稻(Oryza sativa)根的分枝,提高叶片光合同化作用效率,从而通过增强水稻水分利用率来提高水稻的抗旱性。Abogadallah 等[12]研究表明,在埃及三叶草(Trifolium alexandrinumL.)中过表达HRD基因,可降低三叶草蒸腾速率,保护光合作用系统,从而增强水分利用率。对干旱胁迫下转线果芥(Conringia planisiliquaL.)HRD基因烟草与野生型烟草的7 项生理指标及形态、气孔变化对比分析,发现转基因烟草获得了比野生型烟草更好的抗旱能力[13]。但目前关于HRD转录因子基因在棉花抗逆过程中的生理和分子机制尚不清楚。因此,本研究利用pET 原核表达系统成功表达了GhHRD 重组蛋白,并分析了其亚细胞定位和转录激活功能,这些研究的开展有助于进一步阐明GhHRD基因参与棉花抗逆的分子机制。
1 材料与方法
1.1 植物材料
本实验室前期鉴定了8 份陆地棉品种 (系)的抗旱及耐盐水平,结果显示它们综合抗逆水平排序为新陆中 36 号>Y1169 >10615-3 >ND359-5>CQJ-5>KK1543>新炮1 号>新陆早26 号[14]。因此,选择新陆中36 号作为试验材料。
1.2 载体和试剂
pET-28a(+)、pCAMBIA1304、pGBKT7、BL21(DE3)、EHA105、酵母菌AH109、大肠杆菌DH5α感受态、pEASY-T1 Simple Cloning Kit 购自北京全式金生物技术有限公司;蛋白胨、酵母提取物、氨苄青霉素购自宝信生物科技公司;反转录试剂盒、限制性内切酶BamHⅠ、SalⅠ、NcoⅠ和SpeⅠ、T4DNA 连接酶、YPDA 培养基、SD/-Trp 培养基、SD/-Trp/-His/-Ade 营养缺陷型培养基购自赛默飞世尔科技有限公司;质粒DNA 提取试剂盒、琼脂糖回收试剂盒、Taq酶、dNTP、DNA marker 购自天根生化科技有限公司;利福平、异丙基-β-D- 硫代半乳糖苷(IPTG)购自北京索莱宝科技有限公司;引物合成和测序由上海生工生物工程有限公司完成。
1.3 基因的克隆
根据NCBI 提供的拟南芥HRD基因核苷酸序列(登录号:NM_129202.1)设计聚合酶链式反应(Polymerase chain reaction,PCR)引物,以新陆中36 号的cDNA 为模板,以包含开放阅读框的引物(P1:5'-GGATCCATGCATTACTCCAAACCCAA-3',P2:5'-GTCGACTTAAGGGAATTTCCAGAGGTT-3',其中下划线部分依次是BamHⅠ和SalⅠ酶切位点) 扩增目的基因。PCR 体系为10×TaqBuffer 2.0 μL、2.5 μmol·L-1dNTP 2 μL、TaqDNA 聚合酶0.4 μL、10 μmol·L-1上下游引物各0.4 μL、cDNA 2 μL、dd H2O 补足至20 μL。反应程序为95 ℃5 min,95 ℃40 s,52 ℃40 s,72℃1 min,35 个循环后72 ℃10 min。PCR 产物经1%(质量分数) 琼脂糖凝胶电泳回收纯化后,与pEASY-T1 Simple Cloning Kit 载体连接,鉴定阳性克隆,送上海生工生物工程有限公司测序。
1.4 生物信息学分析
采用Protscale(http://web.expasy.org/protscale/)推测蛋白质理化性质;ExPASy(http://prosite.expasy.org/)分析结构域;用DNAMAN 软件进行蛋白多序列比对;利用SWISS-MODEL 进行蛋白建模 (https://www.swissmodel.expasy.org/);用Clustal X 和MEGA 5.0 完成多种氨基酸序列比对及相关蛋白的同源树构建。
1.5 原核表达分析
将阳性质粒和载体pET-28a(+)分别用BamHⅠ和SalⅠ双酶切,连接、转化Escherichia coli/DH5a 感受态细胞后测序。选阳性pET-28a(+)-GhHRD 质粒与空载体分别转化E.coli/BL21(DE3)感受态细胞,各挑取单菌落于50 mL 含卡那霉素(100 mg·L-1)的LB 培养基中,37 ℃培养12 h。次日取0.05 mL 接菌至5 mL 抗性LB 培养基中,于37 ℃振荡培养至OD600约为0.5,各取1 mL 菌液,12 000 r·min-1离心1 min,收集沉淀为对照。剩余的菌液进行原核表达体系优化:(1)诱导时间的优化。选定终浓度1 mmol·L-1IPTG、37 ℃诱导,分别在0 h、1 h、2 h、4 h、6 h、8 h、24 h取样。(2)IPTG 浓度的优化。选定时间4 h、温度37 ℃,分别用0.01 mmol·L-1、0.05 mmol·L-1、0.1 mmol·L-1、0.5 mmol·L-1、1.0 mmol·L-1和2.0 mmol·L-1IPTG 进行诱导。(3)诱导温度的优化。IPTG 浓度0.05 mmol·L-1,时间4 h,分别在25℃、30 ℃、37 ℃条件下诱导。收集的每管菌沉淀加入1 mL 1×十二烷基硫酸钠(SDS)凝胶上样缓冲液,100 ℃煮沸5 min,进行SDS- 聚丙烯酰胺凝胶电泳,并通过湿转转到聚偏氟乙烯膜(PVDF)上进行Western Blotting 分析。
1.6 亚细胞定位分析
设计带有NcoⅠ和SpeⅠ位点的引物(P3:5'-CCATGGATGCATTACTCCAAACCCAA-3',P4:5'-ACTAGTTTAAGGGAATTTCCAGAGGTTAT-3'),将GhHRD基因插入pCAMBIA1304 载体35S 启动子和GFP之间,构建pCAMBIA1304-GhHRD-GFP 瞬时表达载体。采用冻融法将载体导入农杆菌EHA105 菌株。将该菌株活化OD600为0.5,5 000 r·min-1离心10 min 弃上清液,用含有10 mmoL·L-1MgCl2和100 μmol·L-1乙酰丁香酮的MS 液体培养基重悬菌体细胞。将预培养后的第5 层洋葱表皮放入重悬液中浸泡30 min,再转入含有100 μmol·L-1AS 的MS 固体培养基中,25 ℃暗培养28 h,在正置荧光显微镜下观察GFP 信号,确定其亚细胞定位。以pCAMBIA1304-GFP 为对照。
1.7 转录激活功能验证分析
用带有NcoⅠ和SalⅠ位点的引物 (上游:P3、 下游:P2),将GhHRD基因片段插入pGBKT7 载体,并转化酵母AH109 细胞。将带有pGBKT7 对照载体及鉴定为阳性的 pGBKT7-GhHRD 载体的酵母菌活化,分别涂布在SD/-Trp 营养单缺型培养基和SD/-Trp/-His/-Ade营养缺陷型(三缺)培养基上,30 ℃倒置培养3~5 d 后,观察酵母生长情况。
2 结果与分析
2.1 GhHRD 基因的克隆与分析
以新陆中36 号的cDNA 为模板,利用反转录-PCR 得1 条开放阅读框为555 bp 的核酸序列(图1)。经在线软件ExPASy 分析,该序列编码184 个氨基酸,等电点为5,相对分子质量约为19.539 kDa。位于第27~84 氨基酸处有1 个AP2-ERF 功能结构域(图2A),三维结构预测发现该蛋白由3 个β- 折叠、3 个α- 螺旋和无规则卷曲组成(图2B)。

图1 GhHRD基因RT-PCR电泳图Fig.1 RT-PCR products of GhHRD gene

图2 GhHRD基因结构分析Fig.2 Bioinformatics analysis results of GhHRD
经Blast 比对,筛选出9 条与GhHRD 相似性较高的蛋白序列,DNAMAN 多序列比对发现各物种HRD 蛋白的AP2-ERF 结构域 (图3 红框) 序列高度保守,GhHRD 蛋白AP2-ERF 结构域的第14 位为缬氨酸,第19 位为谷氨酸(图3箭头)。
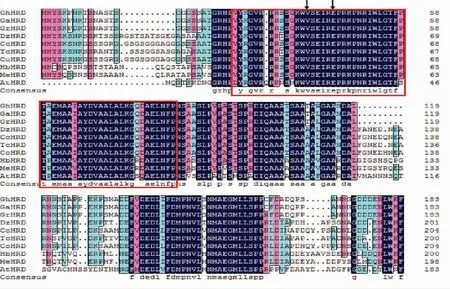
图3 GhHRD蛋白与其他物种HRD蛋白多序列比对Fig.3 Multiple sequence alignment of GhHRD and HRD proteins from other plant
用MEGA5.0 软件邻近连接法(Neighbor-Joining,NJ) 对陆地棉 (Gossypium hirsutumL.)、亚洲棉(G.arboreumL.)、雷蒙德氏棉(G.raimondiiL.)、榴莲(Durio zibethinus)、黄麻(Corchorus capsularisL.)、可可(Theobroma cacaoL.)、埃及锦葵(Corchorus olitoriusL.)、橡胶树(Hevea brasiliensis)、 木薯(Manihot esculenta)、 拟南芥(Arabidopsis thaliana)中的HRD 蛋白序列构建生物系统发育树。图4 结果显示,GhHRD 与亚洲棉、雷蒙德氏棉中HRD 蛋白的亲缘关系最近。
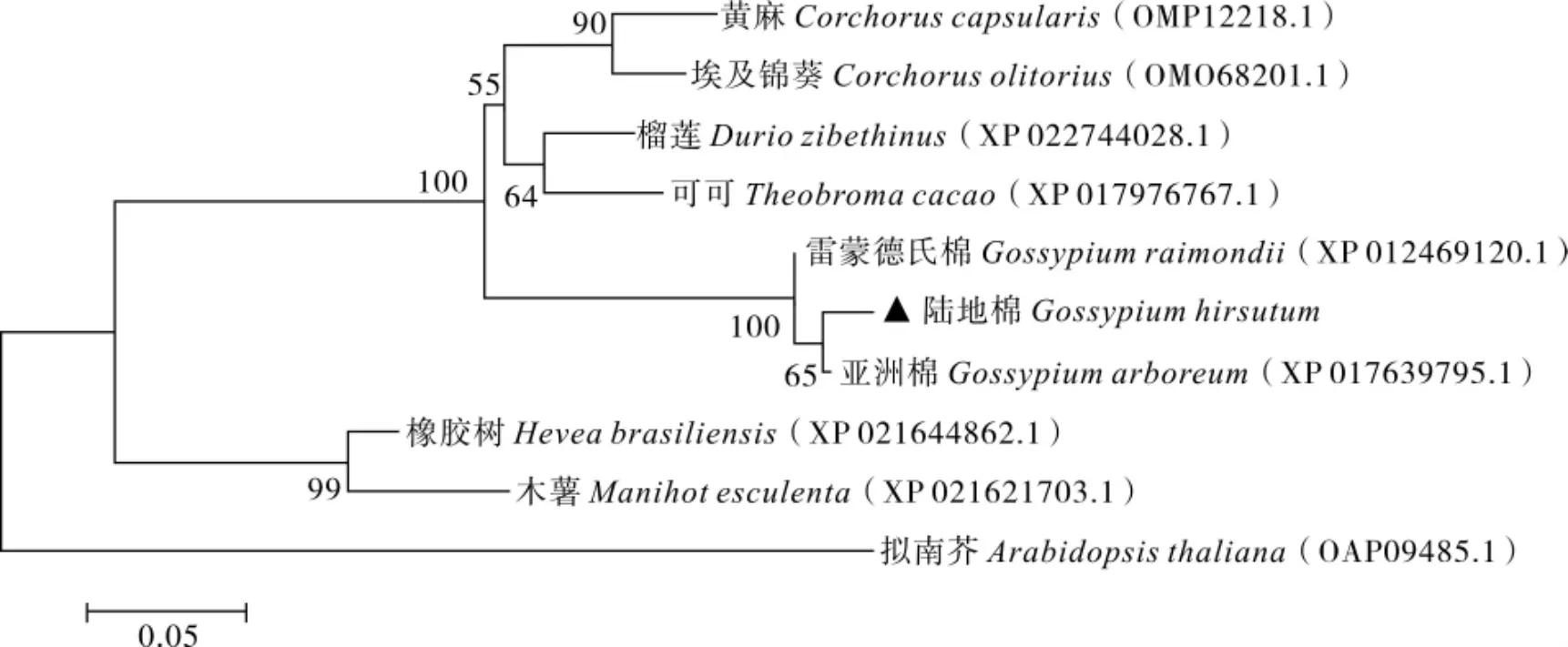
图4 HRD蛋白的系统进化树分析Fig.4 Phylogenetic tree analysis of HRD
2.2 GhHRD蛋白原核表达分析
用引物P1、P2 将GhHRD插入到原核表达载体pET-28a(+),重组质粒经BamHⅠ和SalⅠ双酶切鉴定后,琼脂糖凝胶电泳显示酶切小片段为555 bp 左右(图5),且测序结果与目的序列完全一致,表明pET-28a(+)-GhHRD 原核表达载体构建成功。
用构建好的重组质粒与pET-28a(+)空载体分别转化BL21(DE3)感受态细胞,对重组工程菌BL21/pET-28a(+)-GhHRD 进行IPTG 诱导表达,以BL21/pET-28a(+)为阴性对照。如图6,电泳结果显示,在20 kDa~26 kDa 之间有特异条带,由于重组蛋白His 标签蛋白及相关序列大小约4.8 kDa,因此所表达的蛋白条带大小与GhHRD 预测的19.539 kDa 基本吻合,说明该重组工程菌可以按试验设计正确表达目的蛋白。经诱导条件优化试验,最终发现在25 ℃,0.05 mmol·L-1IPTG 诱导4 h 最佳。将诱导表达的重组蛋白进行Western 印迹分析,在约24 kDa 处出现特异性抗原- 抗体结合带,进一步说明GhHRD 重组蛋白能够表达。
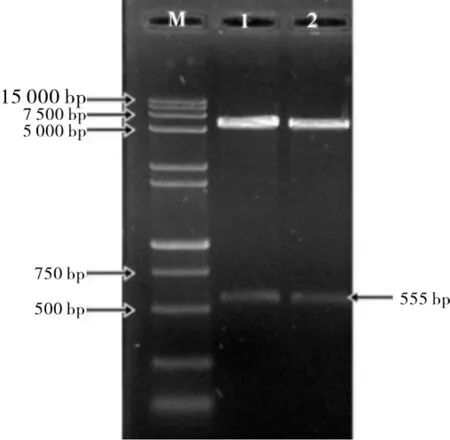
图5 原核表达载体pET-28a(+)-GhHRD双酶切鉴定Fig.5 Identification of recombinant plasmid by double enzyme digestion
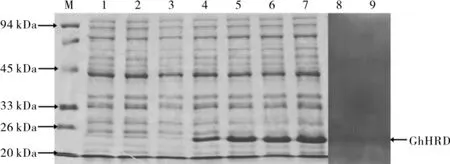
图6 GhHRD重组蛋白原核表达及Western blotting鉴定Fig.6 Prokaryotic expression and Western blotting analysis of recombinant GhHRD protein
2.3 亚细胞定位分析
用引物P3、P4 构建pCAMBIA1304-GhHRDGFP 瞬时表达载体,双酶切和测序结果显示载体构建成功。亚细胞定位结果表明,GhHRD-GFP 融合蛋白荧光信号主要集中于细胞核(图7),该结果验证了生物信息学的预测结果,GhHRD 是1个核蛋白。
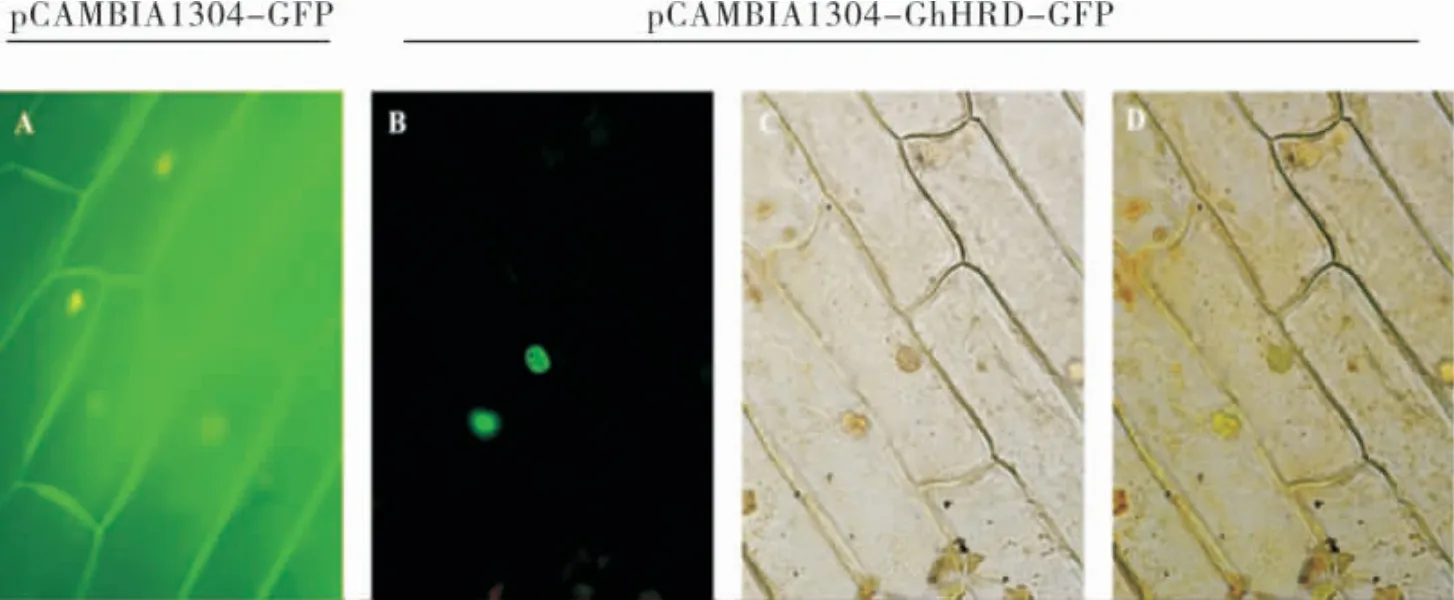
图7 GhHRD在洋葱表皮中的定位Fig.7 Subcellular localization of GhHRD fusion protein in onion epidermal cells
2.4 转录激活功能验证分析
GhHRD为转录因子基因,为验证其是否具有转录激活作用,以pGBKT7 载体为阴性对照,将目标基因转化AH109 酵母感受态细胞。如图8所示,二者在酵母单缺培养基SD/-Trp 中生长状态一致,而在三缺培养基SD/-Trp/-His/-Ade 上,转入pGBKT7-GhHRD 的酵母菌株可以正常生长,阴性对照无法生长。说明效应基因都能够正常表达,激活了下游的报告基因,使其能够在His 和Ade 缺陷培养基中正常生长。这说明,GhHRD 融合蛋白对酵母菌株无毒性,GhHRD基因具备转录自激活功能,验证了GhHRD 是转录因子。

图8 GhHRD转录激活活性分析Fig.8 Transcriptional activation analysis of GhHRD
3 讨论
AP2/ERF 转录因子家族含有1 个由60~70个氨基酸组成的保守的AP2/ERF 结构域。依据结构域的数量,AP2/ERF 家族可以分为4 个亚族,分别是含2 个结构域的AP2 亚族、1 个结构域的干旱应答元件结合蛋白(Dehydration-responsive element-binding protein,DREB) 亚族和ERF亚族、1 个结构域和1 个B3 结构域的RAV(Related to ABI3/VP1)亚族,其中DREB 亚族在保守域的第14 位都具有保守的缬氨酸 (V14),在第19 位都有谷氨酸(E19),而ERF 亚族在第14 位为丙氨酸(A14),第19 位为天冬氨酸(D19),但也有例外[15]。本试验克隆的GhHRD基因编码产物含有1 个AP2/ERF 结构域且在第14 位为缬氨酸,第19 位为谷氨酸,因此GhHRD 属于AP2/ERF 转录因子家族的DREB 亚组。
干旱应答元件结合蛋白(DREB)能够专一性识别顺式作用元件DRE (Dehydration responsive element)/CRT(C-repeat),主要在干旱和冷诱导的响应过程中发挥作用[16]。研究发现,在低温和干旱胁迫的试验中,转DREB1 基因的拟南芥植株生长良好,而对照组全部死亡[17]。Liu 等[18]发现桑树DREB4a基因在干旱、NaCl、 低温和高热处理后表达增高,过表达DREB4a基因的烟草根长和株高明显高于野生型,且具有更强的耐旱性和耐盐性。Huang 等[19-21]在棉花中克隆了GhDBP2、GhDBP3 基因和GhDREB1L基因,RT-PCR 显示该基因在低温、 干旱和盐胁迫下高效表达。Liu等[22]对棉花转录组进行分析,在雷蒙德氏棉中共鉴定出269 个AP2/ERF 类转录因子基因,在陆地棉TM-1 中鉴定出504 个,其中151 个非重复的DREB 和ERF 亚家族基因对不同胁迫有反应:132 个基因受寒冷诱导,63 个基因受干旱诱导,94 个基因受热诱导。实时荧光定量PCR 证实13 个GhDREB和15 个GhERF基因受冷和/ 或干旱诱导。可见,DREB 类转录因子基因在植物抗逆过程中扮演重要角色,由此推测GhHRD基因可能在棉花逆境胁迫应答反应中扮演重要角色。但目前关于棉花DREB 类转录因子基因GhHRD的克隆和功能验证还未见报道。
4 结论
本研究从陆地棉中克隆了1 个AP2/ERF 家族DREB 类转录因子基因GhHRD,能够经原核表达载体正确诱导表达。该基因编码产物定位于细胞核且具有明显转录自激活功能。通过生物信息学分析推测该基因可能参与了棉花逆境胁迫应答过程,但它在棉花逆境胁迫中的作用及其机理还有待于进一步研究。

