一株生防真菌TRCC27001的鉴定及其抑菌特性
于地美, 黄华毅,2, 梁小文, 李肖宇, 田呈明
(1.北京林业大学林学院省部共建森林培育与保护教育部重点实验室,北京 100083;2.广东省林业科学研究院, 广东 广州 510520;3.江西天人生态股份有限公司,江西 吉安 343100)
由植物病原真菌引起的一系列植物病害对农业和林业的发展具有较大影响,会造成较大的生态危害和经济损失.化学药剂对植物病害的防效高且见效快,是防治各种植物病害的主要手段;但长期使用化学药剂会导致环境污染、病原菌抗药性增强、成本升高以及农药残留等问题[1].因此,发展环保且高效的替代防治方法逐渐成为植物病害研究的重要方向之一.
生防微生物在植物病害防治中表现出良好的防控效果以及生态安全性,具有较大的开发应用潜力[2].用于防治植物病害的生防微生物种类很多,最常见的为真菌类、放线菌类和细菌类[3].其中,真菌中的哈茨木霉(Trichodermaharzianum)、绿色木霉(T.viride)、康氏木霉(T.koningii)、丛枝菌根(Arbuscularmycorrhiza)、粘帚霉(Gliocladiumspp.)等已在生产中广泛应用[4-5].木霉菌是全球研究和应用最多的生防真菌之一,有100多种含木霉菌的生物制剂在多个国家得到广泛使用[6].
目前,对于生防真菌的鉴定主要依靠形态学观察和基因序列分析.常见的用于真菌分子鉴定的序列有ITS、Tef 1-α、cal等[7].对木霉的鉴定以多基因结合的方式为主,常用ITS序列和Tef 1-α基因结合进行分子生物学分析.本研究将对菌株TRCC27001进行鉴定,并测定其对多种常见林业、农业病原真菌的抑制能力和筛选其最佳发酵培养基,以期为该菌株在植物病害生物防治中的实际应用提供依据.
1 材料与方法
1.1 材料
1.1.1 供试菌株 生防真菌TRCC27001,由江西天人生态股份有限公司提供.植物病原真菌包括立枯丝核菌(Rhizoctorziasolani)、金黄壳囊孢(Cytosporachrysosperma)、禾谷镰刀菌(Fusariumgraminearum)、大丽轮枝菌(Verticilliumdahliae)、杨树炭疽菌(Colletotrichumpopuli)、胶孢炭疽菌(Colletotrichumgloeosporioides)、尖孢镰刀菌(Fusariumoxysporum)、毛霉(Mucorsp.)、犁头霉菌(Absidiasp.)、葡萄座腔菌(Botryosphaeriadothidea)、黑腐皮壳菌(Cytosporaambiens)、细极链格孢(Alternariatenuissima),均由中国林业微生物菌种保藏管理中心提供.
1.1.2 供试培养基 PDA培养基(马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,琼脂粉17 g),PDB培养基为不加琼脂粉的PDA培养基,胶霉毒素培养基(葡萄糖25 g,酒石酸铵2 g,FeSO40.01 g,MgSO4·7H2O 1 g,蒸馏水1 000 mL),麦芽浸膏培养基(麦芽浸膏30 g,大豆蛋白胨3 g,无水葡萄糖20 g,蒸馏水1 000 mL),察氏培养基(蔗糖30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,K2HPO41 g,蒸馏水1 000 mL),YEMEA 1(酵母膏10 g,麦芽膏10 g,葡萄糖4 g,蒸馏水1 000 mL),麸皮培养基[麸皮36 g,(NH4)2HPO410 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g, 蒸馏水1 000 mL],燕麦培养基[(燕麦片20 g,微量元素溶液1 mL(FeSO4·7H2O 1 g·L-1, MnCl2·4H2O 1 g·L-1, ZnSO4·7H2O 0.1 g·L-1),蒸馏水1 000 mL],CMD培养基(玉米粉30 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL).
1.2 生防菌TRCC27001对多种植物病原真菌拮抗效果的测定
通过平皿对峙法[8]检测生防菌TRCC27001对多种植物病原真菌的拮抗效果.在直径90 mm的PDA平板上距中心3 cm的相对位置处,分别接种直径6 mm的病原菌和生防菌菌饼,每个处理重复3次,倒置于25 ℃恒温培养箱中培养.以病原菌的单独培养作为对照,每24 h观测菌落纵横半径.计算培养96 h后菌株TRCC27001对病原菌丝生长的抑制率,以及生防菌株与病原菌之间的相对抑制率[9].
菌落生长抑制率/%=(病原菌对照组菌落半径-对峙培养病原菌落指向生防真菌的半径)/病原菌对照组菌落半径×100;
生防菌被抑制率/%=(生防真菌对照组菌落半径-对峙培养生防真菌指向病原菌落的半径)/生防真菌对照组菌落半径×100;
相对抑菌率=菌落生长抑制率/生防菌被抑制率.
1.3 生防菌TRCC27001最佳发酵培养基的筛选
1.3.1 生防菌的发酵培养 生防菌株TRCC27001的发酵培养基为培养丝状真菌及木霉属菌株的7种常见培养基.其中,制作燕麦片培养基时需先将燕麦60 ℃水浴1 h,再用4层纱布过滤.发酵培养的具体方法:取生防菌TRCC27001的新鲜菌丝块(6 mm)5块,接入装有100 mL发酵培养基的三角瓶(500 mL)中,25 ℃、150 r·min-1振荡培养10 d;将发酵培养液于10 000 r·min-1、4 ℃条件下离心,取上清液,用孔径0.45 μm的滤膜过滤除菌,得到无菌发酵液.
1.3.2 生防菌无菌发酵液的抑菌活性检测 将TRCC27001无菌发酵液与加热冷却至40~50 ℃的PDA以1∶10(v/v)的比例混合,倒平板,在平板中央分别接入新鲜的金黄壳囊孢菌饼(6 mm),25 ℃倒置培养,每隔一天采用十字交叉法测量病原菌落直径,直至对照组菌落即将长满平皿为止.以不加TRCC27001无菌发酵液的平板作为对照,每个处理设3个重复,计算相对抑菌率[10].
相对抑菌率/%=(对照组扩展直径-处理组扩展直径)/对照组扩展直径×100.
1.4 生防菌TRCC27001无菌发酵液的活性稳定性分析
以金黄壳囊孢为指示菌,分别测定采用麸皮发酵培养基培养后的菌株TRCC27001无菌发酵液在不同酸碱度、温度及辐射时间下的抑菌活性.供试的生防菌无菌发酵液制备后于4 ℃保存备用.每个处理均设3次重复,以未经处理的发酵液混合培养基培养金黄壳囊孢作为对照组,计算相对抑菌率.
相对抑菌率/%=(未混合无菌发酵液组的培养菌落扩展直径-处理组菌落扩展直径)/(未混合无菌发酵液组的培养菌落扩展直径-对照组菌落扩展直径)×100.
1.4.1 不同pH处理下的稳定性 取适量生防菌无菌发酵液,用1 mol·L-1HCl和1 mol·L-1NaOH分别将其调成不同pH值,4 ℃放置30 min,再将各样品的pH值调回中性后,检测各处理无菌发酵液的抑菌活性.以不经酸、碱处理的原样品为对照.
1.4.2 不同温度处理下的稳定性 取适量生防菌无菌发酵液分别于5、15、25、35、45、55、65、75、85、95、105 ℃条件下处理30 min.以4 ℃放置的无菌发酵液为对照,检测各处理无菌发酵液的抑菌活性[11].
1.4.3 不同辐射时间下的稳定性 将适量无菌发酵液倒入无盖的培养皿中,用磁力搅拌器缓慢搅拌,并置于30 W的紫外灯下分别照射0.5、1.0、1.5、2.0 h后,检测各处理无菌发酵液的抑菌活性.对照组为未经紫外线辐射的原样品[12].
1.5 生防菌TRCC27001的鉴定
1.5.1 形态学鉴定 采用Jaklitsch[13]的观测指标,结合孙瑞艳等[14]的描述方式对菌株TRCC27001的形态进行鉴定.
1.5.2 分子生物学鉴定 将生防菌TRCC27001用液体培养基培养后,用CTAB提取法提取其基因组DNA.利用通用引物对ITS1/ITS4扩增ITS片段,ITS1序列为5′-TCCGTAGGTGAACCTGCGG-3′,ITS4序列为5′-TCCTCCGCTTATTGATATGC-3′[15].采用Tef 1-α扩增引物EF1T(5′-ATGGGTAAGGAGGACAAGAC-3′)(SEQ ID NO.3)、EF2T(5′-GGAAGTACCAGTGATCATGTT-3′)(SEQ ID NO.4)进行PCR扩增,获得Tef 1-α基因序列[16].PCR扩增反应体系:10×PCR buffer(10 mmol·L-1Tris/HCl pH 8.0, 50 mmol·L-1KCl, 1.5~2.0 mmol·L-1MgCl2),dNTP mix 4 μL,上、下游引物各10 pmol,Taq聚合酶0.5 μL,DNA模板2 μL,加ddH2O至50 μL.PCR扩增循环条件:94 ℃加热3 min使模板DNA 变性;然后94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,共进行35个循环;最后在72 ℃延伸5 min,4 ℃保温.PCR产物经2.0%琼脂糖凝胶电泳检测,在波长365和254 nm的紫外光下检测为明显单一条带的产物,由擎科生物技术有限公司纯化后用ABI3700进行双向直通测序.测得的原始序列采用Bioedit 7.0.9编辑后得到准确序列,经BLAST进行序列比对,得到相似度较高的菌株种类,并与GenBank上的菌株序列组成序列矩阵,再使用最大简约(maximum parsimony,MP)法构建系统发育树.
1.6 数据统计与分析
采用Excel 2010和SPSS 20.0软件对试验数据进行统计分析,对不同处理组间的结果进行单因素方差分析,应用Duncan氏新复极差法检验差异显著性.
2 结果与分析
2.1 生防菌TRCC27001对多种植物病原真菌的拮抗效果
生防菌TRCC27001对12种常见植物病害的病原真菌均有一定的拮抗效果.培养24 h时,菌株TRCC27001对金黄壳囊孢、禾谷镰刀菌、毛霉、杨树炭疽菌、细极链格孢没有抑菌效果,24 h后抑菌率逐渐上升;对葡萄座腔菌、黑腐皮壳菌、立枯丝核菌、犁头霉菌、尖孢镰刀菌以及大丽轮枝菌等病原菌在培养24 h时即表现出一定抑菌效果,之后抑菌效果逐渐增强直至相对稳定.培养96 h时,生防菌TRCC27001对各病原真菌的生长抑制率和相对抑菌率如表1所示.此时,生防菌落与12种病原真菌菌落均相接,当生防菌与病原菌完全接触后,继续向病原菌方向生长,包围和覆盖部分病原菌落;病原菌落被包围后停止生长,且出现萎缩现象.对峙培养168 h时,在与大丽轮枝菌、葡萄座腔菌、黑腐皮壳菌、立枯丝核菌以及毛霉的对峙平板上,生防菌落已布满平皿;在与金黄壳囊孢、禾谷镰刀菌、杨树炭疽菌、胶孢炭疽菌、犁头霉菌、尖孢镰刀菌以及细极链格孢的对峙平板上,生防菌落占据大半个平皿,病原菌落周围萎缩,部分平皿上出现明显的抑菌带和菌丝消解痕迹.平皿上生防菌气生菌丝发达,形成大量的绿色分生孢子堆(图1),对峙作用基本停止.这表明生防菌TRCC27001竞争系数高,在与病原菌的对峙培养中,能迅速占领生态位,抑制病原菌生长.
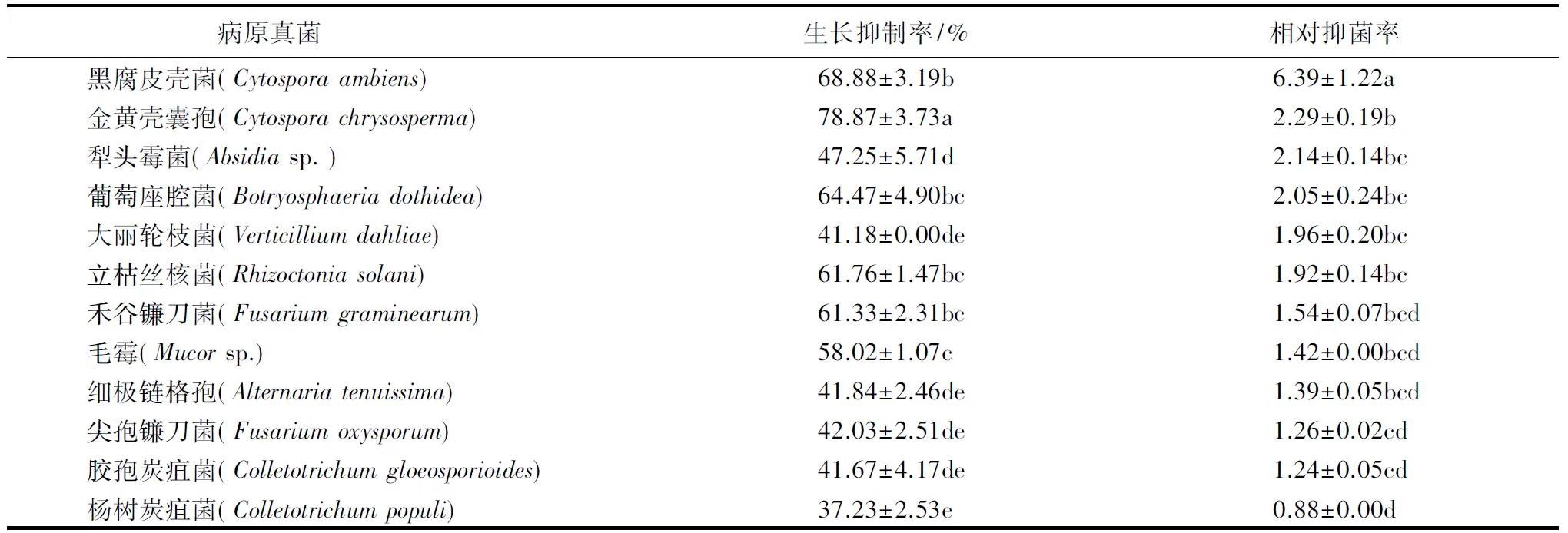
表1 培养96 h时菌株TRCC27001对12种病原真菌的抑制效果1)Table 1 Inhibition effects of strain TRCC27001 on 12 pathogenic fungi after 96 h
1)数据为平均值±标准差.同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
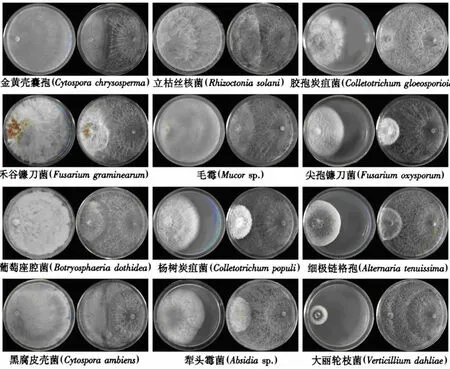
左侧平皿为对照组;右侧平皿为TRCC27001与病原真菌的对峙培养,其中平皿左侧为病原菌,右侧为生防菌TRCC27001.图1 培养168 h时菌株TRCC27001与12种病原真菌的平皿对峙效果Fig.1 Dual-culture effects between strain TRCC27001 and 12 pathogenic fungi after 168 h
2.2 生防菌TRCC27001最佳发酵培养基的筛选
利用麸皮培养基进行发酵培养后,TRCC27001的无菌发酵液对金黄壳囊孢的抑菌能力最强(图2),相对抑菌率达79.40%;经胶霉毒素培养基发酵培养获得的无菌发酵液的抑菌能力最小,相对抑菌率仅为29.79%(图3).
2.3 生防菌TRCC27001无菌发酵液的活性稳定性
菌株TRCC27001无菌发酵液分别经过0.5、1.0、1.5和2.0 h的紫外线辐射后,仍对金黄壳囊孢保持良好的抑菌活性(图4A),指示菌的菌落直径保持在23 mm内;菌株TRCC27001的无菌发酵液经过不同温度处理30 min或在强酸和强碱条件下也均能保持良好的抑菌活性(图4B、4C).这说明菌株TRCC27001的无菌发酵液具有很强的抗逆性.
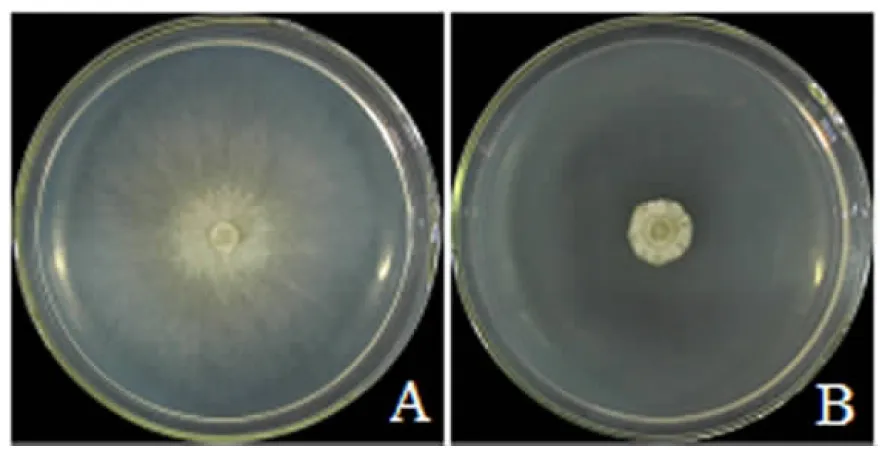
A.对照组;B.处理组.图2 经麸皮培养基发酵培养的TRCC27001无菌滤液对金黄壳囊孢的抑制效果Fig.2 Inhibitory effect of TRCC27001 sterile fermentation broth cultured on wheat bran medium against Cytospora chrysosperma
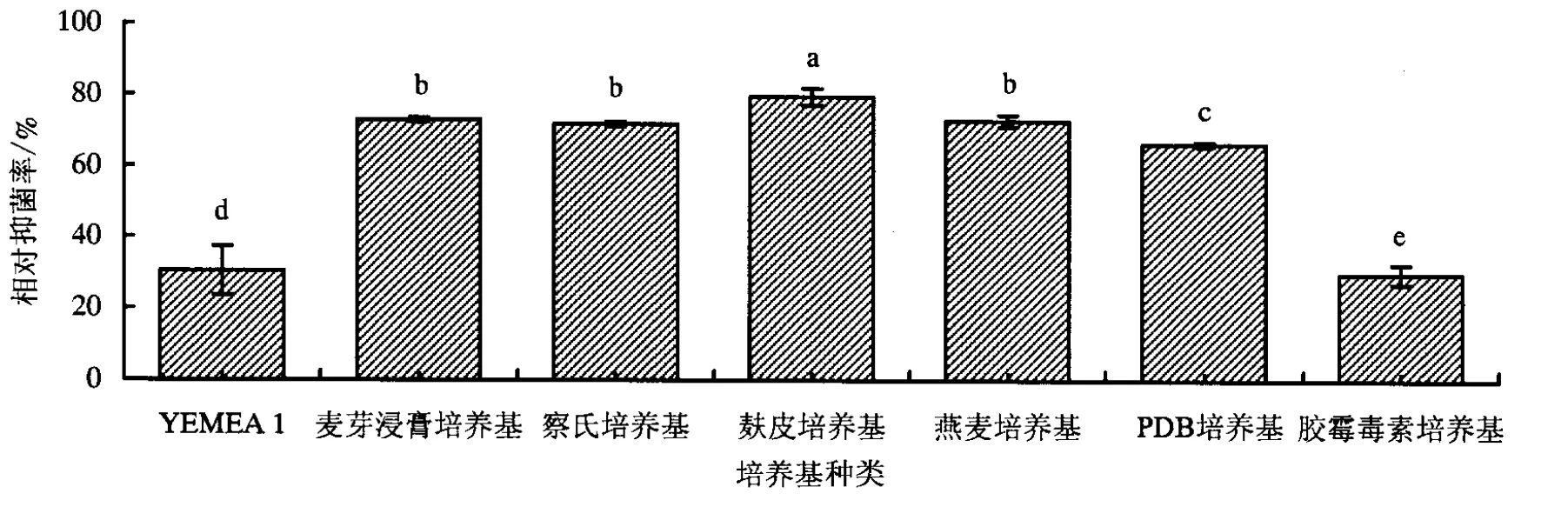
柱上不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05).图3 发酵培养基对TRCC27001无菌发酵液抑菌能力的影响Fig.3 Influences of fermentation mediums on the inhibitory activity of TRCC27001 sterile fermentation broth

图4 辐射时间(A)、温度(B)和pH(C)对无菌发酵液抑菌活性的影响Fig.4 Effects of UV-irradiation time (A), temperature (B) and pH (C) on the inhibitory activity of sterile fermentation broth
2.4 生防菌TRCC27001的鉴定
形态学观察结果表明,纯化的生防真菌TRCC27001菌落在PDA平板上为圆形,生长初期菌丝为白色,气生菌丝少,25 ℃下培养48~72 h后,产生不定型棉絮状白色气生菌丝,分生孢子梗形成小疱,后期气生菌丝呈现同心轮纹状(图5A).生防真菌菌落在CMD平板上为圆形,生长初期菌丝与PDA平板上状态相似,几乎无气生菌丝,25 ℃下培养48 h后,开始形成分生孢子,后期出现明显的分生孢子堆,汇合成宽的灰绿色同心轮纹(图5B、5C).PDA平板上菌落背面开始时无色,后期呈暗黄色.显微镜下观察,菌丝无色纤细,具分隔,多分枝;分生孢子梗从菌丝的侧枝上生出,一般具有2~3个轮生的分枝,瓶梗安瓿形,单生或对生,轮枝状排列(图5D).大多数分生孢子为卵圆形或亚球形,壁光滑(图5E、5F).
以菌株TRCC27001基因组DNA为模板,用ITS序列通用引物扩增出一条长度为616 bp的序列,并用Tef 1-α序列通用引物扩增出一条长度为865 bp的序列(GenBank登录号:KX810817).ITS序列与已知种TrichodermavirensGv29-8的同源性高达99%,Tef 1-α序列与菌株Gv29-8的同源性高达98%.系统进化树(图6)表明,菌株TRCC27001与T.virens聚成一类,且遗传距离最短,结合其生物学特性以及形态学特征,最终将菌株TRCC27001鉴定为绿木霉(T.virens).
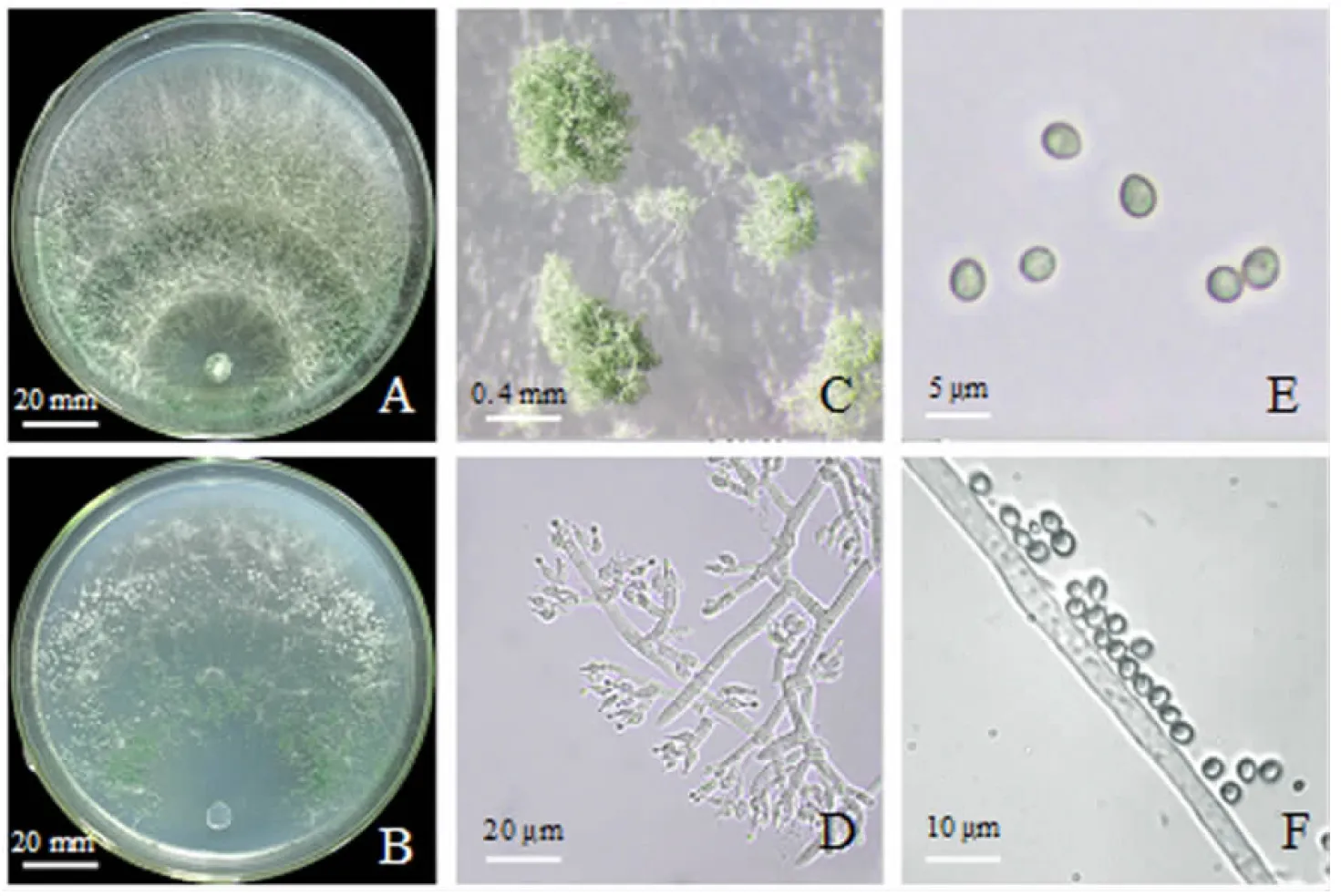
A.PDA平板上的菌落形态;B.CMD平板上的菌落形态;C.CMD平板上的分生孢子堆形态;D.CMD平板上的分生孢子梗和层生瓶梗;E、F.分生孢子.图5 TRCC27001的形态特征Fig.5 Morphological characteristics of strain TRCC27001

图6 基于ITS序列和Tef 1-α序列以最大简约法构建的木霉属系统发育树Fig.6 Phylogenetic tree of Trichoderma constructed by MP method based on combined ITS and Tef 1-α sequences
3 讨论
目前,随着杨树栽植面积的不断扩大,由金黄壳囊孢引起的杨树腐烂病日益严重.发病重灾区常有林木成片死亡的现象,严重制约了林木产业的发展[17].已有研究证明,Psuedomonasfluorcells、Bacillussubtilis、B.punilus、T.viride等均对金黄壳囊孢具有显著拮抗效果[18].其中,木霉属(Trichodermaspp.)真菌是常见的土壤习居菌,存在于植物残体及动物粪便上,现已鉴定的种类超过100种.木霉菌的种群中有一大类被称为拮抗木霉[19-20],至少对18属29种病原真菌表现拮抗活性[21-22].本研究中,菌株TRCC27001对12种常见病原真菌具有较强抑制效果,除杨树炭疽菌外,相对抑菌率均在1以上.结合ITS序列和Tef 1-α序列进行分析,并根据已报道的木霉属真菌的形态特征[13,23],确定该菌株为绿木霉(Trichodermavirens).
木霉菌可以产生多达几百种的挥发性和非挥发性抗菌次生代谢产物[6,24],从而抑制甚至杀死病原菌[25].目前已知的抗菌次生代谢产物包括木霉素、胶霉毒素、绿木霉素、抗菌肽以及以非核糖体肽合成酶合成的Peptaibols等[26].菌株在不同的营养环境中会产生不同的有效抗菌物质[27],且培养基中纤维素的含量会影响抑菌物质的产生.本研究表明,以纤维素含量丰富的麸皮培养基发酵培养的TRCC27001无菌发酵液,对金黄壳囊孢的抑菌活性最强,培养10 d后,病原菌丝生长致密,菌落边缘增厚.麸皮为小麦加工的副产品,极常见且易获取,培养基制作成本较低,适合大量发酵使用.另外,检测生防木霉及其菌剂对高温、干燥、紫外辐射的抗逆能力以及耐贮性,是其能否进行商业化应用的重要评判标准[28].研究发现,菌株TRCC27001无菌发酵液具有良好的稳定性,在pH 2~12、温度5~105 ℃的条件下均能保持较强的抑菌活性,且对紫外线辐射不敏感.
综上所述,菌株TRCC27001的抑菌能力强,抗逆性好,具有较大的开发应用潜力.目前,菌株TRCC27001的其他特性尚不清楚,且其无菌发酵液中有效抑菌物质的种类及其抑菌机制也不明确,有待进一步探索.

