盐胁迫对多花水仙部分生理特性和叶绿素荧光参数的影响
李全超, 刘 洋, 肖瑶宇, 李 琳, 胡邵彬, 陈晓静
(1.福建农林大学园艺学院;2.福建农林大学园艺植物遗传育种研究所,福建 福州 350002)
土壤盐渍化是一个世界性的问题,也是影响植物生长的重要因素[1].随着中国城市化的推进,农田面积不断减少,而我国盐碱地面积广,约占现有耕地的四分之一[2],如何利用盐碱地进行耕作,显得尤为重要.滨海地区距海近的地方土壤平均含盐量为0.160 9%,地下水平均盐浓度约为110 mmol·L-1,化学成分以NaCl为主[3].现有的观赏植物大部分为非耐盐生植物,如何培育抗盐性强的品种以扩大花卉的适种区域是育种工作者关注的主要问题之一.关于盐胁迫影响植物生理特性的研究已有很多报道,盐浓度越高、胁迫时间越长,则植物的反应越明显[4-5].盐胁迫下,衡量膜脂过氧化程度的丙二醛(malondialdehyde, MDA)含量的增加量体现了植物受伤害程度;维持胞内活性氧代谢平衡的过氧化物酶(peroxidase, POD)活性发生显著变化以适应盐胁迫环境.光系统Ⅱ(PSⅡ)是植物将光能转化为化学能的重要部位,在植物响应盐胁迫的过程中发挥重要作用,对盐胁迫的反应敏感.盐胁迫会影响植株PSⅡ对光能的吸收、转化和电子传递,导致光化学活性下降,进而影响植物的正常生长,因此可将其作为筛选耐盐性品种的一个主要指标[6-7].有关植物叶绿素荧光特性在经济作物上的研究较多,而在观赏植物上的研究相对较少.
中国水仙(Narcissustazettavar.chinensis)是石蒜科水仙属多年生草本植物,为中国的十大传统名花之一,具有较高的观赏价值[8].水仙品种单一,主栽品种退化严重,适种面积减少,是水仙花产业面临的严重问题.提高水仙的抗盐性对实现水仙在沿海滩涂的种植,扩大水仙种植区域,提升水仙花产业经济效益都具有重要意义.多花水仙大部分起源于海岛,机体对盐分具备一定的耐性,其抗盐性方面的研究目前尚未见到报道.因此,本试验测定多花水仙在不同盐浓度下的生理指标,探究其在盐胁迫下的生理响应机制,旨在为多花水仙耐盐品种的选育及种植区域的扩大提供依据.
1 材料与方法
1.1 材料
本试验选取的4种多花水仙由福建农林大学园艺植物遗传育种研究所提供.其中,‘云香’和‘黄花2号’水仙为2012年通过审定的新品种;白花Ⅰ号和白花Ⅱ号水仙为育种资源.
1.2 试验设计
试验在福建农林大学遗传育种研究所的温室进行.选取大小一致、无病虫害的2年生种球放在塑料盆中水培,30 d后选取长势一致的植株进行盐胁迫处理.试验共设计6个处理,NaCl浓度分别为0(CK)、50、100、150、200和250 mmol·L-1.将试验材料随机分组,每个处理测定5个种球,单球置高9 cm、直径5.5 cm的组培瓶中培养,加入不同浓度的NaCl培养液100 mL,每隔2 d换一次培养液,7 d后测定相应的指标,重复3次.
1.3 指标测定
1.3.1 叶绿素含量、MDA含量和POD活性的测定 按冯瑞云[9]的叶绿素热醇快速提取法提取叶绿素,按Arnon公式计算总叶绿素的含量;采用硫代巴比妥酸比色法[10]测定MDA含量;采用愈创木酚法[11]测定POD活性.
1.3.2 叶绿素荧光参数的测定 用IMAGING-PAM调制叶绿素荧光成像系统(德国WALZ公司)测定叶绿素荧光参数.取水仙萌芽后37 d由里到外数的第2片叶先暗适应30 min,然后使用ImagingWin软件运行Light Curve程序,测量均在背景光的的光照强度低于1 μmol·m-2·s-1的环境下进行,作用光强度、测量光和饱和脉冲光均由机器程序默认.样品的初始荧光产量(minimal chlorophyll fluorescence, Fo)、最大荧光产量(maximal chlorophyll fluorescence, Fm)、光下最小荧光产量(minimal chlorophyll fluorescence measured in the light-adapted state, Fo′)、光下最大荧光产量(maximal chlorophyll fluorescence measured in the light-adapted state, Fm′)、非光化学淬灭系数(non-photochemical quenching, NPQ)、光化学猝灭系数(photochemical quenching, qP)均由仪器计算自动给出.其中,Fv/Fo=(Fm-Fo)/Fo,Fv/Fm=(Fm-Fo)/Fm,Fv′/Fm′=(Fm′-Fo′)/Fm′.
1.4 数据处理
用Excel 2007软件进行数据处理及制图,采用SPSS 13.0统计学软件进行单因素方差法(One-way ANOVA)数据分析(P<0.05).
2 结果与分析
2.1 盐胁迫对多花水仙叶片叶绿素含量、MDA含量和POD活性的影响
由图1可知,4种多花水仙叶片中的叶绿素含量随着盐浓度的增大呈下降的趋势,‘云香’和‘黄花2号’的叶绿素含量明显高于白花Ⅰ号和白花Ⅱ号.随着盐浓度的增大,‘云香’的叶绿素含量呈先下降后上升再下降的趋势,整体变幅较小,各处理间基本没有达到显著差异,NaCl浓度为250 mmol·L-1时的叶绿素含量相比CK下降了9.8%;‘黄花2号’各个处理的叶绿素含量均高于其他3个品种,当NaCl浓度增大到100 mmol·L-1后各个处理之间均达到了显著差异,NaCl浓度为250 mmol·L-1时的叶绿素含量相较于CK下降了18.9%;白花Ⅰ号和白花Ⅱ号各个处理的叶绿素含量和变化幅度比较一致,当NaCl浓度为100 mmol·L-1时,两个品种的叶绿素含量大幅度下降,NaCl浓度为250 mmol·L-1时,白花Ⅰ号和白花Ⅱ号的叶绿素含量与CK相比较,分别下降了32.3%和38.1%.可见,盐胁迫下,‘云香’和‘黄花2号’的叶绿素含量仍能维持较高水平.
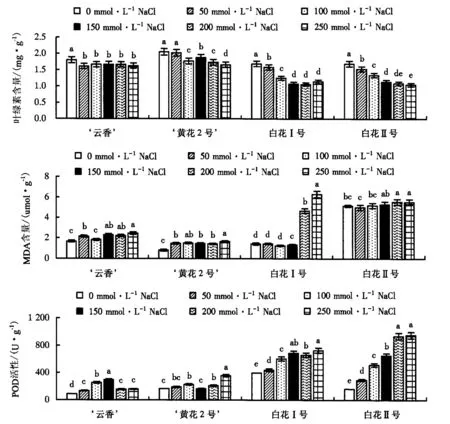
图柱上附不同字母者表示不同NaCl浓度下差异显著(P<0.05),附相同字母者表示不同NaCl浓度下差异不显著(P>0.05).图1 盐胁迫对多花水仙叶片叶绿素含量、MDA含量和POD活性的影响Fig.1 Impact of salt stress on the chlorophyll content, MDA content and POD activity of narcissus leaf
MDA含量的升高能够衡量盐胁迫对细胞膜的损伤程度.由图1可知,随着盐浓度的增大,4种水仙叶片中的MDA含量呈逐渐上升的趋势.‘云香’MDA含量的变化趋势与‘黄花2号’ 较为一致,各胁迫处理与CK相比都达到了显著差异,NaCl浓度为250 mmol·L-1时,云香’和‘黄花2号’的MDA含量分别是CK的1.48和2.05倍.白花Ⅰ号的MDA含量随着盐浓度的增大缓慢上升,当NaCl浓度为200 mmol·L-1时,MDA含量显著上升,是CK的3.29倍;当NaCl浓度达250 mmol·L-1时,MDA含量继续升高,是CK的4.45倍.白花Ⅱ号的MDA含量明显高于其他3个品种,但6个处理间的差异不显著.可见,相对于白花Ⅰ号和白花Ⅱ号,盐胁迫对‘云香’和‘黄花2号’细胞膜的损伤最小.
由图1可知,盐胁迫对4种水仙叶片中的POD活性均有明显的改善作用.随着盐浓度的增大,‘云香’的POD活性呈先上升后下降的趋势,在NaCl浓度为150 mmol·L-1时达到最大,是CK的3.31倍,随着盐浓度的继续增大而降低,但仍高于CK.随着盐浓度的增大,‘黄花2号’的POD活性呈先上升后下降再上升的趋势,在NaCl浓度为250 mmol·L-1时达到最大,是CK的2.15倍.在正常情况下,白花Ⅰ号的POD活性明显高于其他3个品种,其变化趋势与白花Ⅱ号一致,均随着盐浓度的增大而升高,且明显高于‘云香’和‘黄花2号’,当NaCl浓度达250 mmol·L-1时,白花Ⅰ号和白花Ⅱ号的POD活性分别是CK的1.84和5.90倍.可见,白花Ⅰ号和白花Ⅱ号可通过提高POD活性来清除细胞内的活性氧物质,维持活性氧代谢的平衡,保证植物体的正常生长.
2.2 盐胁迫对多花水仙叶片叶绿素荧光参数的影响
Fo是叶片经过充分暗反应后,当光合膜处于非能量化状态时,所有PSⅡ反应中心处于开放时的荧光强度.由图2可知,随着盐浓度的增大,4种水仙叶片中的Fo也随之上升,且白花Ⅰ号和白花Ⅱ号的Fo高于‘黄花2号’和‘云香’.‘云香’的Fo上升缓慢,‘黄花2号’和白花Ⅰ号的Fo在NaCl浓度达100 mmol·L-1时与CK的差异显著,而白花Ⅱ号的Fo随着盐浓度的增大持续上升.PSⅡ反应中心受到破坏可以导致Fo上升,且类囊体膜受损程度与其增大量呈正比,表明‘云香’受盐胁迫的影响最小.

图柱上附不同字母者表示不同NaCl浓度下差异显著(P<0.05),附相同字母者表示不同NaCl浓度下差异不显著(P>0.05).图2 盐胁迫对多花水仙叶片 Fo、Fm、Fv/Fo 和 Fv/Fm的影响Fig.2 Impact of salt stress on Fo, Fm, Fv/Fo and Fv/Fm of narcissus leaf
Fm是PSⅡ反应中心处于完全关闭时的荧光强度.由图2可知,‘云香’和‘黄花2号’的Fm低于白花Ⅰ号和白花Ⅱ号,随着盐浓度的增大,4种水仙的变化趋势较为一致,Fm都逐渐下降.NaCl浓度分别为50和100 mmol·L-1时,‘云香’的Fm与‘黄花2 号’的差异显著,其他浓度的Fm虽有所下降但差异不显著;NaCl浓度为50 mmol·L-1时,白花Ⅰ号的Fm与白花Ⅱ号的差异显著,但随着盐浓度的增大下降幅度较小.可见,低盐浓度对Fm有较大的影响,但随着盐浓度的增大,对‘云香’和‘黄花2 号’的影响不显著.
Fv/Fo是PSⅡ的潜在光化学效率.由图2可知,4种水仙叶片的Fv/Fo随着盐浓度的增大均有明显的下降趋势,‘云香’ 各个处理的Fv/Fo明显高于其他3个品种.NaCl浓度达100 mmol·L-1后,‘云香’的Fv/Fo继续下降但趋势平缓;NaCl浓度达150 mmol·L-1后,‘黄花2号’和白花Ⅰ号Fv/Fo的下降幅度开始变小;NaCl达到200 mmol·L-1后,白花Ⅱ号Fv/Fo的下降幅度逐渐变大.
Fv/Fm反映PSⅡ反应中心内禀光能转换效率.由图2可知,盐胁迫下,4种水仙叶片Fv/Fm的变化趋势与Fv/Fo较为一致,即随着盐浓度的增大呈下降的趋势,在低盐浓度下均显著下降.NaCl浓度为250 mmol·L-1时,‘云香’、‘黄花2号’、白花Ⅰ号和白花Ⅱ号的Fv/Fm分别下降至0.79、0.77、0.78和0.77.表明盐胁迫使4种水仙均发生了光抑制.
Fv′/Fm′是 PSⅡ有效光化学量子产量.由图3可知:4种水仙叶片的Fv′/Fm′随着盐浓度的增大呈下降的趋势,‘云香’和白花Ⅱ号的下降幅度较小,NaCl浓度达250 mmol·L-1时的Fv′/Fm′比CK分别下降了4.7%和4.1%;NaCl浓度为150 mmol·L-1时,‘云香’的Fv′/Fm′与CK的差异显著.‘黄花2号’和白花Ⅰ号的Fv′/Fm′随着盐浓度的增大呈逐渐下降的趋势,相较于‘云香’和白花Ⅱ号,其下降幅度较大;NaCl浓度达250 mmol·L-1时,‘黄花2号’和白花Ⅰ号的Fv′/Fm′分别比CK下降了7.3%和14.9%.可见,盐胁迫对白花Ⅰ号PSⅡ反应中心原初光能捕获能力的影响更大.
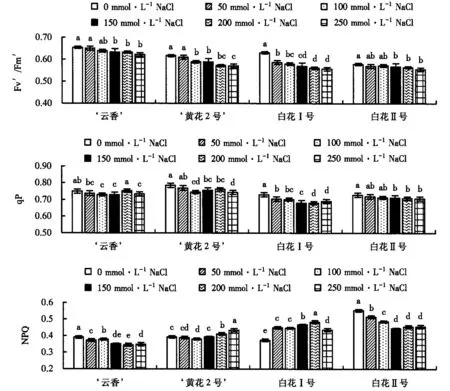
图柱上附不同字母者表示不同NaCl浓度下差异显著(P<0.05),附相同字母者表示不同NaCl浓度下差异不显著(P>0.05).图3 盐胁迫对多花水仙叶片 Fv′/Fm′、qP和NPQ 的影响Fig.3 Impact of salt stress on Fv′/Fm′, qP and NPQ of narcissus leaf
qP表示PSⅡ反应中心的开放程度,其大小与PSⅡ的电子传递活性呈正比.由图3可知,随着盐浓度的增大,4种水仙叶片的qP均呈下降趋势,‘云香’和‘黄花2号’的下降幅度较小,白花Ⅰ号和白花Ⅱ号均呈不断下降的趋势.NaCl浓度达250 mmol·L-1时,‘云香’、‘黄花2号’、白花Ⅰ号和白花Ⅱ号的qP较CK下降了2.1%、5.2%、5.4%和2.2%.可见.盐胁迫对PSⅡ反应中心电子流动的抑制较小.
NPQ反映光系统对过剩光能的耗散能力.由图3可知,白花Ⅰ号和白花Ⅱ号的NPQ高于‘云香’和‘黄花2号’,‘云香’、‘黄花2号’ 的变化趋势与白花Ⅱ号一致,均随着盐浓度的增大呈先下降后上升的趋势.‘云香’的NPQ在NaCl浓度为200 mmol·L-1时下降到最低,在250 mmol·L-1时开始上升;‘黄花2号’ 的NPQ则在NaCl浓度为100 mmol·L-1时下降到最低,在150 mmol·L-1时开始上升;白花Ⅱ号的NPQ在NaCl浓度为150 mmol·L-1时下降到最低,在200 mmol·L-1时开始上升;而白花Ⅰ号的NPQ则呈先上升的趋势,在NaCl浓度达250 mmol·L-1时开始下降.NPQ的升高,表明4种水仙及时通过耗散掉多余的光能来进行自我保护.根据不同盐浓度胁迫的NPQ变化,表明白花Ⅰ号自我保护能力较弱,‘云香’较强.
3 讨论
3.1 盐胁迫对多花水仙叶片叶绿素含量、MDA含量和POD活性的影响
盐胁迫会诱发植物体多种生理代谢发生变化以适应新的环境.研究表明,盐胁迫会导致植物叶片中的叶绿素含量降低,主要是因为植物受到盐胁迫后,叶绿素会加速分解而合成受阻[12-13].杨淑萍等[14]研究表明,低盐浓度可促进海岛棉叶绿素含量的积累,高盐浓度则加快叶绿素的分解.而本试验结果显示,随着盐浓度的增大,‘云香’和‘黄花2号’的叶绿素含量呈先下降后上升再下降的趋势,可能是低浓度盐胁迫没有激活这2个品种的盐抵抗机制,随着盐浓度的增大则通过增大叶绿素的合成来抵抗盐胁迫.当盐浓度较高时,叶绿素含量降低,这是因为盐胁迫使叶绿素的合成受到抑制;同时,NaCl可以提高叶绿素酶的活性[12],加快叶绿素的分解,导致叶绿素含量下降.此结果与朱金方等对中国柽柳的研究结果[15]一致.而白花Ⅰ号和白花Ⅱ号的叶绿素含量随着盐浓度的增大不断下降,可能是盐胁迫直接影响叶绿素的合成和分解.
MDA是膜脂过氧化最重要的产物之一,可通过测定MDA的含量来间接判断膜系统的受损程度以及植物的抗逆性[16].研究表明,耐盐植物叶片的MDA含量随着盐浓度的增大也随之升高,破坏细胞膜的结构与功能,导致代谢紊乱,且耐盐性越强的品种的MDA含量上升幅度就越小[17].本试验中,白花Ⅰ号随着盐浓度的增大,叶片中积累了较多的MDA,表明细胞内的活性氧自由基对细胞膜正常的功能造成较为严重的损伤;而‘云香’和‘黄花2号’在盐胁迫下,细胞内能够保持较低的MDA含量,表明其更耐盐胁迫.
属于抗氧化酶类的POD活性升高,可以在逆境条件下清除过多的活性氧物质,以保证植物正常生长,这在大果白刺[18]、小麦[19]、高粱[20]、棉花[21]和新麦草[22]上得到了验证.本试验中,4种水仙叶片的POD活性对盐胁迫的反应有所不同,‘黄花2号’、白花Ⅰ号和白花Ⅱ号的POD活性随着盐浓度的增大而升高,保持植物体内活性氧代谢平衡,以维持植物的正常生长;而‘云香’的POD活性则随着盐浓度的增大呈先上升后下降的趋势.钟云鹏等[23]研究表明,盐胁迫下,石蒜属植物的POD活性随着盐浓度的增大呈先上升后下降的趋势,这可能是随着细胞活性氧物质含量的增大激活了其他抗氧化酶类,整个抗氧化酶系统相互协调作用从而使POD活性下降.林双冀等[24]研究表明,盐胁迫下,耐盐性较好的品种的POD活性呈下降趋势,而耐盐性较差的品种则相反.根据上述前人的研究结果,推测POD活性可以作为评判水仙品种资源耐盐性的参考.关于盐胁迫下不同水仙品种资源与其他抗氧化酶的关系还有待进一步研究.
3.2 盐胁迫对多花水仙叶片叶绿素荧光参数的影响
叶绿素荧光动力学过程研究是目前最为先进的测定植物光合作用能量吸收、传递、耗散、分配的重要研究方法,现已被广泛用于植物逆境胁迫的研究中[25-26].当植物的生长环境发生变化时,叶绿素荧光参数的变化可在一定程度上反应环境因子对植物的影响[27-28].前人[29-30]研究表明,盐胁迫导致植物叶片Fo上升,Fm、Fv/Fm、Fv/Fo、Fv′/Fm′和qP下降,而NPQ则随着植物的不同变化不一样,与本试验结果较为一致.本试验中,随着盐浓度的增大,4种水仙叶片的Fo上升,Fm、Fv/Fo和Fv/Fm下降,表明PSⅡ反应中心受到了破坏,发生了光抑制.植物在正常条件下,Fv/Fm一般为0.80~0.85,本试验4种水仙叶片的Fv/Fm随着盐浓度的增大虽有所下降但都维持在0.75以上,表明短期盐胁迫会对PSⅡ产生一定的影响但未造成不可逆的破坏.盐胁迫下,4种水仙叶片的Fv′/Fm′和qP都显著下降,表明PSⅡ反应中心原初光捕捉效率下降,降低了PSⅡ的电子传递活性和实际光合效率;NPQ的变化趋势与Fv′/Fm′、qP并不一致,‘云香’、‘黄花2号’和白花Ⅱ号的NPQ随着盐浓度的增大呈先下降后上升的趋势,表明随着盐浓度的增大,这3种水仙启动了热能量耗散机制,通过非光化学猝灭以热形式耗散掉激发能来适应盐胁迫环境,而白花Ⅰ号随着盐浓度的增大则呈先上升后下降的趋势,可能是盐浓度的增大对其造成了一定的损伤,热耗散保护机制开始减弱,此结果在杜鹃花[31]和银杏[32]上有类似的报道.根据NPQ的变化趋势,推测4种水仙在盐胁迫下启动了热耗散保护机制,‘云香’、‘黄花2号’和白花Ⅱ号对盐胁迫的响应更好,白花Ⅰ号最弱.
本试验结果显示,盐胁迫导致4种水仙叶片的叶绿素含量、MDA含量和POD活性及叶绿素荧光参数发生了变化,表明盐胁迫对4种水仙的生长产生了较为严重的影响,但对PSⅡ未造成不可逆的破坏,这可能与多花水仙起源于海岛,有一定的耐盐性有关.根据盐胁迫对4种水仙叶绿素含量、MDA含量、POD活性及叶绿素荧光参数的影响,综合推断耐盐性程度的大小为:‘云香’>‘黄花2号’>白花Ⅱ号>白花Ⅰ号.因此,可以用较耐盐的‘云香’作为进一步扩大适种区域的试验品种.本试验选用的‘云香’和‘黄花2号’为三倍体,白花Ⅰ号和白花Ⅱ号为二倍体,染色体倍性与抗盐性是否直接相关,有待后续研究.

