蓝莓采后病害病原菌分离鉴定及其拮抗菌筛选
杨 蕾, 伍建榕, 邓 佳, 陆燕元, 王 芳
(1.西南林业大学国家林业局西南地区生物多样性保育重点实验室;2.云南省高校森林灾害预警控制重点实验室;3.西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224)
蓝莓为杜鹃花科(Ericaceae)越橘属(Vacciniumspp.),是多年生落叶或常绿小浆果果树.蓝莓果实风味独特,营养丰富,抗氧化活性高,被联合国粮农组织列为人类五大健康食品之一[1].蓝莓为呼吸跃变型果实,在我国西南地区成熟于6—8月.此时高温多雨,且采摘期集中,采后易失水,果肉软化,造成病原菌感染而腐烂变质[2-4],这制约了新鲜蓝莓的流通和大规模生产,限制了产业发展.因此,寻找有效预防采后病害的方法已成为当前蓝莓产业发展亟待解决的问题.
利用微生物生防菌控制果蔬采后病害,能够减少有害化学药剂的使用,是值得深入研究的防治果蔬采后病害的方法之一[5].Mari et al[6]提出拮抗微生物可以促进蓝莓果实自身产生拮抗物质并发生防御反应,能有效防止蓝莓采后病害的发生.芽孢杆菌是革兰氏阳性杆菌,具有繁殖能力强、耐热、耐酸碱、理化性质稳定的特点;其抑菌谱广泛,大规模生产工艺简单,成本较低,是目前主要的生防细菌菌株[7].许多种芽孢杆菌已被证实对果蔬病原菌具有很好的拮抗作用,将芽孢杆菌类群作为生防菌株,在果蔬生产中已被广泛应用.例如:BacillussubtilisDJM-51对番茄溃疡病有抑菌作用[8];BacillusamyloliquefaciensBGP20能有效控制蔬菜采后细菌性软腐病[9];解淀粉芽孢杆菌Bs-18对黄瓜白粉病有良好的防治效果,盆栽防治效率可达到82.22%[10].但是,有关拮抗芽孢杆菌用于蓝莓采后保鲜的报道较少,仅 Kurniawan et al[11]研究了芽孢杆菌和假单胞菌属真菌对蓝莓果实灰霉病和链格孢霉的控制作用.本研究在对蓝莓果实采后贮藏过程中引起腐烂病的病原菌进行分离鉴定的基础上,从健康蓝莓果实、叶片及根际土壤中分离、筛选拮抗芽孢杆菌,测定其对蓝莓采后病害的生防效果,为蓝莓采后病害的生物防治及新型生物农药的开发提供依据.
1 材料与方法
1.1 样本采集
于云南省昆明市盘龙区西南林业大学大棚种植基地内,分别采集18份蓝莓健康果实及9份叶片和根际土壤.其中,9份蓝莓果实置于室温下待其自然发病,用于病原真菌的分离;另外9份蓝莓果实和叶片、根际土壤分装于无菌封口袋内,做好标记并存放于4 ℃冰箱中,用于拮抗菌株的分离.
1.2 病原菌的分离与鉴定
采用组织分离法分离病原菌.在无菌环境下切取发病部位组织,用75%酒精表面消毒5 s后,用无菌水冲洗3次,置于马铃薯葡萄糖琼脂糖(potato dextrose agar,PDA)培养基中央.每份标本设置5个重复,25 ℃培养3~5 d,记录菌株生长情况.当菌落直径生长至约1 cm时,进行纯化保存备用.通过显微形态观察[12]鉴定病原真菌.
1.3 病原菌致病性检测
采用有伤接种法,将分离所得病原菌回接至健康蓝莓果实.选取健康蓝莓果实,在无菌环境下先用无菌水将其表面灰尘冲洗干净,再用75%酒精表面消毒5 s,后用无菌水冲洗3次,晾干.用灭菌竹签将蓝莓果实表面刺3个微孔(孔眼分散),调配病原菌菌液浓度至104、105、106、107CFU·mL-1[13],分别将菌液接种至伤口处,置于室温条件下,定期观察果实发病情况.
1.4 拮抗芽孢杆菌的分离与鉴定
1.4.1 根际土壤样品菌株的分离 采取土壤稀释分离法对根际土壤样品的菌株进行分离.称取10 g土样,放入装有90 mL无菌水并带有玻璃珠的三角瓶中,置于200 r·min-1的摇床上振荡30 min,制成初始土壤悬浮液.在无菌操作台内使用无菌水稀释至10-4、10-5、10-6和10-74个梯度,取200 μL各浓度菌液分别涂布于营养琼脂(nutrient agar,NA)培养基.每个浓度做3个重复,37 ℃培养2~3 d,记录菌株生长情况,挑取形态差异明显的单个菌落纯化后保存备用.
1.4.2 果实及叶片样品菌株的分离 将蓝莓果实和叶片样品分装于盛有30 mL的0.05 mol·L-1磷酸缓冲液离心管中,将其放在100 r·min-1摇床上振荡20 min.然后在无菌操作台内将缓冲液依次稀释至10-1和10-2,吸取各浓度菌液200 μL到NA培养基上.每个浓度做3个重复,37 ℃培养2~3 d,记录菌株生长情况,挑取形态差异明显的单个菌落纯化后保存备用.
1.4.3 供试菌株的初步鉴定 将上述分离纯化得到的供试菌株进行DNA提取,然后选用引物P1和P6[14]进行16S rRNA基因序列扩增.扩增后的PCR产物送北京擎科新业生物技术有限公司测序,测得的序列通过DNAMAN软件进行拼接,将拼接好的序列利用MEGA 6.0软件进行聚类分析,进而初步鉴定出所分离的菌株.
1.5 抑制病原真菌活性试验
选取从蓝莓果腐病上分离得到的病原真菌,接种到PDA培养基上,培养5 d后,在菌落边缘用打孔器打取6 mm菌饼,放至新的PDA培养基中间,同时取6 mm无菌滤纸片放在距其3 cm的4个位置,加入5 μL拮抗细菌菌悬液(菌悬液的浓度为107CFU·mL-1).以无菌水作为对照,3个重复,培养5 d后观察抑菌效果,计算抑菌率.采用 SPSS 17.0软件对数据进行分析处理,并用单因素方差分析的LSD法进行差异显著性分析.
2 结果与分析
2.1 蓝莓采后病原菌的分离与鉴定
通过对蓝莓果实采后表面病原菌的分离和纯化得到8株真菌.经显微形态观察明确了其中2株致病菌,分别为青霉菌(Penicilliumdigitatum)(图1A、1B)和枝孢菌(Cladosporiumtenuiussimum)(图1C、1D).
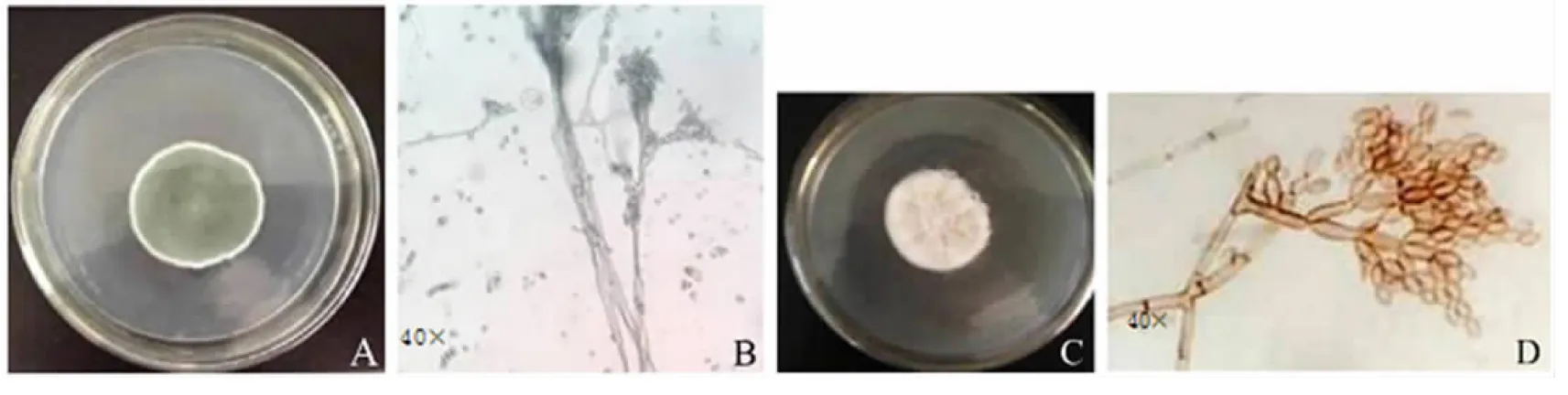
A、B分别为P.digitatum菌落形态和显微结构特征;C、D分别为C.tenuiussimum菌落形态和显微结构特征.图1 蓝莓采后病原真菌菌落形态和显微结构特征Fig.1 Colony morphology and microstructure characteristics of pathogenic fungi isolated from rotten blueberry in post-harvest
P.digitatum形态特征:指状青霉属半知菌类,分生孢子梗较粗短,(60~130) μm×(5~7) μm,帚状分枝顶端往往二轮生,瓶梗3~5个,分生孢子串生、椭圆形、无色,(6~8) μm×(2.5~5.0) μm.
C.tenuiussimum形态特征:正极细枝孢半知菌类,分生孢子梗暗色,在顶部或中部分枝,分生孢子暗色,1~2个细胞,形状和大小不一.
2.2 蓝莓采后病原菌致病性检测结果
将分离到的真菌回接至健康蓝莓果实,在室温条件下,第5天时接种青霉菌的蓝莓果实表面出现绿色霉层,整个果实腐烂变质;接种枝孢菌的蓝莓果实表面出现白色霉层,整个果实也已经变质;而对照组未见明显症状(图2).

A、C为对照组;B为接种P.digitatum的发病果实;D为接种C.tenuiussimum的发病果实.图2 蓝莓采后病原真菌回接发病症状Fig.2 Infective symptoms of blueberry inoculated with P.digitatum and C.tenuiussimum
2.3 拮抗菌的分离与鉴定
从健康蓝莓的果实、叶片和根部土壤中,共分离获得17株菌.其中,叶片中分离出2株,果实中分离出7株,根际土壤中分离出8株.对这些菌株进行16S rRNA序列扩增,结果见图3.
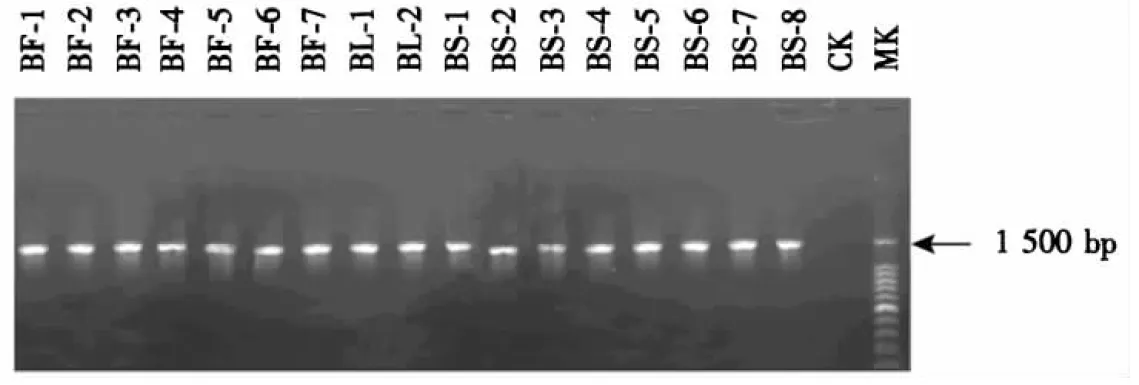
BF.蓝莓果实;BL.蓝莓叶片;BS.蓝莓根际土壤;CK.对照水;MK.100 bp DNA marker.图3 17株分离菌的16S rRNA基因扩增电泳图Fig.3 Electrophoresis of 16S rRNA gene from 17 isolated strains
利用MAGE 6.0软件,采用邻接法对测定的序列进行比对并构建系统发育树(图4).结果表明,菌株BS-8和BF-4与Brevibacillus的菌株聚在一起,属于Brevibacillus.其中,菌株BS-8与B.brevisNBRC 15304(T)和B.panacihumiDCY35(T)的序列相似性分别为98.73%和96.77%;菌株BF-4与B.borstelensisNRRL NRS-818(T)的序列相似性为99.93%.菌株BF-1属于Paenibacillus,其与P.dendritiformisCIP 105967(T)、P.popilliaeATCC14706(T)、P.thiaminolyticusNBRC 15656(T)的序列相似性分别为99.44%、98.10%、98.38%.菌株BS-4属于Staphylococcus,其与S.epidermidisATCC 14990(T)、S.capraeATCC 35538(T)、S.capitisATCC 27840(T)的序列相似性分别为98.88%、98.33%、98.47%.菌株BS-3、BF-5和BS-1属于Bacillus.其中,BS-3与B.paralicheniformisKJ-16(T)的序列相似性为99.44%;BF-5与B.velezensisCR-502(T)的序列相似性为96.48%;BS-1与B.subtilissubsp.inaquosorumKCTC 13429(T)和B.velezensisCR-502(T)的序列相似性分别为99.02%和99.13%.BF-3属于Rhodococcus,其与R.enclensisNIO-1009(T)和R.trifoliiT8(T)的序列相似性分别为99.34%和98.83%.BF-2属于Kocuria,其与K.indicaNIO-1021(T)、K.salsicia104(T)、K.marinaKMM 3905(T)的序列相似性分别为98.57%、97.80%、99.16%.BL-1、BL-2属于Bacillus.BS-2、BS-7、BS-6、BF-7属于Pseudomonas.BF-6属于Flavobacterium,与F.acidificumLMG 8364(T)的序列相似性为99.57%.BS-5属于Enterobacter,其与E.tabaciYIM Hb-3(T)和E.muelleriJM-458(T)的序列相似性分别为99.02%和99.01%.
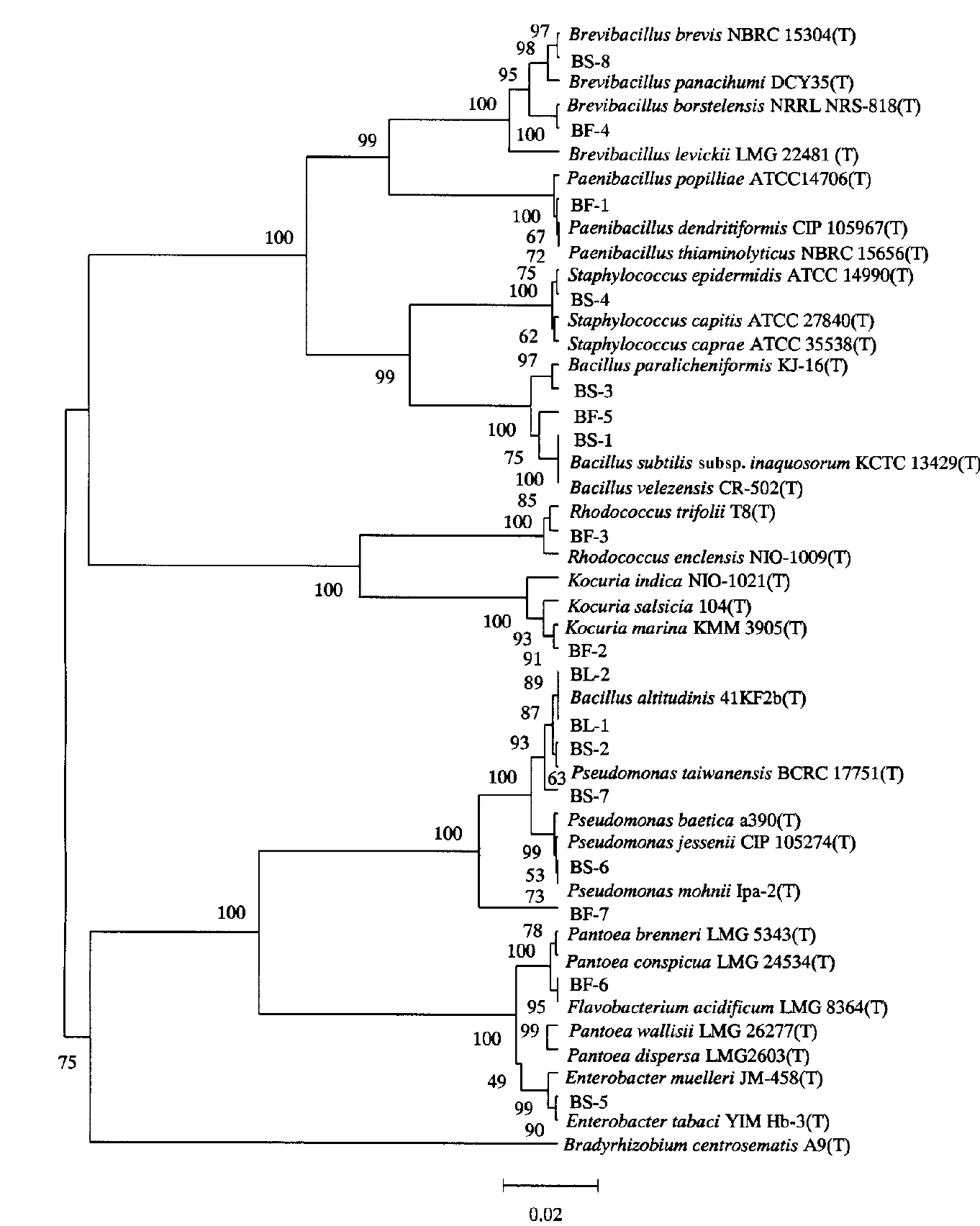
图4 基于16S rRNA基因构建的系统发育树Fig.4 Phylogenetic tree based on 16S rRNA genes
2.4 拮抗菌的筛选
抑菌活性试验结果表明,从健康蓝莓果实、叶片及根际土壤中分离出的细菌对蓝莓采后的2种病原真菌有不同程度的抑制效果.其中,5株菌(BS-1、BS-3、BS-8、BF-4、BF-5)对P.digitatum有显著的抑制效果,抑菌率分别为87.6%、90.6%、78.6%、68.7%、67.6%(表1).由图4可知,其中3株为芽孢杆菌(Bacillus),2株为短芽孢杆菌(Brevibacillus).3株菌(BS-3、BS-8、BF-4)对C.tenuiussimum有显著的抑制效果,抑菌率分别为90.7%、92.6%、91.5%(表1).其中,菌株BS-3对P.digitatum和C.tenuiussimum的抑制率都在90%以上.

表1 健康蓝莓果实、叶片及根际土壤分离菌株对2种蓝莓病原菌的抑制结果1)Table 1 Control efficacy of strains isolated from healthy blueberry fruit, leaf and rhizosphere soil on P.digitatum and C.tenuiussimum
1)同列数据后附不同大、小写字母者分别表示在0.01、0.05水平上差异显著,附相同大、小写字母者分别表示在0.01、0.05水平上差异不显著.
3 讨论
本研究分离得到的引起蓝莓果实采后病害的青霉菌和枝孢菌,与周笑犁等[3]报道的贵州蓝莓采后病原真菌基本一致,说明青霉菌和枝孢菌是引起我国西南地区蓝莓采后病害的常见病原真菌.本研究还获得了对青霉菌和枝孢菌有显著抑制活性的多个芽孢杆菌菌株,其中BS-3菌株对青霉菌和枝孢菌的抑制率都达到了90%以上.BS-3菌株的16S rRNA序列与BacillusparalicheniformisKJ-16的同源性达99.44%,可以认为是同种的不同株系.Wang et al[15]曾报道BacillusparalicheniformisMDJK30对牡丹根腐病菌有拮抗作用.本研究证明菌株BS-3在实验室条件下对蓝莓采后的2种病原菌具有较好的抑制效果,今后将进一步对其拮抗机理以及生产应用的安全性和持久性等进行深入研究.

