低磷胁迫下不同杉木家系根系觅磷能力分析
吴文景, 汪 攀, 陈奶莲, 马祥庆, 林文奖, 吴鹏飞
(1.福建农林大学林学院,福建 福州 350002;2.国家林业局杉木工程技术研究中心,福建 福州 350002;3.福建农林大学海峡联合研究院,福建 福州 350002;4.福建省漳平五一国有林场,福建 龙岩 364000)
磷是植物生长发育过程中必需的元素,以多种途径参与体内各种代谢过程,对植物生长发育具有重要作用[1].由于磷素在土壤中的移动性较差,扩散距离仅1~2 mm,加之南方酸性红壤的强烈化学固定作用,植物可直接吸收利用的有效磷匮乏,严重影响了农林植物的优质高产生产[2-3].传统生产过程主要通过施加磷肥以改良土壤营养,但这将加速有限磷矿资源的耗竭,同时还引发了环境污染问题[4].研究[5]表明,植物在长期适应过程中可最大限度获取土壤中有限的磷资源,通过调整根系形态结构或改变生物量分配格局等途径来增强养分吸收和利用效率,提高其在低磷逆境中完成生命周期的机会.而且,不同植物或者同一植物的不同品系对土壤有效磷的吸收和利用的效率均存在明显差异[6-7].可见,若能充分挖掘植物自身遗传潜力,筛选出对土壤有限磷资源觅养能力较强的基因型,即可保证传统方法所需的磷素矿质能源的供应,有效减少磷肥施用量,为实现农林植物高效生产提供科学途径[8].
杉木(Cunninghamialanceolata)是我国南方重要的速生造林树种[9].随着杉木多代连栽及造林面积的不断扩大,土壤有效磷匮乏已成为杉木人工林可持续经营的主要限制因子之一[10].由于杉木广泛分布于我国17个省区,其分布区生境差异大且生态遗传隔绝,在长期的系统发育过程中已形成了不同的营养遗传性状,以适应不同供磷水平的土壤环境,便于筛选杉木耐低磷胁迫的优良种质材料[11-12].研究[13-15]表明,不同杉木无性系磷素利用效率存在明显差异,且在低磷胁迫条件下有些杉木无性系可通过提高磷素吸收和利用的效率以抵抗低磷环境.邹显花等[16]研究发现低磷环境杉木通过根系伸长、表面积和体积增大或侧根增加等形态指标的变化做出响应,也可通过根系分泌有机酸[17-18]或内源激素[19]等生理指标变化途径来提高磷素利用效率.可见,杉木对低磷环境的适应能力与根系活力指标密切相关[20],通过根系增生觅磷的能力探讨不同杉木地理生态类型对低磷胁迫响应机制的差异性,对研究可高效利用土壤有限磷资源的杉木种质材料具有重要意义.
由于植物对低磷胁迫的响应是多个器官综合反应的体现,仅对单一指标评价容易产生误差[21-22].因此,如何基于根系增生觅磷能力从多个相关指标综合评价不同杉木类型对低磷胁迫的适应能力显得尤为重要.鉴于此,本文选择福建省漳平五一国有林场9个半同胞家系杉木种子培育的幼苗为研究对象,通过室内沙培模拟试验,以正常供磷处理为对照,分别设置轻度和重度磷胁迫处理,比较不同供磷处理条件下杉木根系形态指标的变化,结合苗高、地径和根冠比等生长指标,利用隶属函数法对不同家系杉木根系觅磷能力的差异性进行探讨,旨在筛选出对南方林区红壤有限磷素资源利用能力较高的杉木优良种质资源,为推动杉木高效培育进程提供理论依据.
1 材料与方法
1.1 供试材料
选取福建省漳平五一国有林场1.5代杉木种子园结实情况较好的9个半同胞家系种子培育的6个月生且长势均一的健壮幼苗[23],分别为15号、20号、23号、25号、28号、36号、38号、40号和41号,平均苗高和地径分别为(12.5±1.2)cm和(0.21±0.02 cm)(表1).该种子园(117°29′E, 25°02′N)海拔400~500 m,山地红壤,属亚热带海洋性季风气候,年均温度20.3 ℃,年降水量1 508.8 mm,年蒸发量1 170 mm,相对湿度80%,年无霜期300 d,年日照数1 889 h以上.
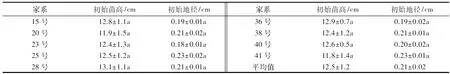
表1 不同家系杉木幼苗试验前的初始苗高与地径1)Table 1 Height and root collar diameter of Chinese fir seedlings from different families before P stress
1)小写字母表示不同家系杉木间差异未达显著水平(P<0.05).
1.2 试验设计
在福建农林大学林学院温室大棚进行沙培盆栽模拟试验,根据参试苗木地上部及根系大小,选用盆口直径18 cm、盆底直径9 cm、高32 cm的聚乙烯花盆为培育容器,每个容器栽植1株杉木.培养基质为洗净河沙[全磷含量(0.110±0.004)mg·kg-1,有效磷为痕量],每盆装河沙干质3.5 kg.根据南方红壤有效磷平均含量[3]设置3个供磷浓度:正常供磷(1.0 mmol·L-1KH2PO4)、轻度磷胁迫(0.5 mmol·L-1KH2PO4)和重度磷胁迫(0 mmol·L-1KH2PO4),每个处理5个重复.为满足试验期间苗木对其它养分的需求,根据改良的1/3 Hoagland营养液配方[3]进行补充,低磷胁迫处理中不足的钾素用等量KCl代替.利用NaOH和稀HCl溶液调节营养液pH,pH达到5.8.每7 d浇1次配置的营养液,每盆每次浇30 mL,每天17:00浇纯水100 mL.温室大棚室温18~28 ℃,光照10 h·d-1,相对湿度>80%.试验盆栽3个月后,于2014年6月30日进行苗木收获.
1.3 试验方法
分别于盆栽前和收获后,将每一株参试杉木幼苗根系用纯水洗净,利用根系扫描系统(WinRHizo,version 4.0B)进行根系长度、表面积和体积等形态指标的扫描与定量分析;同时测定其苗高和地径.
由于盆栽前杉木苗木根系与地上部无法分别测定,本文随机选择20株参试苗木分别将其根系与地上部分离,置105 ℃烘箱内杀青30 min后,调至80 ℃烘干至恒重(精确到0.001 g),测定参试苗木盆栽前的干物质质量.对收获后的每一株参试苗木分别测定根系和地上部干物质质量.
1.4 数据统计与分析
为分析不同供磷处理对参试苗木的苗高、地径、根系形态指标及生物分配量影响的差异性,采用不同测定指标的增量(E)进行统计,即盆栽前和收获后的测定指标分别记为E0和E1,E=E1-E0.
采用隶属函数法[24]结合权重对不同家系杉木根系觅磷能力进行排序.以正常供磷处理为对照,选取轻度与重度磷胁迫处理条件下参试杉木的苗高增量、地径增量、根系形态指标变化和根冠比作为评价指标,利用式(1)和式(2)分别计算各指标的隶属函数值;结合权重,利用式(3)~式(5)分别得到轻度与重度磷胁迫下不同家系杉木幼苗根系觅磷能力的综合评价值,取其平均值(T).T值越高,表明该家系根系觅磷能力越强.
若某一指标与觅磷能力呈正相关,则用式(1)计算隶属函数值;若某一指标与觅磷能力呈负相关(即不良指标),则用式(2)计算隶属函数值.
μXab=Xab-XbminXbmax-Xbmin
(1)
μXab=1-Xab-XbminXbmax-Xbmin
(2)
式中:μ(Xab)为a家系b指标的隶属函数值,Xab为a家系b指标V,Vb=∑na=1Xab-XbXb的值,Xbmax为各家系b指标值中的最大值,Xbmin为各家系b指标值中的最小值.
为确定不同指标的权重,采用标准差系数法,先计算标准差系数Vb,再求各指标的权重Wb.
Vb=∑na=1Xab-XbXb
(3)
wb=vb∑ma=1vb
(4)
式中:Xab为a家系b指标的值,Xb为b指标的平均值.
D=∑na=1uXb×Wb
(5)
式中:μXb为某一家系b指标的隶属函数值,Wb为b指标权重,D为综合评价值.
采用SPSS(20.0)对家系和供磷处理的影响效应进行双因素方差分析.若2个因素对杉木生长指标的影响无显著交互作用(P>0.05),则进行单因素方差分析,利用LSD多重比较方法进行检验(P=0.05).如果2个因素存在显著交互作用(P<0.05),则分析2个因素对测定指标的叠加影响效应.研究结果以平均值±标准差表示,不同小写字母表示同一家系在不同供磷处理间的差异达显著水平(P<0.05).
2 结果与分析
2.1 供磷处理和家系差异对杉木幼苗测定指标的双重影响
双因素方差分析结果(表2)表明,供磷处理和家系对杉木幼苗根体积、根生物量和根冠比的影响均存在明显的交互作用(P<0.05),而对苗高、地径、根长和根表面积的影响无明显交互作用(P>0.05).从单个因素来看,供磷处理对根系指标和地径的影响均达显著水平(P<0.05),而对苗高的影响不明显(P>0.05);家系对杉木苗高、地径和根系形态指标的影响均达显著水平(P<0.05).

表2 供磷处理和家系差异对杉木幼苗测定指标的双重影响Table 2 Interactive effect of phosphorus supply and family on the growth indexes of Chinese fir seedlings
2.2 低磷胁迫对不同家系杉木根系形态指标增量的影响
轻度与重度磷胁迫下,杉木根系形态指标增量明显提高(表3).与正常供磷相比,25号和38号家系在轻度与重度磷胁迫下,根系形态指标增量均显著增大;20号和41号家系在轻度磷胁迫下根系指标增量无显著变化,但随磷胁迫的加剧,根系形态指标增量均显著增大.其余家系杉木根系形态指标在低磷胁迫下虽有所增大,但均未达显著水平(P>0.05).
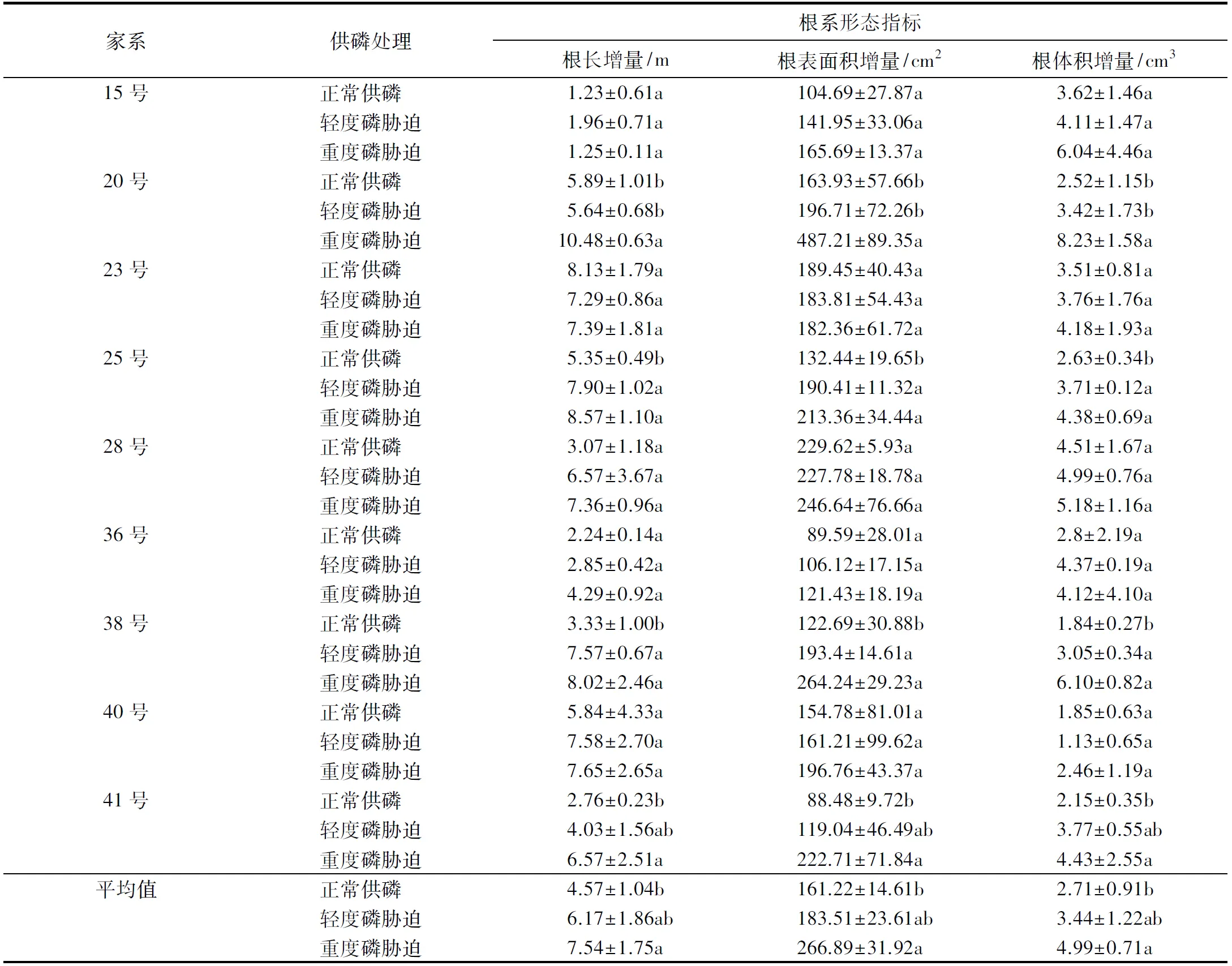
表3 不同家系杉木在不同供磷处理下根系生长指标增量的比较1)Table 3 Comparisons on increments of root morphological indexes among different P supplies for different families of Chinese fir seedlings
1)不同小写字母表示同一杉木家系不同供磷处理间差异达显著水平(P<0.05).
2.3 低磷胁迫对不同家系杉木生物分配量的影响
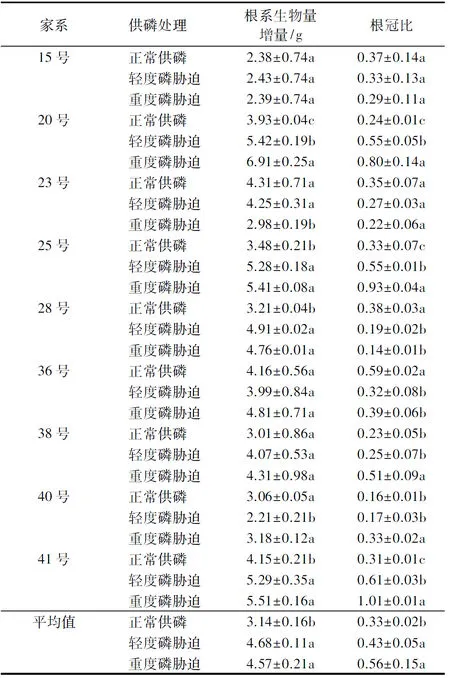
表4 不同供磷处理下杉木幼苗根系生物量增量与根冠比的比较Table 4 Comparisons on root biomass increments and root to shoot ratio of different families of Chinese fir seedlings under different P supplies
从表4可知:轻度与重度磷胁迫下不同家系杉木根系平均生物量增量和根冠比明显提高(P<0.05);随着低磷胁迫程度的加剧,20号、25号、28号和41号家系杉木根系生物量的积累显著增大,而40号家系呈先降低后上升的趋势(P<0.05);23号家系杉木在轻度磷胁迫下无显著变化,随着磷胁迫的加剧,根系生物量显著降低;从根冠比来看,20号、25号和41号家系杉木显著增大,而28号和36号家系明显减小;38号和40号家系杉木在轻度磷胁迫下无显著变化,但重度磷胁迫使得根冠比显著增大;其余家系杉木根系生物量和根冠比在不同供磷处理下差异均未达显著水平(P>0.05).
2.4 低磷胁迫对不同家系杉木苗高和地径的影响
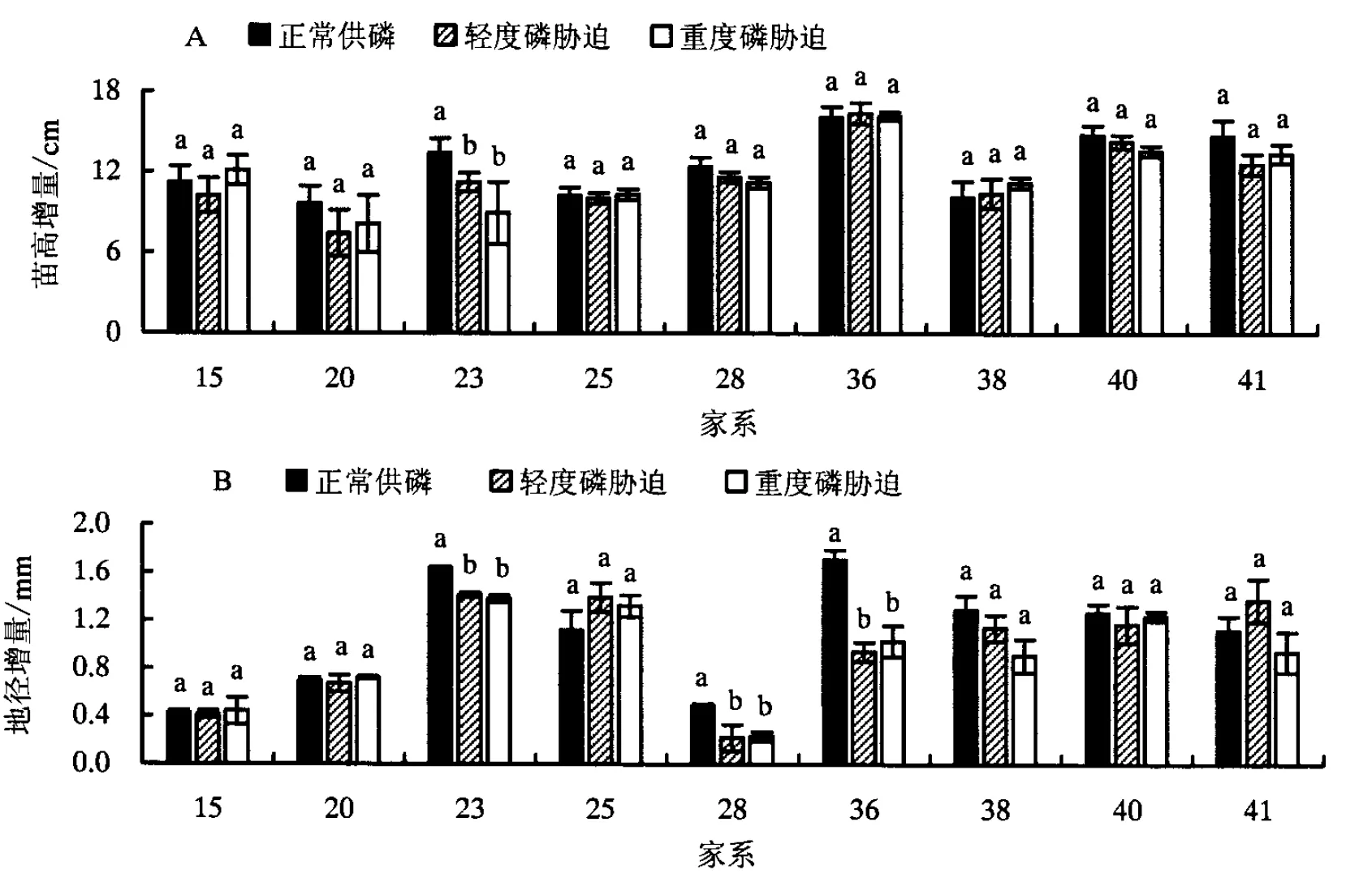
从图1可知,轻度与重度磷胁迫下,不同家系杉木平均地径增量明显降低(P<0.05),而平均苗高生长量下降不明显(P>0.05).从图2可知:23号家系的苗高生长量下降19.4%和40.1%,其他家系苗高增量无显著差异(P>0.05);其中,23号、28号和36号家系地径生长受低磷胁迫的抑制,其增量均显著下降(P<0.05).
2.5 低磷胁迫下不同杉木家系根系觅磷能力的综合评价
以正常供磷处理为对照,运用隶属函数法结合权重,分别选用轻、重度磷胁迫下苗高、地径、根长、根表面积、根体积、根生物量等增量指标和根冠比对9个家系杉木根系觅磷能力进行综合评价(表5).从表5可知:轻度磷胁迫时,排名前三的杉木家系分别为25号、36号和23号,其综合评价值分别为0.719、0.579和0.55;重度磷胁迫时,排名前三的杉木家系分别为20号、25号和41号,其综合评价值分别为0.744、0.665和0.644.当选取轻、重度磷胁迫下的综合评价值的平均值进行排序时,综合评价值表现为25号>20号>41号>36号>38号>23号>28号>40号>15号(表5),表明20号、25号和41号杉木具有较强的综合评价值.
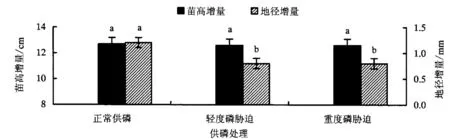
不同小写字母表示不同供磷水平处理间差异显著(P<0.05).图1 不同供磷处理下杉木平均苗高和地径增量的比较(平均值±标准误差)Fig.1 Comparisons on average increments of height and root collar diameter for Chinese fir seedlings under different P supplies (mean±SE)
不同小写字母表示不同供磷水平处理间差异显著(P<0.05).图2 不同供磷处理下不同家系杉木苗高和地径增量的比较(平均值±标准误差)Fig.2 Comparisons on increments of height (A) and root collar diameter (B) for different families of Chinese fir seedlings under different P supplies (mean±SE)
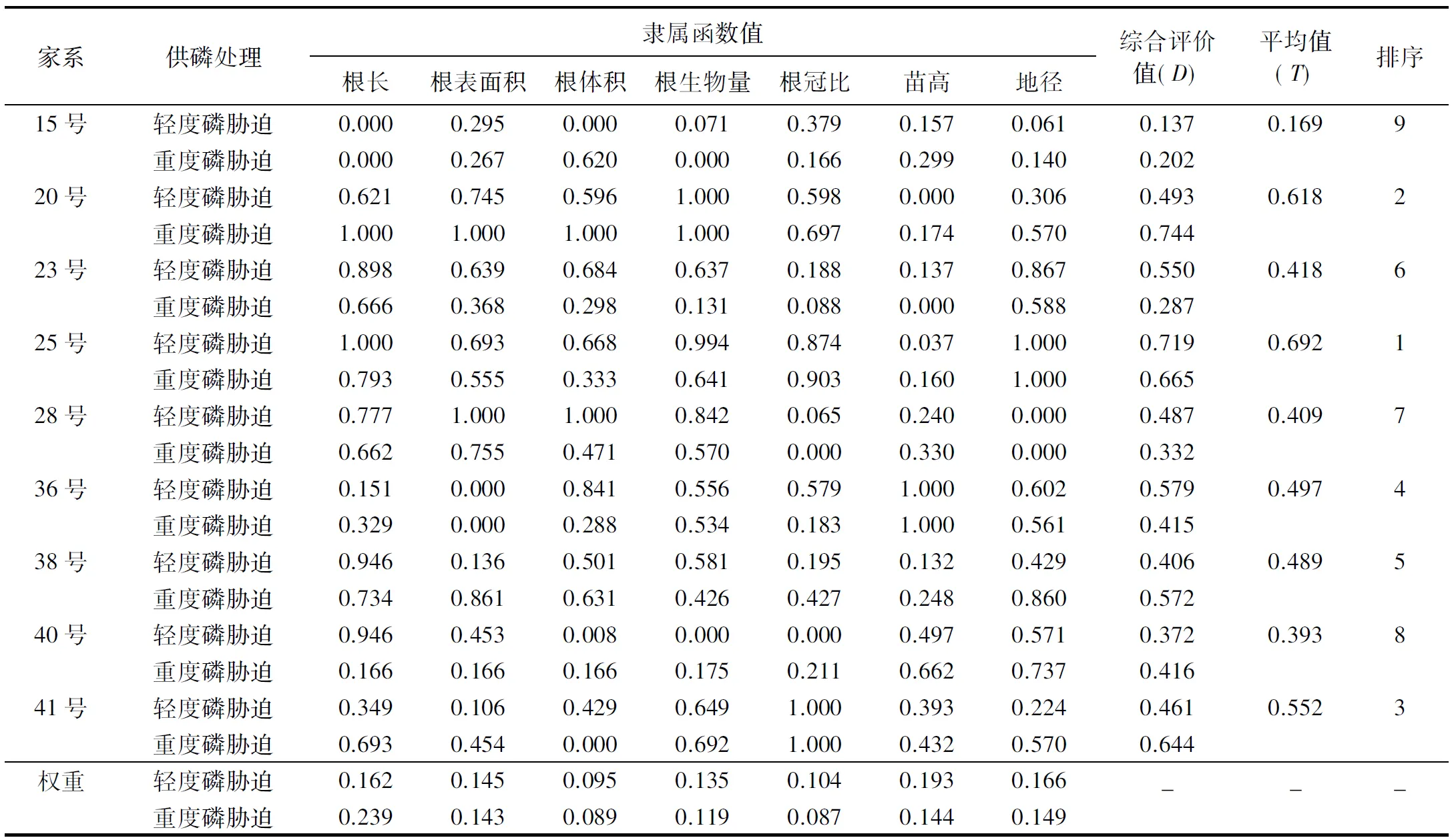
表5 轻度和重度磷胁迫下不同杉木家系生长指标的评价与综合排序Table 5 Comprehensive evaluation and ranking on growth indexes of Chinese fir seedlings from different families under mild and severe P stress conditions
3 讨论
自然环境中,植物难免遭受土壤养分供应不足、旱涝和重金属污染等多种逆境,但有些植物基因型可通过形态生理学变化以抵抗环境胁迫[13,25].本研究发现,低磷胁迫下不同杉木家系的苗高、地径、根系生物量及形态指标生长的差异明显(P<0.05),表明不同家系对低磷逆境的响应能力具有显著差异.特别在不供磷处理条件下,25号、20号和41号家系杉木的苗高和地径生长仍可保持较高生长量,同时根系的形态指标生长量和生物质分配量显著提高,以增加根系与土壤的接触机会,有效扩大磷素吸收范围,提高磷素吸收效率,从而维持地上部正常生长,其采用的是一种“主动”适应低磷环境的策略[26].这可能与有些杉木家系在有效磷含量极低、固定态磷丰富的生长介质中,根系释放有机酸[18,27]、质子或酸性磷酸酶[28]等生理指标仍然增大有关,最终导致杉木根系对介质中固定态磷的活化能力增强,提高了磷素生物有效性,以供自身生长需求[29].研究[30]也发现,植物可通过保持较高细根周转率来维持较高的养分吸收效率,同时通过分解死亡细根,将大量营养物质和养分带入土壤中,维持自身生长和生命活动.
然而,根系增生或释放分泌物会导致体内贮存养分的快速消耗,加重植物在低磷环境的胁迫程度[31].因此,有些植物为节省根系增生的能力消耗,会在磷素不足条件下启动体内化学信号的改变和转导,促进磷素内循环,采用一种“被动”适应低磷环境的策略,即主要通过溶解根系皮层细胞[32],活化细胞壁中储存的磷素[33-34],增强高亲和力无机磷运转蛋白的活性[35],以及提高叶片光合效率[36],提高体内磷素的利用效率,以适应低磷胁迫环境.也有研究[37]发现在磷饥饿状态下植物还可通过改变蔗糖等新陈代谢新的途径避免缺磷对植物能量循环的破坏,与此同时,胞内磷酸酶和核酸酶产生水解细胞内的代谢物和核酸释放出磷,促进体内磷素的高效利用.本研究中,36号家系杉木根系增生虽然不明显,但在低磷环境仍能够保持较高的地上部生长,这可能与其改变体内不同器官磷素分配的生理生化响应过程有关.
本文运用隶属函数法结合权重综合评价了9个参试家系杉木幼苗根系觅磷能力,其强弱排序为25号>20号>41号>36号>38号>23号>28号>40号>15号.其中,低磷环境中,25号、20号和41号家系杉木根系形态指标增大特别明显,对土壤磷斑块具较强的觅食能力,综合评价值较高,可在土壤有效磷较低的南方林区推广运用.另外,36号家系杉木具有启动“被动”适应低磷环境策略的能力,也可以考虑在进一步研究验证之后加以利用.

