安石榴苷在Caco-2细胞模型的肠吸收机制△
周本宏,李旷宇,姜姗,吴玥,兰昱
1.武汉大学 人民医院 药学部,湖北 武汉 430060;2.武汉大学 药学院,湖北 武汉 430072
石榴皮是石榴科石榴PunicagranatumL.的干燥果皮,具有涩肠止泻、止血、驱虫的功效,是一种常见的中药材。安石榴苷(Punicalagin)是石榴皮中主要的鞣花鞣质(Ellagitannin)类成分,已有研究表明,安石榴苷具有显著的药理活性,如抗氧化、抗肿瘤、抗菌、抗炎、抗病毒等[1-7]。Caco-2细胞来源于人结肠腺肿瘤,可以在体外培养的状态下自发地发生分化并形成单层的上皮样细胞,与肠道上皮细胞在形态学和生理功能上具有相似性,近30年来,该模型被广泛地用于研究药物的转运吸收[8]。现阶段,对安石榴苷等鞣质类成分的研究主要集中在其药理活性及作用机制,而对于其吸收转运的研究较少,本实验选用Caco-2细胞模型来研究安石榴苷的肠吸收机制,为安石榴苷的进一步开发利用提供理论依据。
1 材料
1.1 仪器与试剂
UV-1800型紫外分光光度计(岛津,日本);Millcell ERS-2跨膜电阻仪(Millpore,美国);CKX41倒置显微镜(Olympus,日本);酶标仪(Perkin Elmer,美国);LC-20AT高效液相色谱仪(岛津,日本);实验室pH计(Mettler Toledo,瑞士);HZ-301B恒温摇床(一恒科学仪器有限公司);transwell小室(Corning,美国)。
安石榴苷对照品(成都曼斯特,批号:16031501,纯度≥98%);维拉帕米,环孢菌素A(阿拉丁);碱性磷酸酶测试盒(南京建成);DMEM培养基,PBS,HBSS(Hyclone);胎牛血清非必需氨基酸,胰酶(Gibco);青-链霉素(吉诺生物);CCK-8试剂盒(日本同仁研究所);乙腈(美国Tedia,色谱纯);甲醇,三氟乙酸(德国Merck,色谱纯);EDTA-Na2(Biosharp);MillQ超纯水。
实验所用Caco-2细胞株细胞源自中国科学院典型培养物保藏委员会细胞库,代数在35~50代。
1.2 色谱条件
色谱柱:C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇(A),0.1%三氟乙酸水溶液(B)[10];洗脱条件:0~5 min,92%~70% B;5~11 min,70% B;11~11.5 min,70%~55% B;11.5~18 min,55% B;流速:1.00 mL·min-1;检测波长:378 nm;柱温:30 ℃;进样量:20.00 μL。
1.3 细胞毒性实验
本实验以CCK-8法进行细胞实验,操作如下:精密称定安石榴苷对照品,用HBSS配制,安石榴苷的浓度分别为100.00、150.00、200.00、250.00、300.00、350 μmol ·L-1;另取培养于96孔板中生长状态良好的细胞,向每孔加入100 μL不同浓度安石榴苷的HBSS,每个药物浓度设置6个复孔,1个对照孔,1个空白孔,孵育4 h后吸弃含药HBSS,用PBS洗涤细胞;最后向每孔加入100 μL含CCK-8试剂的空白培养基(每100 μL培养基含10 μL CCK-8试剂),2 h后用酶标仪测定各孔吸光度(A)值,检测波长为450 nm。按照公式(1)计算细胞存活率。

(1)
式中:As表示实验孔的吸光度值;Ac表示对照孔的吸光度值;Ab表示空白孔的吸光度值。
1.4 Caco-2细胞模型的建立与验证
1.4.1 细胞形态学观察 将细胞接种于细胞培养皿中,定期更换培养基,并于第4天、第7天、第14天、第21天在倒置显微镜下观察细胞形态。
1.4.2 碱性磷酸酶的测定 取培养第4天、第7天、第14天及第21天的Transwell小室,分别吸收上室(AP侧)和下室(BL侧)的培养基为测定管,标准管中加入等体积酚标准应用液,分别依次加入缓冲液、基质液及显色剂后于520 nm测定A值,按试剂盒上的说明简化得公式(2),计算其碱性磷酸酶的活力。
(2)
1.4.3 细胞电阻值的测定 用Millcell跨膜电阻仪分别测定第3天、第5天、第7天、第10天、第14天、第18天、第21天Transwell小室中细胞的跨上皮电阻(TEER),将电极置于HBSS溶液中平衡后,将电极的长端置于下室、短端置于上室细胞侧,读取电阻值,记录数据并按公式(3)计算细胞TEER值。
单位面积TEER(Ω·cm-2)=R测定×A
(3)
式中:R测定表示测定电阻值,A为有效膜面积。
1.4.4 标志性渗透物的检测 本实验选用酚红作为标志性渗透物来检测培养21 d后的Caco-2细胞单层膜的完整性及渗透率。取Caco-2细胞吸取AP及BL侧的培养基,在AP侧加入0.2 mL酚红溶液、BL侧加入0.6 mL空白HBSS溶液,分别于第30、90、120、150、180 min吸取下室溶液,测定酚红的含量,按公式(4)计算渗透率。空白小室为空白对照组。
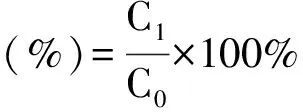
(4)
式中:C1为对侧酚红浓度;C0为酚红的初始浓度。
1.5 转运实验
取培养21 d、TEER值大于500 Ω·cm-2、碱性磷酸酶与酚红渗透率均达标[10]的Caco-2细胞,用37 ℃预热的HBSS溶液轻轻洗涤细胞2次,再加0.20 mL HBSS溶液至AP侧、0.60 mL HBSS溶液至BL侧,于37 ℃培养箱中平衡30 min,然后吸弃HBSS溶液;BL到AP侧的转运:向BL侧分别加入安石榴苷HBSS溶液0.60 mL,向AP侧加入0.20 mL空白HBSS溶液,在AP侧取样500 μL,取样后补足空白HBSS;AP到BL侧的转运:向AP侧分别加入安石榴苷HBSS溶液0.20 mL,向BL侧加入0.60 mL空白HBSS溶液,在BL侧取样500 μL,取样后补足空白HBSS。转运实验37 ℃摇床上进行,转速为55 r ·min-1。取样500 μL,加入500 μL甲醇,3000 r·min-1离心5 min,取上清液20 μL进HPLC分析后测得药物的累积转运量。
1.5.1 不同时间药物的累积转运量 向AP侧或BL侧分别加入150.00、200.00、250.00、300.00、350 μmol·L-1的安石榴苷HBSS溶液,向BL侧或AP侧加入空白HBSS,分别于60、90、120、150、180 min在AP侧或BL侧取样,取样后补足空白HBSS,样品预处理后按照1.2项下条件用HPLC进行分析。
1.5.2 浓度对药物转运的影响 向AP侧或BL侧分别加入150.00、200.00、250.00、300.00、350 μmol·L-1的安石榴苷HBSS溶液,向BL侧或AP侧加入空白HBSS,180 min后在AP侧或BL侧取样,样品预处理后按照1.2项下条件用HPLC进行分析。
1.5.3温度对药物转运的影响 向AP侧或BL侧分别加入250.00、300.00、350 μmol·L-1的安石榴苷HBSS溶液,向BL侧或AP侧加入空白HBSS,180 min后在AP侧或BL侧取样,转运实验分别在4 ℃和37 ℃条件下进行,样品预处理后按照1.2项下条件用HPLC进行分析。
1.5.4 pH值对药物转运的影响 向AP侧或BL侧分别加入pH值分别为6.0和7.4的安石榴苷HBSS溶液(空白HBSS溶液pH为7.4),安石榴苷的浓度为250.00、300.00、350 μmol·L-1,向BL侧或AP侧加入空白HBSS,180 min后在AP侧或BL侧取样,样品预处理后按照1.2项下条件用HPLC进行分析。
1.5.5 P-gp抑制剂对药物转运的影响 为了研究P-糖蛋白(P-glycoprotein,P-gp)对于安石榴苷肠吸收可能存在的作用,选用盐酸维拉帕米和环孢菌素两种不同的P-糖蛋白抑制剂(盐酸维拉帕米的浓度为100.00 μmol·L-1、环孢菌素的浓度为10.00 μmol·L-1)。转运实验前在小室中加入P-糖蛋白抑制剂,向AP侧或BL侧分别加入浓度250.00、300.00、350 μmol·L-1的安石榴苷HBSS溶液,向BL侧或AP侧加入空白HBSS,180 min后在AP侧或BL侧取样,样品预处理后按照1.2项下条件用HPLC进行分析。
1.6 数据处理
按照公式(5)、(6),计算安石榴苷表观渗透系数(Apparent permeability,Papp)值和外排率(Efflux ratio,ER)值。
(5)
(6)
2 结果
2.1 HPLC方法学考察
取安石榴苷母液,将母液稀释至10.00 mL棕色容量瓶中,浓度分别为1.25、2.50、5.00、7.50、10.00 μmol·L-1。每个浓度按照1.2项下色谱条件进样,每个浓度进样3次,得出峰面积值,以对照品浓度为横坐标(X)、峰面积(安石榴苷α、β峰面积之和)为纵坐标(Y),绘制标准曲线Y=3 833.9X-1 363.9,线性范围1.25~12.50 μmol·L-1,r=0.999 7。取对照品母液,稀释高、中、低(2.50、5.00、10.00 μmol·L-1)3个不同浓度,按照1.2项下色谱条件每隔2 h进样1次,平行进样5次,计算日内精密度值,按照日间精密度的测定方法连续测定5 d,得出日间精密度值。日内精密度值分别为2.07%、2.32%、2.98%,日间精密度值分别为2.89%、2.95%、2.31%。考察5.00 μmol·L-1安石榴苷在4 ℃和37 ℃条件下180 min内的稳定性,RSD值分别为0.59%和2.61%。2.50、5.00、10.00 μmol·L-13种不同浓度安石榴苷的回收率分别为98.36%、97.42%、101.14%。安石榴苷有α和β两种同分异构体,其专属性结果如图1所示。综上可知本实验所建立的方法符合生物样品测定要求。
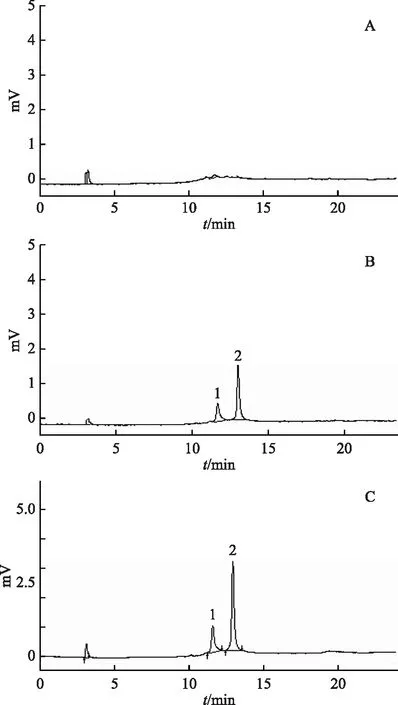
注:A.空白溶剂;B.安石榴苷对照品;C.HPLC分析样品;1.安石榴苷α;2.安石榴苷β。图1 安石榴苷专属性色谱图
2.2 细胞毒性实验
表1结果显示,不同浓度安石榴苷的细胞存活率均在95%以上,实验所用的各浓度的安石榴苷对细胞没有毒性。
表1 不同浓度安石榴苷的细胞毒性
2.3 Caco-2细胞模型验证
2.3.1 细胞形态学特征 到第14天时,显微镜下可观察到细胞连接紧密,开始呈上皮样分化,形成一层完整的单层膜。
2.3.2 碱性磷酸酶的测定 如图2所示,AP侧碱性磷酸酶值随着时间变化增长迅速,而BL侧增长缓慢,第21天时,AP侧的碱性磷酸酶值是BL侧的10倍以上,单层膜的极性符合要求。
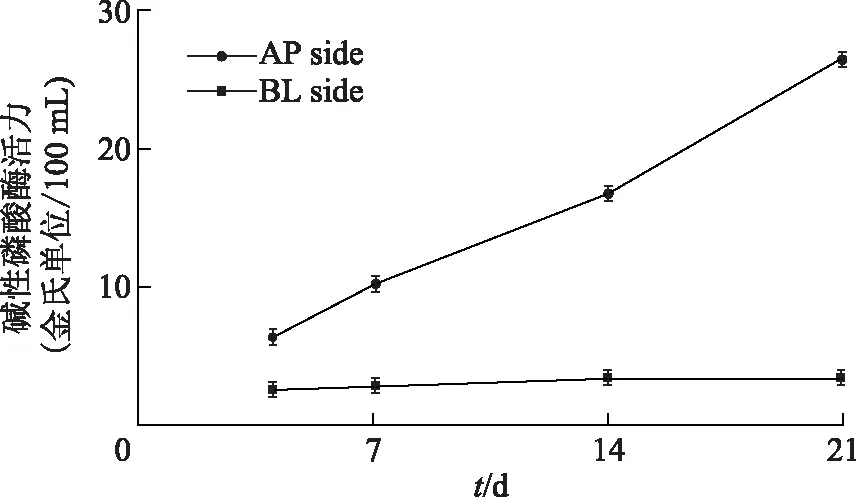
图2 不同生长时期Caco-2细胞碱性磷酸酶活性
2.3.3 细胞电阻值的测定 图3所示,细胞电阻值随时间变化而增加,第21天时,细胞电阻值大于500 Ω·cm-2,单层膜细胞连接紧密。
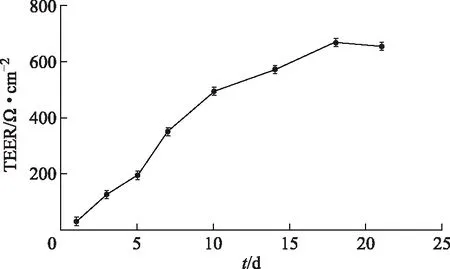
图3 不同生长时期Caco-2细胞跨膜电阻值
2.3.4 标志性渗透物的检测 如图4所示,180 min内细胞单层膜酚红的透过率小于0.05%,单层膜细胞完整性良好。
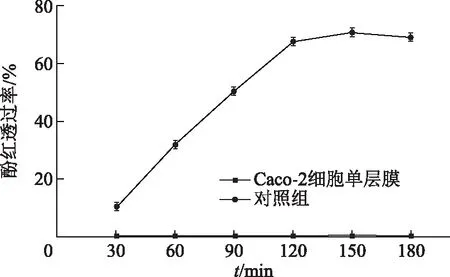
图4 Caco-2细胞模型的酚红透过率
2.4 转运实验
2.4.1 不同时间药物的累积转运量 不同时间AP侧到BL侧的药物积累转运量和BL到AP侧药物的累积转运量如图5所示,各浓度AP侧至BL侧和BL到AP侧的转运量均随时间的增加而呈现近线性效应。
2.4.2 浓度对药物转运的影响 不同药物浓度对于药物Papp的影响结果如图6所示。浓度为150.00、200、250.00、300.00、350 μmol·L-1的安石榴苷ER值分别为(1.81±0.03)、(2.00±0.05)、(2.18±0.06)、(2.30±0.08)、(2.51±0.32),各浓度ER值均接近2或大于2。

注:与Papp(BL-AP)相比,*P<0.05。图5 不同时间各浓度安石榴苷在Caco-2细胞的累积转运量
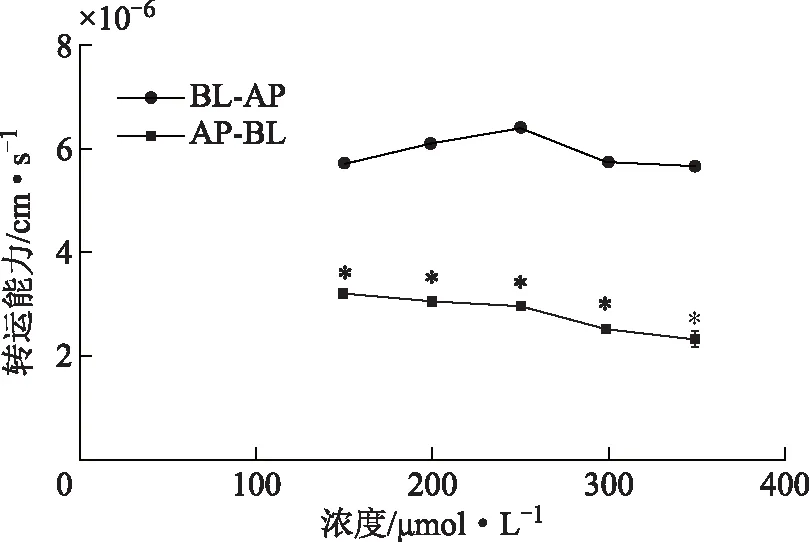
注:与Papp(BL-AP)相比,*P<0.05。图6 浓度对安石榴苷转运的影响
2.4.3 温度对药物转运的影响 如图7所示,4 ℃时250.00 μmol·L-1、300.00 μmol·L-1、350 μmol·L-1的安石榴苷从AP侧到BL侧和从BL侧到AP侧的Papp比37℃均有降低。各浓度的ER值分别为(2.19±0.14)、(2.15±0.10)、(2.29±0.14)。
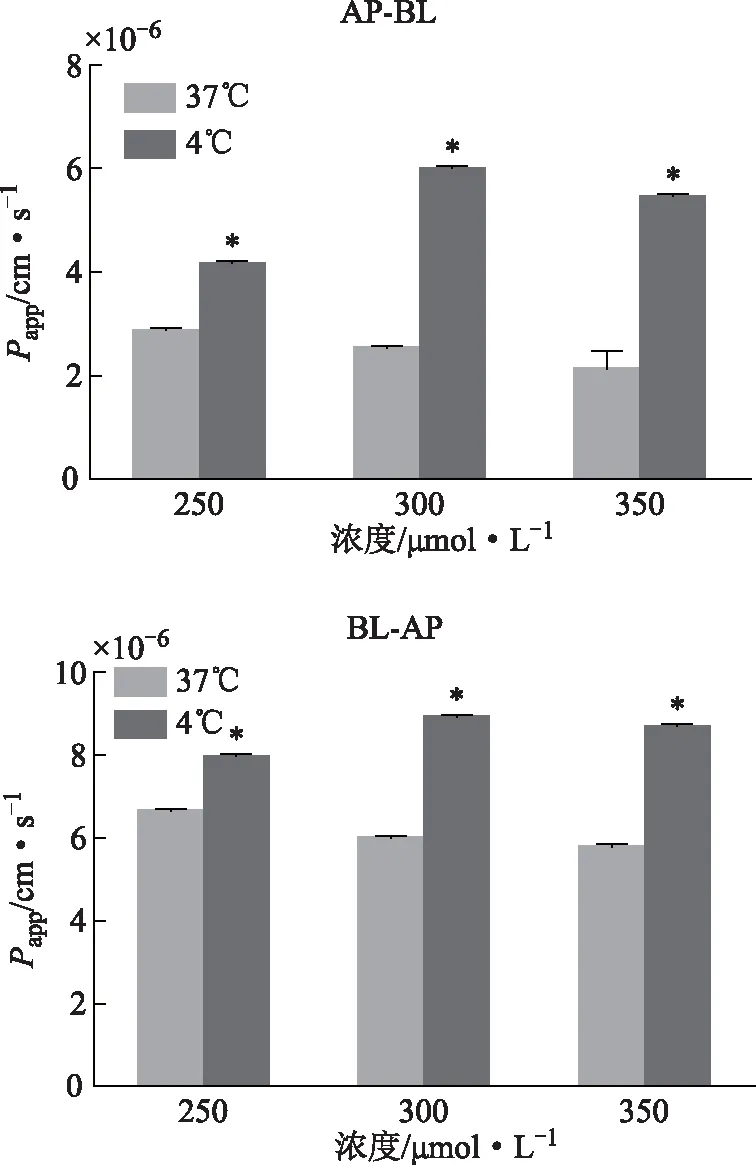
注:与37 ℃测定的Papp相比,*P<0.05。图7 温度对安石榴苷转运的影响
2.4.4 pH值对药物转运的影响 pH值对与安石榴苷Papp的影响如图8所示,与pH为7.4时相比,pH值为6.0时安石榴苷从AP侧到BL侧的转运量增多,而BL侧到AP侧的转运量无明显变化。pH值6.0条件下,250.00、300.00、350 μmol·L-1的安石榴苷的ER值分别为(1.37±0.03)、(1.18±0.04)、(1.46±0.04)。
2.4.5 P-gp抑制剂对药物转运的影响 P-gp抑制剂对安石榴苷转运的影响如图9所示,与对照组相比,加抑制剂时250.00、300.00、350 μmol·L-1的安石榴苷从AP侧到BL侧的转运增加,BL侧到AP侧的转运减少。维拉帕米组的ER值分别为(0.94±0.02)、(0.67±0.02)、(0.54±0.02);环孢菌素A组的ER值分别为(1.18±0.04)、(0.76±0.02)、(0.54±0.02)。
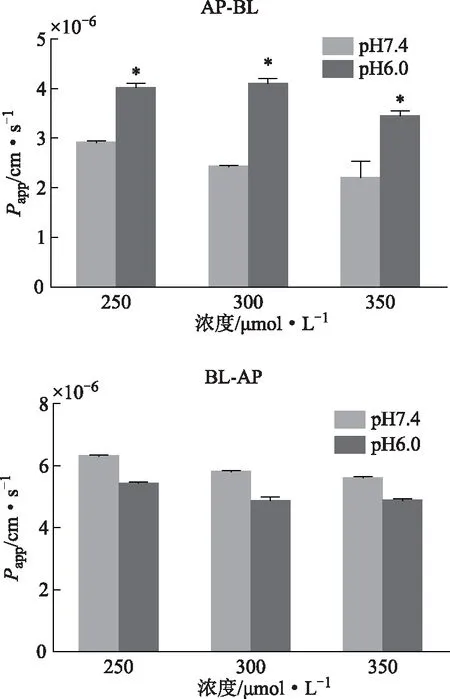
注:与pH为7.4测定的Papp相比,*P<0.05。图8 pH对安石榴苷转运的影响

注:与对照组的Papp相比,*P<0.05。图9 P-糖蛋白抑制剂对安石榴苷转运的影响
3 讨论
Caco-2模型功能的发挥与其细胞代数有着很大的关联,本实验选用的细胞确定代数在35~50代。同时,Caco-2细胞模型的建立需要多项指标的监控,主要是细胞的极性和单层膜的完整性[11],本实验通过观察细胞的形态学特征、测定细胞碱性磷酸酶活性、不同生长期的细胞跨膜电阻值及标志性渗透物的渗透率验证Caco-2细胞模型,筛选各指标均合格的细胞进行实验。
本实验建立了HPLC测定安石榴苷的方法,采用Caco-2细胞模型研究时间、浓度、温度、pH、P-gp抑制剂对安石榴苷转运的影响并推测安石榴苷的肠转运方式。通常情况下[12],药物Papp值大于1×10-6cm·s-1时,可认为该药物吸收良好,150~350 μmol·L-1的安石榴苷的Papp值在2.3×10-6~3.2×10-6cm·s-1,安石榴苷易被Caco-2细胞吸收。不同浓度的安石榴苷从AP侧到BL侧的转运和从BL侧到AP侧的转运均不具有浓度依赖性;不同浓度的安石榴苷Papp(BL-AP)值大于Papp(AP-BL)值,安石榴苷在Caco-2细胞的外排量大于摄入量,且各浓度安石榴苷ER值均大于1.5,可以认为安石榴苷的转运方式以主动转运为主;37 ℃条件下,安石榴苷的双向转运均多于4 ℃时的转运,进一步印证了安石榴苷存在主动转运的方式。pH为6.0时安石榴苷AP侧到BL侧的转运多于pH为7.4时,酸性条件促进安石榴苷的吸收,初步推测是由于酸性条件可促进安石榴苷的电离进而促进了其吸收。
P-gp是由人MDR1基因编码的跨膜转运糖蛋白,主要分布于细胞质膜上[13]。P-糖蛋白可通过利用ATP水解所释放的能量将底物排出细胞外,是主要的外排转运蛋白。P-gp抑制剂存在的条件下,安石榴苷的Papp(AP-BL)值增大、Papp(BL-AP)值减小,维拉帕米与环孢菌素两种代表性P-gp抑制剂均能促进安石榴苷在Caco-2细胞上的吸收、抑制其外排,P-糖蛋白参与了安石榴苷的转运。
综上可知,安石榴苷易于被Caco-2细胞吸收,在Caco-2细胞上的转运方式以主动转运为主,不具有浓度依赖性。同时安石榴苷在Caco-2细胞的吸收、转运、外排均受浓度、温度、pH值及P-gp抑制剂的影响,P-糖蛋白参与了安石榴苷的转运。

