中国黏膜黑色素瘤的临床特点及基因突变分析
黄复雪,李丹丹,文习之,李婧婧,祝保艳,张晓实
(中山大学肿瘤防治中心生物治疗科,广东广州510060)
黑色素瘤是一种具有高度侵袭性和种族特异性的恶性肿瘤。在中国每年新发病人数超过2万[1]。与西方人不同,中国黑色素瘤人群以肢端及黏膜型为主,黏膜型发病率约为24%[2],明显高于西方的1.3%,且具有发现晚,预后差的特点(中位生存时间,黏膜型9.1个月vs.皮肤型11.7个月)[3]。近年来,免疫治疗及靶向治疗在黑色素瘤治疗方面发展迅速,但可获益患者占比少,且黏膜型黑色素瘤免疫治疗疗效较皮肤型黑色素瘤差[4],可供选择靶向治疗药物有限。新的治疗方法有赖于对肿瘤分子机制的不断深入探索,本研究拟通过联合中国黏膜黑色素瘤患者的二代测序(next generation sequencing,NGS)测序结果及临床资料,为探寻中国黏膜黑色素瘤患者的个体化治疗提供依据和参考。
1 材料与方法
1.1 材料
收集2017年9月至2018年9月在中山大学肿瘤防治中心生物治疗科就诊并在我院行NGS测序的25例黏膜型黑色素瘤患者的临床资料及基因检测结果。本研究经医院医学伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 实验方法
1.2.1 组织样本采集和DNA提取 基因组DNA按照QIAamp DNA FFPE Tissue Kit说明书提取,DNA浓度使用Qubit dsDNA assay(Life Technologies)进行测定。
1.2.2 NGS文库制备 使用Covaris M220超声仪行DNA片段化,随后行末端补平、磷酸化和接头连接。使用Agencourt AMPure beads(Beckman Coulter,Brea,CA,USA)回收200~400 bp的DNA片段,随后行捕捉探针(钓饵)杂交,捕获杂交片段和聚合酶链反应(PCR)扩增。采用生物分析仪进行高灵敏度DNA检测以评估片段的质量和大小。50ng DNA用于文库构建。12个PCR循环用于文库扩增。富集的双端测序(读取长度150 bp)的样品在Nextseq500测序仪(Illumina,Inc,San Diego,CA,USA)上进行测序。
1.2.3 Panel描述 包含295个与癌症发生机理及靶向治疗密切相关的基因,利用探针杂交法富集其中287个基因的外显子区域和22个基因的内含子区域,报告与癌症有明确临床相关性的基因突变、扩增及融合变异(图1)。
1.3 统计学方法
采用SPSS 20.0对数据进行统计学分析,计数资料以样本的绝对数和相应的百分比表示。
2 结果
2.1 患者基本信息
研究共纳入黏膜黑色素瘤患者25例,其中男性14例(56%),女性11例(44%)。中位年龄为57岁,各亚型比例为:头颈黏膜13例(52%),阴道及尿道6例(24%),直肠肛管2例(8%),食管4例(16%),见表1。
图1 295个基因列表Fig.1 The 295 genes in our panel

表1 病人临床病理特点Table 1 Clinicopathological characteristics of the patients
2.2 黏膜黑色素瘤患者主要驱动基因突变情况
在25例黏膜黑色素瘤患者中,BRAF基因共观察到5例突变(5/25,20%),均发生在头颈黏膜黑色素瘤患者,其他类型黏膜黑色素瘤患者未见突变,其中2例为p.V600E突变,1例p.D94G突变,1例KCTD15-BRAF基因融合和1例基因拷贝数增加。KIT基因突变共在5(20%,5/25)例患者中检测到,3例拷贝数增加,2例错义突变,突变位点分别为p.W557G和p.L576P。3(12%,3/25)例患者检测到NRAS基因突变,位点分别为p.Q61R,p.G12V和p.G12D,均为热点突变。NF1基因突变共在2(8%,2/25)例患者中检测到3个变异,其中一例患者为p.Ala399fs移码突变,1例患者为p.Ser1331fs移码突变和p.K2593M错义突变,黑色素瘤驱动基因BRAF,NRAS,KIT,NF1的分布见图2。
2.3 黏膜黑色素瘤患者基因突变频率及各不同通路的突变情况
295个基因中125个基因发生至少一个变异,变异类型包括错义突变,剪切突变,拷贝数增加及缺失,无义突变,基因重排和基因融合。变异最多的基因为MYC基因,共观察到9例(9/25,36%),均表现为基因拷贝数增加(CN=2.67-6.74)。其次发生变异的基因为KDR,突变率为24%(6/25),除1例病人KDR同时观察到基因错义突变和拷贝数增加,其余患者均表现为基因拷贝数增加。目前,这些基因在黏膜黑色素瘤高频突变尚未见报道。多靶点药物治疗靶点如MET,PDGFRA,FLT4,ROS1等,及其他靶向治疗靶点如ALK,EGFR,ERBB3,mTOR等均在黏膜黑色素瘤患者有观察到。具体基因突变类型及分布见图3。
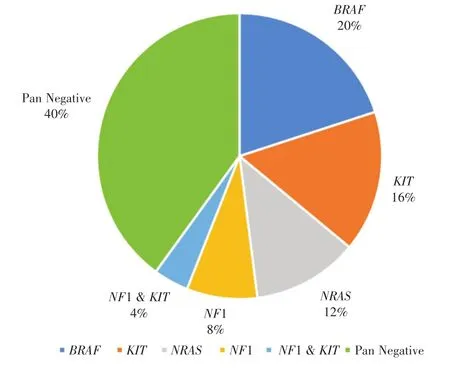
图2 25例黏膜黑色素瘤患者BRAF,NRAS,NF1及KIT基因突变分布Fig.2 Mutations of BRAF,NRAS,NF1,and KIT in 25 mucosal melanoma patients
随后,我们将125个基因根据功能分为DNA损伤修复、MAPK、生长因子及其受体、细胞周期、PI3K-mTOR、免疫应答和WNT/NOTCH相关通路,未纳入相关通路的基因没有纳入本部分分析。变异率最高的通路为DNA损伤修复76%(19/25),随后依次为细胞周期72%(18/25),生长因子及其受体 60%(15/25),PI3K-mTOR56%(14/25),MAPK 36%(9/25),免疫应答 28%(7/25)和WNT/NOTCH相关通路24%(6/25)。在DNA损伤修复相关通路,我们可观察到多个同源重组修复相关基因突变,如NBN,BLM,BRCA2,BRIP1,SMARCD1。细胞周期相关通路中,包含多个与黑色素瘤发生发展相关的基因,如CCND1,CDK4,SOX10等。生长因子受体通路包含多个超进展相关基因,如FGF19,FGF3和FGF4据报道可能与免疫治疗后超进展现象的发生有关。MAPK通路变异主要表现在BRAF,NF1及NRAS热点基因突变。各个通路包含的基因及分布见图4。
2.4 黏膜黑色素瘤患者的肿瘤突变负荷(Tumor mutation burden,TMB)及免疫相关基因突变情况
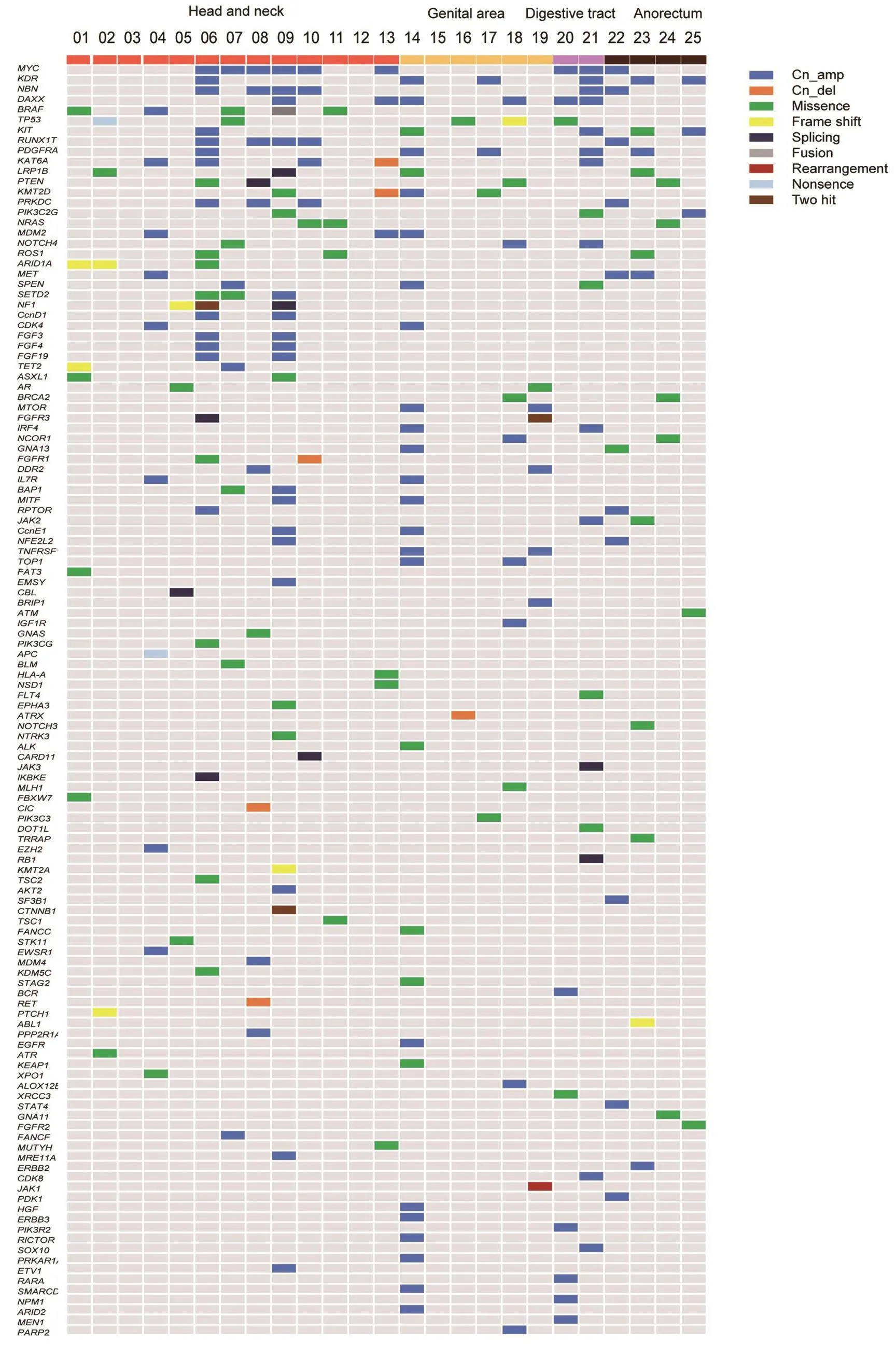
图3 125个突变基因突变频率Fig.3 Mutation frequency of 125 mutated genes
在25例黏膜黑色素瘤患者中,中位TMB为6.12(2.04~10)/Mb(图5)。免疫应答通路突变率为28%(7/25),我们观察到了与免疫治疗相关的JAK1/2,HLA-A基因的变异,突变频率分别为8%(2/25)和4%(1/25)。其他基因如BCR,CARD11,JAK3及STAT4也观察到4%(1/25)的突变(图4)。

图5 25例黏膜黑色素瘤病人的肿瘤突变负荷Fig.5 TMB of our 25 mucosal melanoma patients
3 讨论
黏膜黑色素瘤整体发病率低,侵袭性强,发展到晚期缺乏有效的治疗选择,深入了解其基因突变谱,探索新的治疗方法迫在眉睫。我们首次运用NGS对中国黏膜黑色素瘤人群的基因突变谱进行了探索,并发现多个目前在中国黏膜黑色素瘤人群尚未见报道的基因突变。
首先,我们观察了25例黏膜黑色素瘤患者中黑色素瘤的主要驱动基因变异,并与西方黏膜黑色素瘤测序结果及我中心皮肤黑色素瘤数据进行对比。不同于西方人群测序结果,在我们的黏膜黑色素瘤病人中,BRAF突变频率较高,为20%(5/25),且突变率高于我中心总的黑色素瘤人群(20%vs.16.3%),但低于皮肤黑色素瘤人群(20%vs.27%)[5],且均集中在头颈黏膜,其中 2例为p.V600E突变,1例p.D94G突变,1例KCTD15-BRAF基因融合和1例基因拷贝数增加。BRAF-V600抑制剂可为p.V600E突变提供治疗选择,对于非BRAF-V600突变患者,已有研究表明FDA已批准的BRAF-V600抑制剂,如vemurafenib及dabrafenib对非BRAF-V600突变的患者无效,而其他BRAF抑制剂的有效性尚未可知,有待大规模临床试验进一步证实,广谱RAF抑制剂及MEK抑制剂可能会发挥疗效,也有待进一步证实[6-7]。KIT基因突变率为20%(5/25),NF1基因突变频率为12%(3/25),均低于Hintzsche报道的西方人群的48%及37%,且各黏膜类型突变频率均低于Hintzsche[8]的报道,但KIT基因突变频率高于我们之前报道的总突变率5.8%,及皮肤型黑色素瘤的3%,也证实在中国黏膜黑色素瘤患者中,KIT或也属于主要驱动基因。NRAS基因突变频率为12%(3/25),位点分别为p.Q61R,p.G12V和p.G12D,均为热点突变,也高于我们此前报道的皮肤的7%,与总的10.5%类似[5]。
随后,我们对黏膜黑色素瘤中各信号通路及基因的变化进行了观察。在我们的研究中,最常见的基因突变为MYC基因扩增,其次为KDR扩增。MYC基因家族及其产物可促进细胞增殖,永生化,去分化和转化等,在多种肿瘤形成过程中发挥重要作用。已有体外实验证实c-MYC基因高表达与皮肤黑色素瘤侵袭性呈正相关,MYC抑制剂JQ1可有效抑制肿瘤生长[9],并有报道表明MYC或可调控PD-L1表达,影响免疫治疗疗效[10]。尽管MYC在黏膜黑色素瘤发生发展中的作用尚待研究,在存在有效抑制剂的情况下,MYC或可为黏膜黑色素瘤的治疗提供新的治疗靶点。KDR(VEGFR-2)是VEGF发挥促血管生成作用的主要功能性受体,具有明显趋化性和促分裂活性,是血管形成的主要调控因子,在维持肿瘤细胞生长过程中发挥重要作用[11]。
在各信号相关通路变异中,DNA损伤修复通路变异率最高,为76%(19/25)。既往我们认为黏膜黑色素瘤发生部位隐匿,无日光损伤,此通路变异率低,然而我们的数据表明,在黏膜黑色素瘤病人中广泛存在DNA损伤修复通路变异,或许与慢性炎症介导的DNA损伤有关。PARP抑制剂被认为是BRCA胚系突变的有效治疗药物,在乳腺癌,卵巢癌及前列腺癌的治疗上发挥重要作用,最近有报道显示在非BRCA突变的肿瘤中,PARP抑制剂同样可以发挥作用,存在ATM,ATRX,EMSY,FANCI,RAD52等其他DNA损伤修复相关通路突变的肿瘤或也可获益于PARP抑制剂[12-14]。对于合并细胞周期及PI3K-mTOR相关通路变异的黑色素瘤,有学者此前在体内及体外实验中均证实CDK4/6抑制剂及PI3K-mTOR通路抑制剂可发挥疗效[15-16]。生长因子受体通路上我们可见多个散发有可选靶向药物治疗的靶点,如MET,PDGFRA,KDR,FLT4,ALK,ERBB3及ROS1等。免疫应答相关通路中的基因突变,如JAK1/2,可能与免疫治疗继发耐药相关,对于合并此类基因突变的患者,联合治疗或许可以使患者获益[17]。
综上所述,在我们25例行NGS测序的黏膜黑色素瘤患者中,最常见的基因突变为MYC,KDR等基因扩增,DNA损伤修复,细胞周期,PI3K-mTOR及生长因子受体通路广泛存在突变,且存在多个药物治疗靶点。黏膜黑色素瘤基因突变与其他类型黑色素瘤存在差异,NGS测序可为黏膜黑色素瘤的治疗提供潜在治疗靶点。

