间充质干细胞对B细胞增殖及免疫调节功能的影响
刘秋莉,肖崇珺,黄牡丹,黄 里,陈小湧,郑海清
(中山大学1.附属第三医院生物治疗中心,广东广州510630;2.附属第三医院岭南医院康复医学科,广东广州510700;3.中山医学院干细胞中心,广东广州510080)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)是存在于骨髓中的非造血类的干细胞。近年来的研究发现,骨髓间充质干细胞除了具有较低的免疫原性外(低表达HLA-Ⅰ类分子,不表达HLA-Ⅱ类分子)[1-2],还具有调节免疫活性细胞反应的作用[3]:MSC除了能抑制T细胞由丝裂原刺激的增殖反应,增加调节性T细胞比例外,还可以促进B细胞的增殖、活化以及其抗体分泌,并影响B细胞的趋化功能。尽管B细胞是重要的免疫调节细胞,在许多自身免疫性疾病和移植排斥中发挥重要功能作用[4-5],但目前关于MSC对B细胞具体的免疫调节效应并不明确。已有文献报道MSC能够诱导调节性B细胞产生,但是经MSC教育后的B细胞的功能是否有变化?因此,本研究拟观察MSC对B细胞免疫调节作用的影响,从而探讨MSC是否具有教育或诱导B细胞亚群产生进而具有主动抑制其他免疫细胞增殖、活化以及分泌相关炎症因子的功能,为MSC在治疗自身免疫性疾病和移植排斥中通过调控B细胞发挥作用的机制提供一定的理论依据。
1 材料与方法
1.1 MSC的分离和培养
取健康供体来源的骨髓细胞约30 mL,并签署知情同意。采用Ficoll-Paque淋巴分离液(GE公司)用密度梯度离心法(450×g,30 min)从骨髓中分离单个核细胞;收集的单个核细胞接种至75 cm2培养瓶中,用低糖DMEM(L-DMEM,Low Glucose-Dulbecco′s Modified Eagle Medium)培养基在37°C,体积分数5%CO2条件下培养、换液、传代至第6代。
1.2 MSC表型鉴定
取体外培养到第6代的MSC消化重悬成106/mL,取100 μL细胞悬液于流式管,采用BD公司流式抗体CD29-PE、CD34-PE-cy7、CD44-APC、CD45-PE-cy7、CD73-FITC、CD90-PE、CD105-FITC、CD166-APC标记MSC,同型对照分别为PE、PE-cy7、APC、-FITC的IgG抗体,进一步流式细胞仪鉴定MSC表型,证明体外培养对MSC细胞表型无影响。
1.3 体外定向诱导MSC成骨、成脂细胞及鉴定
取第6代的MSC按4×103/cm2的密度接种于6孔板,细胞达到60%~70%融合后,吸去旧培养基,加入成骨细胞诱导液(含10-7mol/L地塞米松,10 mmol/L β-甘油磷酸钠,50 mg/L 维生素C),置37℃,体积分数5%CO2的饱和湿度条件下培养箱中,诱导培养3周后,吸去成骨细胞诱导液,用PBS缓冲液洗3次,40 g/L多聚甲醛固定15 min,加入适量茜素红S进行钙结节染色,光学显微镜下观察染色结果。同样,将第6代的MSC按4×103/cm2的密度接种于6孔板,细胞达到80%~90%融合后,加入脂肪诱导液(含1 μmol/L地塞米松,0.5 mmol/L 3-异丁基-1-甲基黄嘌呤,10 mg/L牛胰岛素,0.2 mmol/L吲哚美辛,100 mmol/L胎牛血清FBS的HDMEM)诱导3 d,再用含10 mg/L牛胰岛素,10%FBS的高糖DMEM(H-DMEM,High Glucose-Dulbecco′s Modified Eagle Medium)的脂肪诱导保持液处理1 d,如此循环3次后,用脂肪保持液处理7 d,每隔3 d换1次液。对照组加入含10%FBS的H-DMEM,置培养箱中,每隔3 d换液1次,最后吸去脂肪诱导液,用PBS洗3次,中性PFA室温固定1 h,进行油红O染色。
1.4 外周血淋巴细胞的制备
1.4.1 外周血单个核细胞的获取 通过密度梯度离心法,用淋巴细胞分离液分离肝素钠抗凝的不同健康人来源的新鲜外周血,收集全部白膜层单个核细胞,用无菌PBS按1:4稀释。450×g,离心10 min,弃上清。再加足量PBS洗涤两次。用含10%胎牛血清的RPMI-1640培养基(Roswell Park Memorial Institute,RPMI-1640)完全培养基悬浮细胞,即获得人外周血单个核细胞(Peripheral blood mononuclear cell PBMC)。
1.4.2 流式细胞仪分选外周血T、B淋巴细胞并检测纯度 用含0.1%BSA的PBS(pH 7.4)洗涤2遍,弃上清,加入BD公司流式抗体小鼠抗人CD3-FITC,CD19-FITC标记PBMC,抗体用量每次实验106个细胞/test,充分震荡混匀,4℃孵育30 min,然后用含0.1%BSA的PBS(pH 7.4)洗涤两遍,去除多余抗体;用PBS重悬细胞,BD influx流式分选仪分选细胞。分选所得的细胞采用FACS influx流式细胞仪检测其纯度,使检测细胞纯度>95%。
1.5 MSC与B细胞共培养
MSC接种在24平底孔板,按MSC∶B=1∶5比例共培养,即MSC每孔约1×105,B细胞5×105每孔。培养体系总体积为500 μL。分选纯化的CD19+B细胞,按MSC:B=1:5比例分别接种于24孔板,共培养3 d。收取细胞进行染色,标记CD19-FITC、CD5-V450、CD24hi-PE、CD27-APC、CD38hi-PECy7采用流式细胞仪分析CD19+CD5+B细胞、CD27+CD24hiB细胞与CD38hiCD24hiB细胞百分比变化以及CD19+CD5+B细胞生物学功能。
1.5.1 B细胞与MSC共培养对其增殖的影响 取invitrogen公司荧光染料CFSE(Carboxyfluorescein succinimidyl amino ester)标记的CD19+B细胞,PBS洗涤一遍,弃上清,用计数板计数后,按MSC∶B=1∶5的比例与MSC共培养,培养体系总体积为500 μL,并加入小鼠抗人 IgM 10 mg/L,CD40L 1 mg/L(刺激时间为96 h),所有细胞组均设3个复孔。96 h后收集B细胞,流式细胞术分别检测单独培养的B细胞以及和MSC共培养后的B细胞增殖情况。
1.5.2 MSC对B细胞细胞因子分泌的影响 取CD19+B细胞,PBS洗涤一遍,弃上清,用计数板计数后,按MSC∶B=1∶5的比例与MSC共培养3 d,培养体系总体积为500 μL,最后6 h加入BD公司 leukocyte activation cocktail,包含 PMA(Phorbol 12-Myristate 13-Acetate)50 μg/L、离子霉素(ionomycine)500 μg/L 以及 BFA(Brefeldin A)10 mg/L。72 h后收细胞,用含0.1%BSA+0.05%NaN3的PBS(pH7.4)洗涤一遍,弃上清,调整细胞浓度为106/mL,取100 μL细胞悬液于流式管,加入表型流式抗体CD19-FITC,充分混匀,室温避光孵育15 min;加100 μL细胞固定液(solution A),充分混匀,室温避光孵育15 min,然后用含0.1%BSA+0.05%NaN3的PBS(pH 7.4)洗涤一遍,弃上清;加100 μL细胞破膜液(solution B)重悬细胞,同时加入胞内细胞因子流式抗体IL-10,充分震荡混匀,4℃避光孵育30 min,然后加2 mL含0.1%BSA+0.05%NaN3的PBS(pH7.4)洗涤两遍,去除多余抗体;弃上清,用200 μL 10 g/L多聚甲醛(paraformaldehyde,PFA)重悬细胞,流式检测。
1.5.3 CD19+B细胞与MSC培养后对CD4+T细胞增殖的影响 取CFSE标记的CD4+T细胞(2×105细胞/孔),PBS洗涤一遍,弃上清,用计数板计数后,按CD19+B∶CD4+T=1∶1的比例,接种到anti-CD3 mAb(200 μg/L)的96孔板,并加入anti-CD28 mAb(1 mg/L)刺激。培养体系总体积为200 μL。所有细胞组均设3个复孔。流式检测96 h的CD4+T细胞增殖情况。
1.5.4 CD19+B细胞与MSC培养后对CD4+T细胞分泌IFN-γ的影响 取CD4+T细胞,PBS洗涤一遍,弃上清,用计数板计数后,按CD19+B∶CD4+T=1∶1的比例与MSC共培养3 d,培养体系总体积为500 μL,最后6 h加入 leukocyte activation cocktail。收细胞,用含0.1%BSA+0.05%NaN3的PBS(pH 7.4)洗涤一遍,弃上清,调整细胞浓度为106/mL,取100 μL细胞悬液于流式管,加入表型流式抗体CD4-FITC,充分混匀,室温避光孵育15 min;加100 μL solution A(细胞固定液),充分混匀,室温避光孵育15 min,然后用含0.1%BSA+0.05%NaN3的PBS(pH7.4)洗涤一遍,弃上清;加100 μL solution B(细胞破膜液)重悬细胞,同时加入胞内细胞因子流式抗体IFN-γ-APC,充分震荡混匀,4℃避光孵育30 min,然后用含0.1%BSA+0.05%NaN3的PBS(pH7.4)洗涤两遍,去除多余抗体;弃上清,用200 μL 1%PFA重悬细胞,流式检测。
1.6 统计学分析
采用SPSS软件分析结果,均以均数±标准差()表示。在外周血淋巴细胞相关实验中,鉴于不同健康人来源的B淋巴细胞按来源配对后被分为CD19+B细胞单独培养组和共培养组(按CD19+B∶MSC=5∶1比例),因此B淋巴细胞增殖实验、B细胞分泌IL-10实验以及检测B细胞亚群CD19+CD5+B细胞增殖实验与其IL-10分泌实验均采用配对t检验,P<0.05为有统计学意义;同样,在CD19+B细胞抑制CD4+T细胞分泌IFN-γ的实验中,CD19+B细胞单独培养组与MSC共培养组之间的比较亦采用配对t检验,P<0.05为有统计学意义。
2 结果
2.1 MSC的鉴定及体外诱导分化成骨、成脂
健康捐献者的骨髓在体外成功分离培养出MSC(图1A),并验证MSC在体外具有诱导分化成骨、成脂功能。当MSC在成脂诱导培养液中培养2周,大部分的细胞分化为被油红O染色的脂肪细胞(图1B)。当MSC在成骨诱导培养液中培养3周,大于80%的细胞分化为能被茜素红S染色的成骨细胞(图1C)。同时,我们还采用流式细胞仪分析MSC表型,细胞表面标记抗原CD29、CD44、CD73、CD90、CD105、CD166均为阳性,而不表达造血干细胞表面标记抗原CD45和CD34(图1D)。
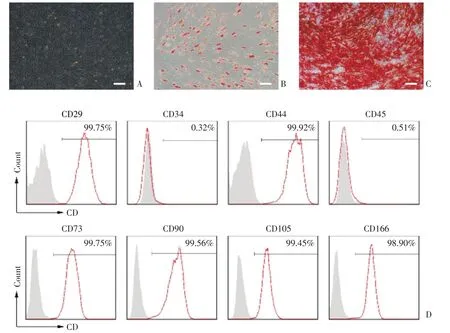
图1 MSC体外诱导分化及表面标记分子Fig.1 MSC induced differentiation and phenotype in vitro

图2 MSC促进CD19+B细胞增殖Fig.2 MSC promotes proliferation of CD19+B cells

图3 MSC促进CD19+B细胞分泌IL-10Fig.3 MSC enhances the IL-10 secretion of CD19+B cells
2.2 MSC在体外促进B细胞的增殖及其分泌IL-10
为了探讨MSC在体外对调节性B细胞免疫调节功能的影响,我们首先对MSC在体外对B细胞增殖及分泌相关因子功能的影响进行了研究观察。我们利用CFSE荧光标记系统来评估B细胞的增殖情况,结果发现:单独培养组中B细胞增殖的比例为(33.13±1.11)%;共培养组中B细胞增殖的比例为(42.30±0.58)%,以上实验细胞均重复3次,经统计学分析,两组之间的比较有统计学差异(t=2.6,P=0.016,图2A、B)。
IL-10是炎症反应中重要的抑炎因子。为了进一步分析MSC对B细胞免疫调节的影响,我们又对MSC在体外是否具有促进B细胞分泌抑炎症因子进行了研究。结果我们发现,在采用CpG+重组人可溶性CD40L预先刺激B细胞的条件下,共培养组分泌IL-10的B细胞的比例由(0.48±0.04)%增加至1.25%±0.07%,与单独培养组的B细胞比较,两组之间的差异有统计学意义(t=3.7,P=0.003,图3A、B)。以上实验均重复了3次。
2.3 MSC增强CD19+B细胞对CD4+T细胞增殖的抑制并减少其IFN-γ的分泌
既然MSC在体外具有促进B细胞的增殖及其分泌IL-10,我们接着进一步观察MSC是否也具有促进CD19+B细胞对CD4+T细胞的免疫调节抑制功能。结果我们发现,共培养组中的CD19+B细胞能明显抑制CD4+T细胞的增殖并减少其IFN-γ的分泌水平(图4A、B,5A、B)。
2.4 MSC增加CD19+CD5+B细胞的表达与IL-10的分泌
为了进一步解释分析CD19+B细胞与MSC共培养后具有明显抑制CD4+T细胞的增殖并减少其IFN-γ分泌的原因,我们紧接着又采用流式细胞仪对CD19+B细胞相关亚群细胞进行了分析,结果我们发现,共培养组中CD19+CD5+B细胞亚群的比例明显增加,而其它调节性B细胞亚群中CD27+CD24hiB细胞与CD38hiCD24hiB细胞反而呈减少趋势(图6A、B,7A)。

图4 MSC增强CD19+B细胞对CD4+T细胞增殖的抑制能力Fig.4 MSC enhances the ability of CD19+B cells to inhibit CD4+T cells

图5 MSC增强CD19+B细胞抑制CD4+T细胞分泌IFN-γ Fig.5 MSC enhances the ability of CD19+B cells to inhibit the secretion of IFN-γ by CD4+T cells

图6 MSC对其它调节性B细胞亚群表达的影响Fig.6 Effects of MSC on other subgroups expression of regulatory B cells
我们已在前面的研究中发现MSC能促进B淋巴细胞的增殖并且能增加其IL-10的分泌,而CD19+B细胞与MSC共培养后,能明显抑制CD4+T细胞的增殖并减少其IFN-γ的分泌水平,这是否与其分泌IL-10相关?因此,我们又继续分析B细胞中具有分泌IL-10的CD5+B细胞亚群,结果我们发现,共培养组中CD5+B细胞数量的百分比由单独培养条件下的(21.31±1.22)%增加至(31.27±0.92)%(t=2.7,P=0.014);而且其IL-10的分泌水平由(1.09±0.08)%增加至(2.44±0.06)%(t=4.6,P<0.001),差异有统计学意义(见图7A~D)。进一步实验中,我们在B细胞和T细胞的共培养体系中加入R&D公司小鼠抗人IL-10中和抗体(10 μg/mL),结果显示,IL-10中和抗体能够逆转B细胞抑制T细胞分泌IFN-γ(图8A、B)和细胞的增殖百分比(图8C、D)。

图7 MSC增加CD5+B细胞的比例与其分泌IL-10Fig.7 MSC increase the proportion of CD5+B Cells and its IL-10 secretion

图8 B细胞通过分泌IL-10抑制T细胞炎症因子分泌和增殖反应Fig.8 B cells inhibit T cells secretion inflammation cytokine and proliferation through secreting IL-10
3 讨论
B细胞是获得性免疫反应中的重要的效应细胞。一般认为B细胞通过产生抗原特异性抗体和辅助诱导CD4+T细胞活化而发挥正性免疫调节效应。直到在小鼠体内发现了负性调节免疫反应的特异B细胞亚群,才证实了调节性B细胞(Regulatory B-cell)的存在及B细胞对于维持机体免疫耐受的重要作用。近年来,越来越多的实验研究均表明了B细胞也具有免疫调节反应作用[4-6]。
Corcione等[7]发现MSC呈剂量依赖性地使B细胞停滞在Gn/G期,对其增殖产生明显地抑制性作用;同时,MSC还能抑制抗IgG抗体、可溶性分子CD40L以及其他细胞因子刺激下引起的B细胞的增殖;而Rafei等[8]的研究结果也发现MSC可以通过趋化因子CCL2抑制转录因子STAT3的表达,进而诱导PAX5蛋白的生成来抑制浆细胞Ig的分泌;还有研究表明MSC可以通过抑制B细胞介导的成熟蛋白-1信使RNA的表达,从而抑制B细胞终末分化。相反,也有研究表明MSC具有促进B细胞的增殖与分化的作用[9],这可能与MSC分泌的IL-7有关;在CpG,CD40L和IL-2的刺激下,MSC能诱导与其直接接触的B细胞增殖,然而这种诱导增殖的效应在Transwell培养体系里被阻断了;MSC还能诱导记忆B细胞增殖分化为浆细胞[9-10]。
我们在本研究中发现,MSC在体外培养体系具有增强B淋巴细胞对CD4+T细胞的增殖及其分泌IFN-γ水平的抑制能力(图4、5);当我们采用流式细胞仪进一步分析B细胞相关亚群细胞时,我们发现CD5+B细胞的数量明显增加,同时其分泌的IL-10也显著增加。这提示着MSC增强B淋巴细胞对CD4+T细胞的增殖及其分泌IFN-γ的抑制可能与具有分泌IL-10的CD5+B细胞的表达增加有关。Mizoguchi等[11]曾经报道过:他们在慢性结肠炎的小鼠动物模型中发现一群能分泌IL-10的调节性B细胞,而这群调节性B细胞高表达CD1d表型。Guo等[12]在hMSC治疗多发性硬化动物模型EAE小鼠时也发现,随着EAE小鼠临床病情的缓解,其体内具有分泌IL-10的CD1d highCD5+调节性B细胞明显的表达增加。Le Huu等[13]更进一步将CD1d highCD5+B10细胞过继输注至cGVHD小鼠模型中,他们发现cGVHD小鼠的硬皮病表现明显改善。这提示着MSC可能通过增加分泌IL-10的B细胞的表达,从而对自身免疫系统疾病起到相应的治疗作用。尽管目前也有些研究表明MSC是具有抑制B淋巴细胞的增殖[14],并且使得B淋巴细胞分泌IgM、IgG,和IgA的功能明显受损[7-8],但有的研究也证实了MSC能促进B淋巴细胞的增殖,这也充分地支持了我们的研究结果[15]。
CD5是一个具有免疫调节作用的细胞表面受体分子,除T细胞外,CD5分子还表达在一类特殊的B细胞亚群(B1a)表面[16]。经BCR(B细胞受体)激活后,人外周血中CD19+CD5+B细胞能产生较传统B细胞(CD19+CD5-B细胞)更多的IL-10[17],IL-10是一种重要的抑制炎症水平的免疫调节因子,能产生IL-10的B细胞称为调节性B细胞(Breg)。Dalloul[18]将CD5+B细胞描述为具有免疫调节能力的Breg细胞。Lo-Man[19]也曾报道CD5+B细胞通过产生大量的IL-10抑制新生小鼠的固有免疫反应的DC细胞的功能。Lemoine[20]发现CD5+B细胞能通过影响Treg细胞的功能发挥免疫抑制作用,在包括系统性红斑狼疮的多种自身免疫病人样本中均能发现相同的抑制作用。
虽然本研究在体外实验证实了MSC具有促进CD5+调节性B细胞表达的增加以及增强其免疫调节功能,但是MSC在体内是否也同样具有促进CD5+调节性B细胞的表达增加?其体内的功能学表现如何?以及MSC在体内对其免疫调节作用的影响的具体机制如何?我们仍不清楚,这也是本研究的不足之处,因此需要进一步的研究探讨。此外,虽然本实验研究所采用的PBMC均来自不同健康者提供的血液,且每组实验均至少重复3次并同时设置3个复孔,但其代表性仍有一定的局限性。

