嗜热链球菌的电转化条件
洛雪,时旭,史海粟,杜阿楠,陈茜,乌日娜,武俊瑞
(沈阳农业大学 食品学院,辽宁 沈阳,110866)
乳酸菌属于革兰氏阳性菌,微好氧,能够发酵碳水化合物生产乳酸,通常乳酸菌基因组中G+C含量较低,它与人类有密切的关系,是人类正常肠道菌群的组成成分,如双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、罗氏菌属(Rothia)、片球菌属(Pediococcus)、链球菌属(Streptococcus)和明串珠菌属(Leuconoostoc)等[1-2]。其中部分乳酸菌及其发酵产物有一定的生理功能,能够调节肠道微生态平衡、调节免疫功能、降低胆固醇、抑制有害菌生长等。并且它还能赋予发酵食品特有的滋气味和质感[3-4],因此近年来乳酸菌成为研究的热点,随着分子生物学技术的发展,诸多的乳酸菌全基因组(S.thermophilus、Lactococcuslactis、Lactobacillusacidophilus、Lactobacillusplantarun等[5-6])逐步测序成功,成为模式生物,基因工程改造的乳酸菌逐渐应用于食品工业、医药、保健品和饲料等行业[7]。前期乳酸菌的研究主要集中在菌群结构及多样性分析[8-9]、益生菌资源的挖掘[10-11]、优化乳酸菌及其产物的发酵条件等[12-13]。20世纪后期,研究人员开始研究乳酸菌基因功能、生物学特性及其代谢产物产生的分子机制。研究人员开始将外源基因转入乳酸菌中,提升乳酸菌的益生性能[14],但由于乳酸菌细胞壁紧致、厚密,外源DNA很难进入受体细胞,故而转化效率极低[15-16],严重制约了乳酸菌分子生物学的研究和基因工程技术的发展[17-18]。目前应用最广泛的乳酸菌转化外源DNA的方法是电转化法(electrotransformation)[19-20],该方法将乳酸菌放入到外加电场中,电流作用细胞壁和细胞膜表面产生微小通道,由于电导率和通透性发生变化,外源DNA可以进入细胞内[21],当电场消失后,乳酸菌经过富集培养,微小通道会消失,不会对细菌产生很大影响[22-23]。本研究选择乳酸菌组成型质粒pMG36e作为载体,该质粒已是一款成熟的表达载体[24],研究甘氨酸浓度、菌体生物量、电极缓冲液、电压和质粒浓度对嗜热链球菌转化效率的影响。
1 材料与方法
1.1 材料与试剂
嗜热链球菌sp1.1:本实验室前期同学分离自内蒙地区发酵乳制品,后经鉴定为嗜热链球菌。
pMG36e质粒:本实验室保藏。
甘油、甘氨酸、红霉素、蔗糖、柠檬酸铵、MgCl2、KH2PO4、K2HPO4等均为国产分析纯试剂。
1.2 仪器与设备
Gene Pilser Xcell电转仪,美国BIO-RAD公司;MILLI-Q超纯水仪,美国Millipore公司;BS124S万分之一分析天平,北京赛多利斯公司;PB-10精密酸度计,北京赛多利斯公司。
1.3 实验方法
1.3.1 红霉素杀伤曲线
将冻干或甘油冷冻保存的S.thermophilussp1.1纯化三代,进行纯培养,挑取单菌落接种于M17液体培养基,37 ℃培养24 h。制备不同浓度的红霉素平板(红霉素质量浓度5~30 μg/mL)。
1.3.2 甘氨酸对S.thermophilus感受态细胞的影响
按1%的接种量将S.thermophilussp1.1接入含有不同浓度甘氨酸的培养基(甘氨酸质量浓度为0、10、20、30、40、50 g/L)中进行培养,测定其12 h的生长曲线,以甘氨酸0 g/L的为对照。
1.3.3 菌体生物量对电转化率的影响
按1%接种量将S.thermophilussp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.2、0.4、0.6、0.8和1.0的菌体,制备S.thermophilus感受态细胞。
混合质粒与感受态细胞,冰浴,用电穿孔仪进行电击,电击结束后37 ℃温育复苏培养,将复苏后菌液涂布在红霉素抗性平板上,37 ℃静置培养48~72 h,比较不同菌体生物量对电转化率的影响。阴性对照为不加质粒的感受态细胞。
1.3.4 电极缓冲液对电转化率的影响
按1%接种量将S.thermophilussp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,比较不同电转缓冲液 Ⅰ(0.5 mol/L蔗糖,1.0 mol/L MgCl2,1.0 mmol/L KH2PO4/K2HPO4;pH 7.4)、Ⅱ(0.5 mol/L蔗糖,1 mmol/L柠檬酸铵;pH 6.0)、Ⅲ(272 mmol/L蔗糖,150 g/L甘油)、Ⅳ(272 mmol/L蔗糖,100 g/L甘油,10 mmol/L磷酸盐缓冲液;pH 7.4)和100 g/L甘油电转缓冲液对电转化率的影响结果,感受态细胞具体制作方法同1.3.3。 阴性对照为不加质粒的感受态细胞。
1.3.5 电压对电转化率的影响
按1%接种量将S.thermophilussp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,利用电转缓冲液Ⅱ制备感受态细胞,具体制作方法同1.3.3。设置电压为1.4、1.6、 1.8、2.0、2.2和2.4 kV进行电转化。37 ℃静置培养48~72 h后,比较不同电压对电转化率的影响结果。阴性对照为不加质粒的感受态细胞。
1.3.6 质粒浓度对电转化率的影响
按1%接种量将S.thermophilussp1.1接入含有10 g/L甘氨酸的MRS液体培养基中,37 ℃培养,收集OD600为0.8的菌体,利用电转缓冲液Ⅱ制备感受态细胞,制备电压选取1.8 kV,具体制作方法同1.3.3。设计质粒质量浓度设为0.2~1.6 g/L进行电转化。37 ℃ 静置培养48~72 h后,比较不同电压对电转化率的影响结果。阴性对照为不加质粒的感受态细胞。
2 结果与讨论
2.1 红霉素杀伤曲线
结果如表1所示,初选质量浓度梯度为5 μg/mL,结果显示红霉素质量浓度为5 μg/mL时,S.thermophilus能够生长,红霉素质量浓度为10 μg/mL时,S.thermophilus不能生长,说明S.thermophilus对红霉素比较敏感,降低浓度梯度为2.5 μg/mL,在质量浓度达到7.5 μg/mL时S.thermophilus不能生长,因此,后续实验红霉素抗性平板质量浓度为7.5 μg/mL。
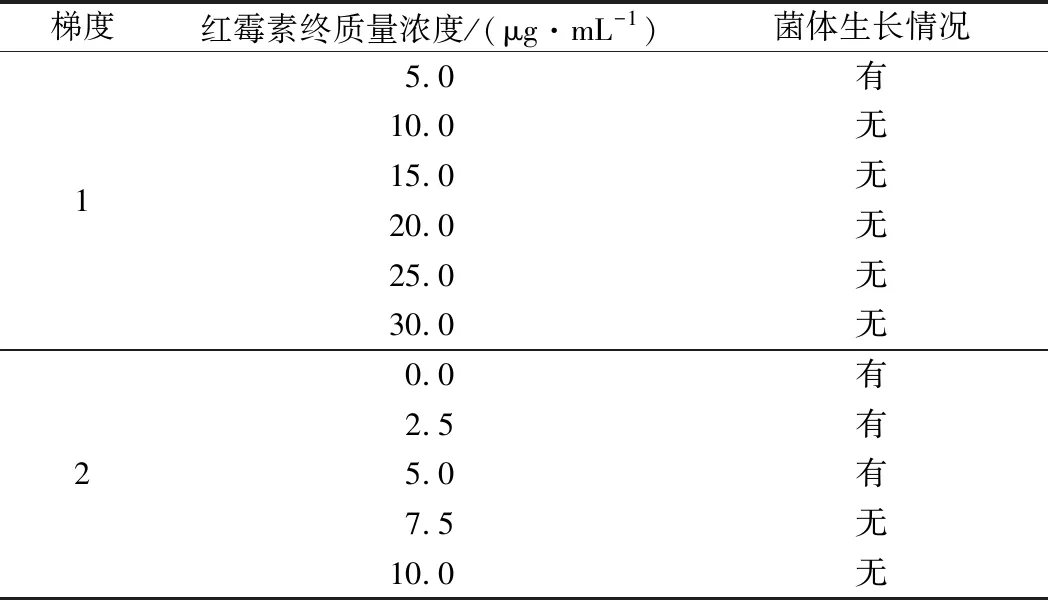
表1 红霉素对S.thermophilus的影响Table 1 Effect of S. thermophilus by erythrocin
2.2 甘氨酸对S. thermophilus转化率的影响
结果显示甘氨酸会影响S.thermophilus的生长(图1-A),培养基中的Gly添加量不同,对S.thermophilus的生长影响程度不同,Gly添加量与细胞的生长速率呈现负相关,即甘氨酸添加量越高,细胞生长越缓慢,分析培养12 h的S.thermophilus生长结果,Gly添加量为10~40 g/L的培养基中S.thermophilus的生长速率为在正常培养基中的74.6%、42.3%、29.8%和24.1%;当Gly添加量达到50 g/L时,S.thermophilus基本不生长。
选取各组菌株对数生长期(OD600≤0.7),制作感受态细胞,未添加Gly、Gly添加量为30和40 g/L的实验组,其转化效率为0;Gly添加量为10 g/L的实验组,转化效率最高,结果见图1-B,可能由于Gly在菌体生长过程中取代肽链上的L-丙氨酸和D-丙氨酸,影响由双糖单位(N-乙酞葡萄糖胺和N-乙酰胞壁酸)、短肽链和肽桥组成的肽聚糖的结构[25],这种替代造成了丙氨酸与尿苷二磷酸胞壁酸的连接,而酶因无法识别底物而受阻,使得合成含Gly的肽聚糖前体物积累,破坏了细胞壁生长过程中肽聚糖合成与酶水解的平衡。因此合成的肽聚糖有缺陷,使得细胞壁变得疏松[26]。但Gly添加量过大会导致菌体死亡,后续实验选择Gly的添加量为10 g/L。
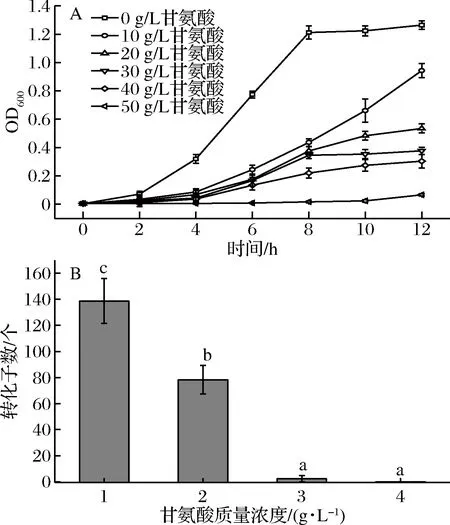
图1 甘氨酸浓度对菌体生长(A)及转化效率(B)的影响Fig.1 Effect on cell growth (A) and conversion efficiency (B) under different glycine content注:图中不同小写字母代表差异显著,P<0.05。下同。
2.3 菌体生长时期对电转化效率的影响
如图2所示,细菌在不同生长时期的转化效率不同,总体呈现先上升后下降的趋势。利用生长初期细胞(OD600<0.8)制作的感受态细胞,转化效率随OD值的增加而上升;当OD600=0.8时,转化效率达到最高,可产生近120个转化子;利用对数生长期后期细胞(OD600>0.8)制作的感受态细胞,转化效率随OD值的增加而下降,由于在OD600=0.8时,细胞处于最旺盛的生长阶段,细胞活力最高,代谢旺盛,细胞壁结构相对松散,电击时易于形成空洞,有效转化菌株量多,随着生长时间的增加,细胞逐渐衰亡而使转化菌株量减少[27],因此后续实验选择将S.thermophilus培养至OD600=0.8制作感受态细胞。
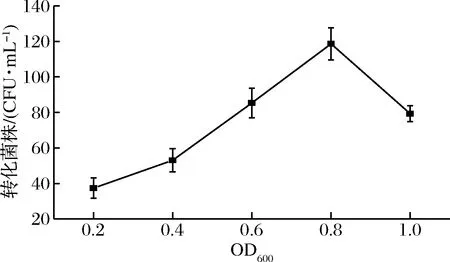
图2 细菌不同生长时期对转化率的影响Fig.2 Effect of growth phase on transformation efficiency
2.4 电压对电转化效率的影响
结果如图3所示,电压对转化率的影响总体呈现先上升后下降的趋势,转化电压相对较低时(1.4~1.8 kV),细胞难以极化产生孔洞,DNA不能进入,随着电压的升高[28],转化效率随之增大,电压达到1.8 kV 时,转化效率最高,如果转化电压继续增大,细胞会因细胞膜损伤过大而死亡,转化效率反而呈下降趋势[29],因此后续实验选择转化电压为1.8 kV。
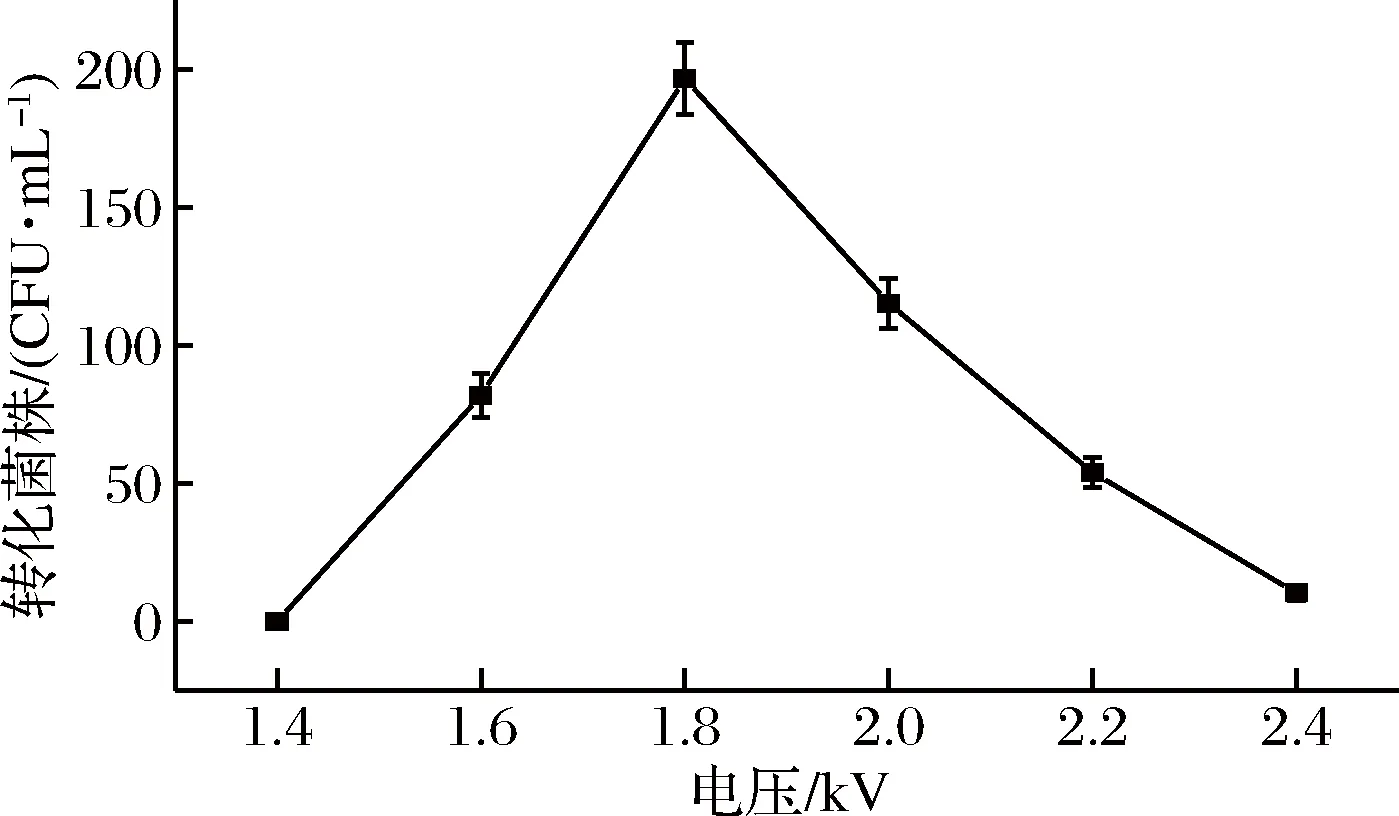
图3 不同电压对转化率的影响Fig.3 Effect of voltage on transformation efficiency
2.5 质粒浓度对电转化效率的影响
结果如图4所示,在质粒质量浓度为0.2~1.0 g/L时,电转化效率随着质粒浓度增大而提高,质粒质量浓度达到1.0 g/L时电转化效率最高,随后在质粒质量浓度为1.0~1.6 g/L时,电转化效率随着质粒浓度的增大而降低,质粒质量浓度在1.0 g/L时达到饱和,再增加质粒浓度会阻塞细胞孔洞,从而使转化菌株减少,高玲等在多黏类芽孢杆菌JSa-9电转化方法的优化试验中,所得的质粒添加量对转化菌株的影响也呈此趋势[30]。因此后续实验选择质粒质量浓度为1.0 g/L。
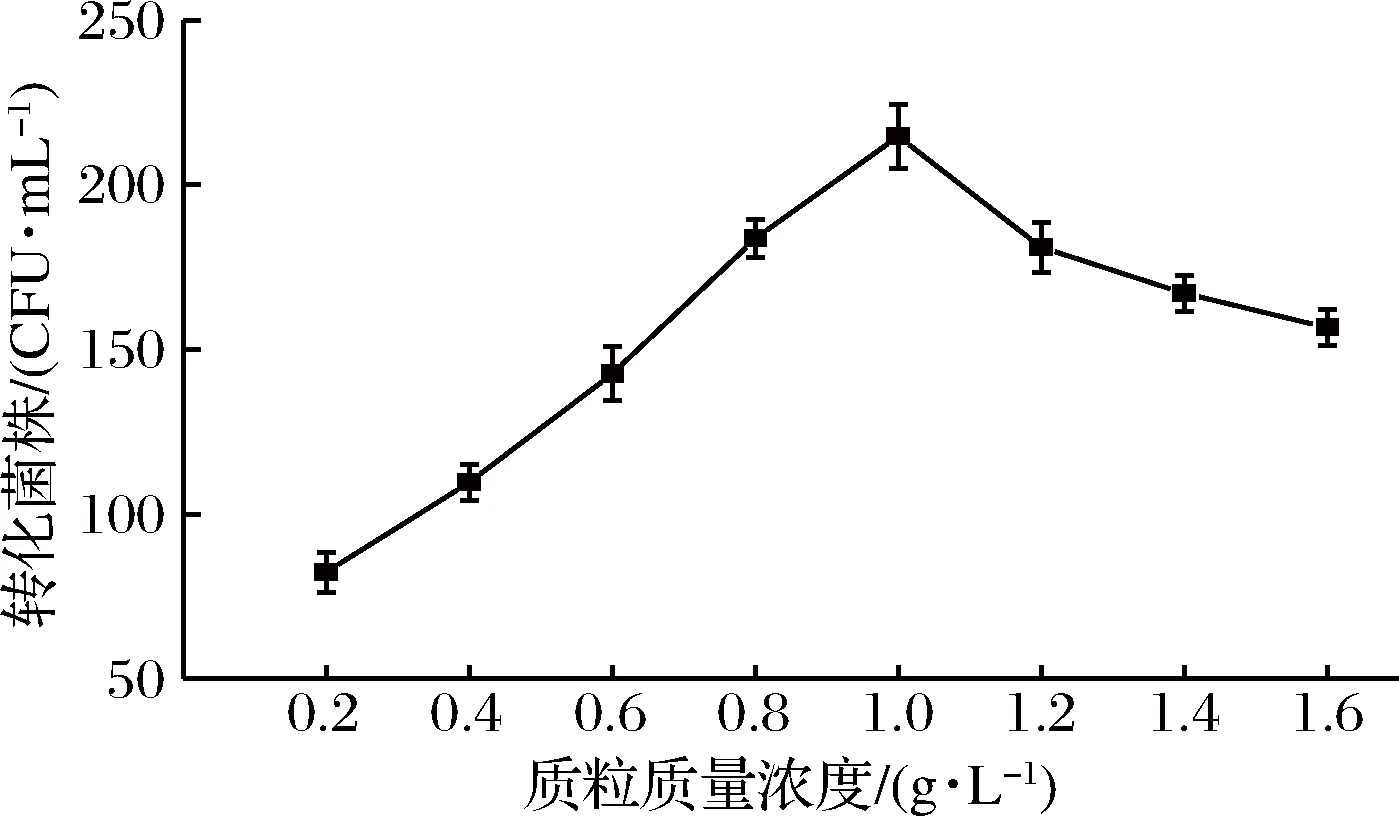
图4 不同浓度质粒对转化率的影响Fig.4 Effect of differentcontent of plasmid on transformation efficiency
2.6 电转缓冲液对电转化效率的影响
将S.thermophilus接入含10 g/L Gly的M17培养基中,接种量为1%,37 ℃培养至OD600=0.8,选择不同电转缓冲液(Ⅰ、Ⅱ、Ⅲ、Ⅳ和100 g/L甘油)制作感受态细胞,配制1.0 μg/μL质粒用于转化,用1.8 kV电压进行电转化,研究不同电转缓冲液对电转化效率的影响。
如图5所示,不同电转缓冲液处理的感受态细胞电转化率不同,用电转缓冲液Ⅰ和Ⅱ处理的细胞,转化效果较好,电转缓冲液Ⅱ的处理效果优于电转缓冲液Ⅰ;电转缓冲液Ⅳ处理的感受态细胞,在转化时发生了击穿的现象,可能由于电击介质的电阻过低造成了这种现象;电转缓冲液Ⅲ和100 g/L甘油处理的感受态细胞转化率为0,说明这2种电转缓冲液不能使S.thermophilus形成感受态,后续实验选择电转缓冲液Ⅱ作为电转化缓冲液。

图5 不同缓冲液对转化率的影响Fig.5 Effect of different buffer on transformation efficiency
3 结论
S.thermophilus红霉素的敏感阈值为7.5 μg/mL,甘氨酸添加量、菌体生长时期、转化电压、质粒质量浓度和电转缓冲液均影响S.thermophilus的转化效率,本研究选择甘氨酸质量浓度为10 g/L、菌体生长至OD600=0.8、转化电压为1.8 kV、质粒质量浓度为1.0 g/L、 选择电转缓冲液Ⅱ。本研究为后续构建嗜热链球菌基因工程菌株奠定了一定的基础。

