对大肠杆菌生物膜具有高抑制能力的乳酸菌的筛选
姚沛琳,王剑,张新剑,黄悦
(宿州学院 生物与食品工程学院,安徽 宿州,234000)
细菌生物膜是附着于物体表面被细菌胞外大分子包裹的有组织的细菌群体,与浮游状态的细菌相比,对抗生素和宿主免疫防御系统具有较强的抗逆性[1-2]。细菌生物膜具有群体感应,以“团队作战能力”使整个种群更好地存活下来[3-4]。现已证明,很多久治不愈的慢性细菌性感染与生物膜有关[5],如肺囊性纤维化,弥漫性泛细支气管炎,牙周炎,肠道感染,心瓣膜性心内膜炎等[6]。
大肠杆菌是引起泌尿系统、呼吸系统、消化道系统感染的常见病原菌,也是研究容易形成生物膜的模式病原菌[7]。抗生素法是目前临床上治疗致病菌生物膜感染最常用的方法,宋雅山等[8]的研究表明,米诺环素对大肠杆菌生物膜有抑制作用,可以缓解透析相关腹膜炎。陈盛等[9]的研究表明,巯乙磺酸钠可显著减少大肠杆菌的黏附及产EPS的能力。中草药法抑菌取得了一定的研究进展[10],李斌等[11]研究表明,黑木耳提取物对大肠杆菌生物膜形成有抑制作用。喻华英等[12]研究表明,黄连、苦豆子、金银花和连翘可以抑制大肠杆菌生物膜的形成。抗生素由于引起细菌抗药性的问题,世界范围内正在呼吁减少抗生素的使用[13]。中草药法虽然比较温和,但是由于其本身味道的限制,在实际应用上有很大的局限性[14]。因此以益生菌为主的细菌替代疗法越来越受到关注,其中乳酸菌是目前最常见的一类益生菌。
乳酸菌具有多种益生功能[15-16]。在乳酸菌抑制变异链球菌(引起龋齿的主要病原菌)生物膜的研究中取得了一定的研究进展。KHAN等[17]发现来源于印度藏茴香种子的提取物能够降低变异链球菌生物膜的活性,抑制变异链球菌对唾液包被羟基磷灰石的黏附和水不溶性葡聚糖的合成。KANG等[18]发现来源于儿童唾液的2株食寇魏斯氏菌CMS1和CMS3能够显著抑制变异链球菌生物膜的形成,并且它们合成的水溶性葡聚糖也能够抑制变异链球菌生物膜的形成。乳酸菌对致病菌的抑制作用机理,除了产生抑菌物质对致病菌有杀伤作用外,与致病菌对营养物质或者黏附位点的争夺也密切相关[19]。而目前在该领域的研究,多是研究乳酸菌代谢产物对游离大肠杆菌的抑制作用,很少涉及到乳酸菌的代谢产物或乳酸菌菌体对大肠杆菌生物膜的抑制作用。
乳酸菌具有中草药无法比拟的优点,如味道上可以被绝大多数人群接受,乳酸菌的摄入可以增加体内有益菌的数量,再加上益生菌概念深入人心,为乳酸菌的应用提供了可行性。乳酸菌对大肠杆菌生物膜的研究还未见报道,所以此领域具有较大的研究价值。因此,本实验主要通过体外生物膜的方法研究乳酸菌对大肠杆菌生物膜形成的影响。
1 材料与方法
1.1 实验菌株
乳酸菌来源:从皖南、皖北地区采集的家庭自制腌制菜、市售酸奶、自制葡萄酒等。
大肠杆菌ATCC25922,由本实验室保存。
1.2 设备及试剂
1-15PK离心机,湖南湘仪实验室仪器开发有限公司;Multiskan GO酶标仪,美国Thermo公司;722型可见光分光光度计,上海仪电分析仪器有限公司;SHP-250型电热恒温培养箱,上海三发科学仪器有限公司;OLYMPUS IX71荧光倒置显微镜,广州市明美科技有限公司。
MRS培养基、LB培养基均购于青岛海博生物技术有限公司。
主要试剂:细菌基因组提取试剂盒、PCR试剂盒、溶菌酶、PI染料、CFSE染料等,均购于上海生物工程有限公司;甲醇、结晶紫、乙醇、NaH2PO4、Na2HPO4、牛胆盐、NaCl等化学试剂,均购于国药集团。
1.3 实验方法
1.3.1 乳酸菌的分离与纯化
从皖南、皖北地区采集的家庭自制腌制菜的汁液中分离乳酸菌菌株。无菌操作取1 mL的样品,用无菌生理盐水进行10倍梯度稀释,直至稀释到10-5。取10-3、10-4、10-5这3个梯度的稀释液各0.1 mL分别涂布于MRS固体培养基上,37 ℃厌氧培养48 h。采用平板划线法,挑取典型菌落,多次划线后得到纯菌株。经菌落形态观察、革兰氏染色镜检、接触酶实验,将革兰氏染色阳性、接触酶实验阴性的菌株接种到MRS液体培养基中,过夜培养,-80 ℃甘油保藏[20]。
1.3.2 体外抑菌实验
本实验采用牛津杯琼脂扩散法[21]。将活化3代的乳酸菌接种到MRS液体培养基中,37 ℃培养20 h,在4 ℃和12 000 r/min下离心30 min,用0.22 μm微孔滤膜将离心后的菌液进行过滤,得到乳酸菌无细胞发酵上清液。将活化3代的大肠杆菌接种到LB培养基,37 ℃摇床过夜培养12 h,调节OD至0.3,大肠杆菌的菌落数控制在1×108CFU/mL左右。LB固体培养基与大肠杆菌菌液混合凝固后,用镊子将无菌的牛津杯(内径为6 mm)轻轻地、均匀地放置在培养皿上。往每一个牛津杯里加入200 μL乳酸菌无细胞发酵上清液,将此平板正面静置于37 ℃培养48 h,测量抑菌圈大小。
1.3.3 乳酸菌对大肠杆菌生物膜形成的影响
1.3.3.1 微孔板法
(1)乳酸菌发酵上清液对大肠杆菌生物膜形成的影响
参考O’TOOLE等[22]的方法进行。大肠杆菌过夜培养,调节菌浓度为OD=0.1,每孔加入此浓度的大肠杆菌菌悬液150 μL,再加入150 μL乳酸菌发酵上清液,37 ℃培养24 h。弃去孔内的液体,用PBS缓冲液洗涤3次,用甲醇[11]固定15 min,倒掉液体吹干。用结晶紫染色15 min,清除染液后,用去离子水洗涤3次,吹干。加200 μL 95%(体积分数)乙醇,置于摇床缓慢摇摆30 min,酶标仪600 nm。测定吸光度。各实验组每次做5个平行,重复3次。分别用水和甲醇作阴性和阳性对照。
(2)乳酸菌菌体对大肠杆菌生物膜形成的影响
在实验(1)的基础上做了如下改动,每孔加入150 μL浓度为OD=0.01的大肠杆菌菌悬液和150 μL浓度为OD=0.01的乳酸菌菌悬液,37 ℃培养24 h。其他条件同实验(1)。
1.3.3.2 荧光显微镜法
(1)乳酸菌发酵上清液对大肠杆菌生物膜形成的影响
大肠杆菌过夜培养,调节菌浓度为OD=0.1±0.05。 将活化3代的乳酸菌接种到MRS液体培养基中,37 ℃培养20 h,离心取发酵上清液。在直径6 cm的玻璃培养皿中放入18 mm×18 mm规格的无菌盖玻片,加入1 mL大肠杆菌菌悬液和3 mL乳酸菌发酵上清液,37 ℃培养24 h,取出玻璃片,PBS冲洗3次,去除表面浮游细菌,立即于室温避光条件下用荧光染料CFSE和PI分别对活菌和死菌进行染色。30 min后,取出盖玻片,冲洗染液,在荧光显微镜下观察成膜情况[23]。
(2)乳酸菌菌体对大肠杆菌生物膜形成的影响
在实验(1)的基础上做如下改动,培养皿中加入1 mL菌浓度为OD=0.01大肠杆菌菌悬液和3 mL菌浓度为OD=0.01乳酸菌菌悬液。37 ℃培养24 h。其他条件同实验(1)。
1.3.4 菌株的耐酸性测定
将纯化活化后的菌株按体积分数1%接种到MRS液体培养基中,37 ℃下静置培养24 h后,按1% 接种量分别接入pH为2.0、3.0、4.0、5.0、6.0和7.0的MRS液体培养基中,37 ℃厌氧,测定600 nm下的吸光值(OD600),并记录结果[24]。
1.3.5 菌株的耐胆盐性测定
菌株接种于MRS液体培养基中,37 ℃条件下静置培养18 h,再按2%的接种量分别接种于含0、0.1%、 0.2%、0.3%、0.5%(质量分数)牛胆盐的MRS-THIO培养基(MRS培养基中添加质量分数为0.2%巯基乙酸钠),37 ℃静置培养24 h,以未接种的MRS-THIO培养基为对照,分别测定上述不同质量浓度培养基在600 nm下的吸光度,按照公式(1)计算乳酸菌对胆盐的耐受力[25]。

(1)
1.3.6 统计学分析
本研究采用SPSS Statistics 17.0单因素方差对实验结果进行显著性分析(One-Way,ANOVA)。显著性水平设置为0.05,其中P<0.05代表差异显著。采用Excel 2013对数据进行作图和分析。
2 结果与讨论
2.1 乳酸菌对大肠杆菌的抑菌性分析
从不同来源的传统发酵食品中分离出了90株乳酸菌,采用牛津杯琼脂扩散法测定这90株乳酸菌的发酵上清液对大肠杆菌的生长抑制作用。结果显示,大多数乳酸菌对大肠杆菌都有不同程度的抑制作用。牛津杯法测定的抑菌效果是在大肠杆菌非生物膜状态下进行的研究,而相关的研究成果表明[23],乳酸菌的抑菌性与抑制生物膜能力不是呈正相关。因此,为了筛选出对大肠杆菌生物膜具有较强抑制能力的乳酸菌,根据前期研究中的抑菌实验结果,分别从好、中、差3个水平中随机选取10株乳酸菌(即2-1、3-1、15-2、7-1、A-1、7-2、10-1、1-1、11-3、13-1)研究其发酵上清液和菌体对大肠杆菌生物膜形成的抑制情况,这10株乳酸菌的牛津杯法抑菌实验结果如图1所示。
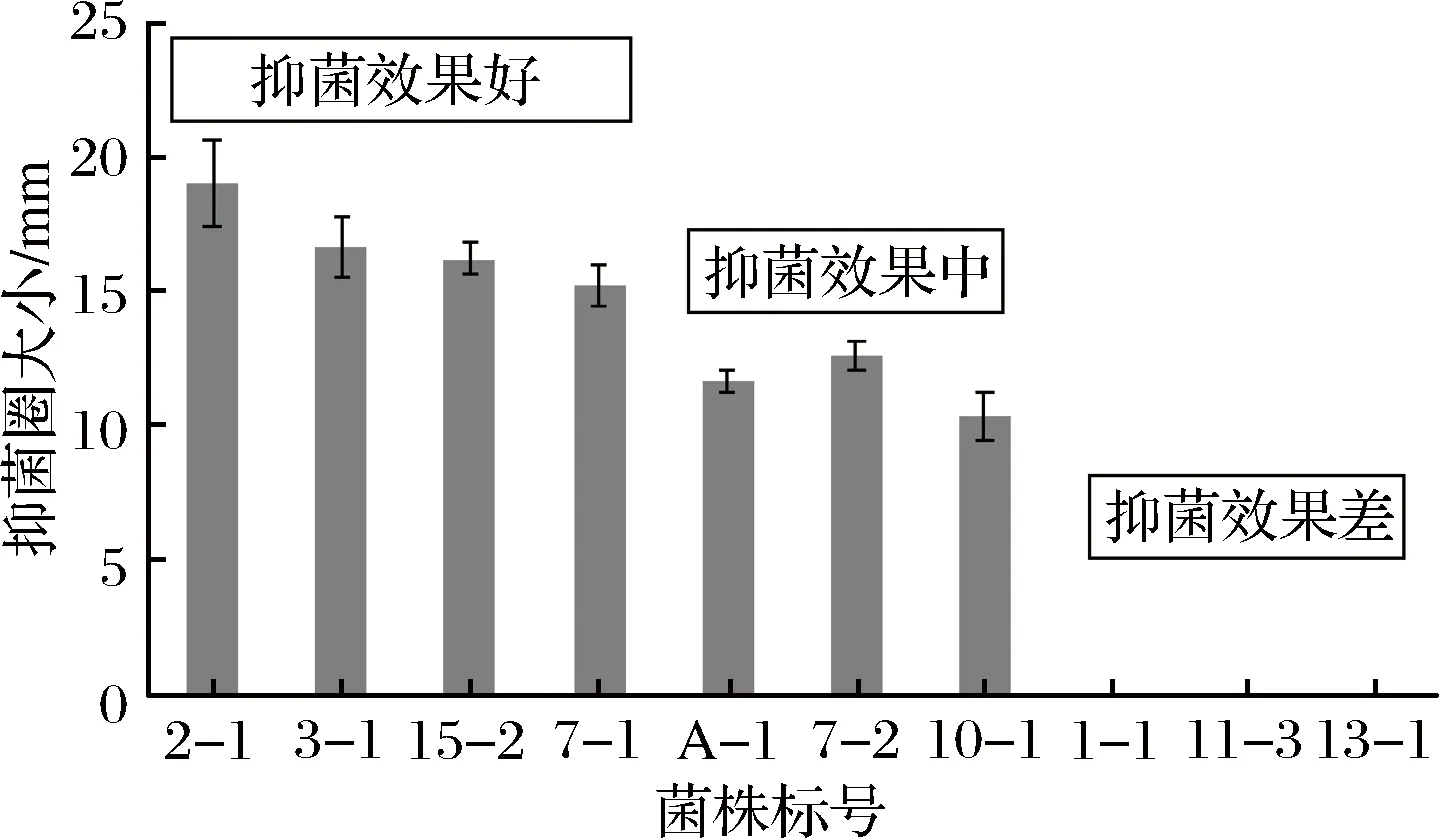
图1 10株乳酸菌的抑制大肠杆菌的效果Fig.1 The inhibited effect of 10 species of LAB on E.coli
2.2 乳酸菌发酵上清液对大肠杆菌生物膜形成量的影响
乳酸菌发酵上清液对生物膜形成量的影响结果见图2。由图2可知,各实验组与对照组(阴性组为无菌水,阳性组为甲醇)均有显著性差异(P<0.05),其中7-1和11-3表现出了非常好的抑制效果,对生物膜的抑制率分别达到84.59%和85.19%,抑制效果其次的是2-1、3-1、7-2、10-1、13-1。同时由图1和图2的比较可知,乳酸菌的抑菌性与其对大肠杆菌生物膜形成的抑制效果之间并不存在规律性。
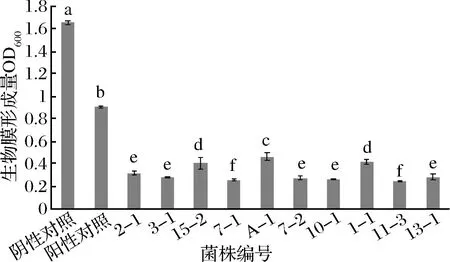
图2 乳酸菌发酵上清液对大肠杆菌生物膜形成量的影响Fig.2 The effect of the culture supernatant of LAB on E.coli biofilm formed quantity
2.3 乳酸菌菌体对大肠杆菌生物膜形成量的影响
乳酸菌菌体对生物膜形成量的影响结果见图3。由图3可知,在3-1、7-1和15-2的作用下,不仅不会抑制大肠杆菌生物膜的形成,反而会促进其生物膜的形成。2-1、7-2、11-3与阴性对照组无显著性差异(P<0.05), 因此无抑制效果。1-1与甲醇的作用效果相当。A-1、10-1、13-1表现出较好的抑制效果,抑制率分别达到65.20%、70.09%和64.59%。
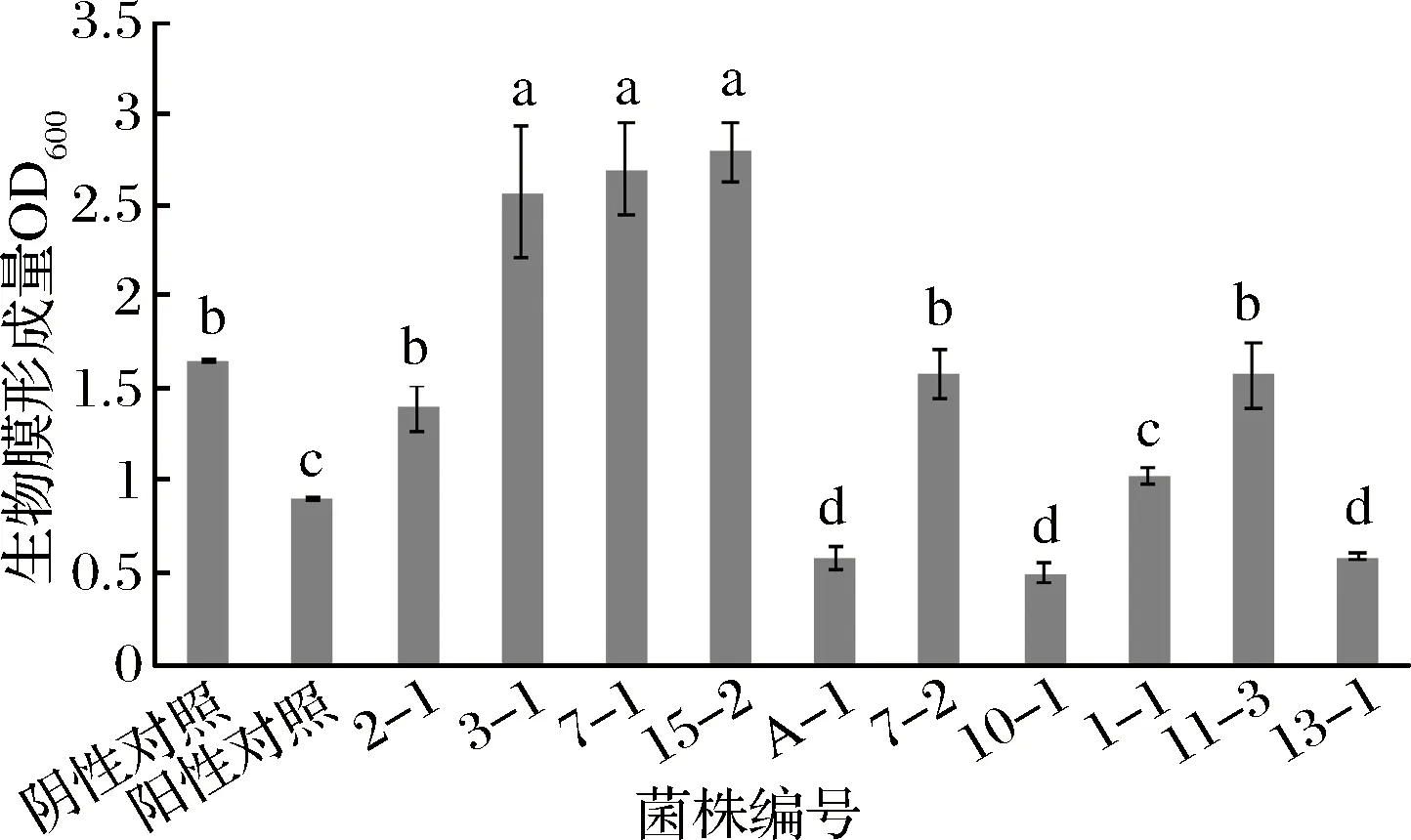
图3 乳酸菌菌体对大肠杆菌生物膜形成量的影响Fig.3 The effect of LAB on E.coli biofilm formed quantity
综合图2和图3的结果可知,乳酸菌发酵上清液和乳酸菌菌体对大肠杆菌生物膜形成的抑制效果差别较大,两者无相关性。乳酸菌发酵上清液对大肠杆菌生物膜的形成均表现出较好的抑制效果,但是乳酸菌菌体的作用效果较为复杂,有的表现出较好的抑制效果,而有的却表现出促进效果。综合来看,10-1、 13-1这2株乳酸菌的发酵上清液和菌体均表现出较好的抑制大肠杆菌生物膜形成的效果。
2.4 荧光显微镜实验
通过聚苯乙烯材质的96平底孔板作为体外生物膜模型对生物膜进行定量是一种传统方法[26]。因此,为了验证实验结果,本实验对乳酸菌发酵上清液实验中抑制效果较好的2株乳酸菌,即7-1和11-3,以及乳酸菌菌体实验中抑制效果较好的3株乳酸菌,即10-1、13-1和A-1,采用荧光显微镜法,观察所形成的生物膜的构造,结果分别如图4和图5所示。
由图4可知,在相同的荧光强度下,未用任何试剂处理的常态生物膜(图4-A和图4-B),活菌占主导地位,菌体成团块蘑菇状紧密地连接在一起,有孔状通道,呈现出典型的生物膜结构。而添加了7-1和11-3的发酵上清液的处理组,即图4-C和图4-D以及图4-E和图4-F,生物膜结构完全遭到破坏,菌体基本上以散点形式分布,细菌总量明显下降,并且死菌占主导地位,这一结果与用96平板测得的生物膜量的结果相同。
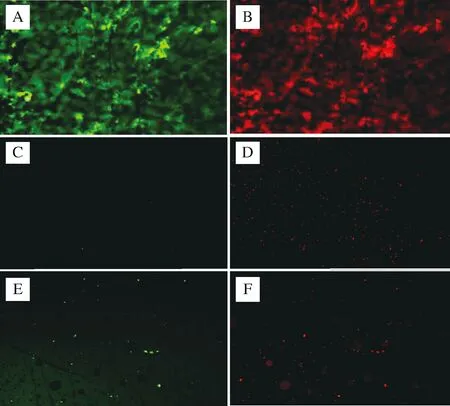
A、B-未添加任何试剂;C、D-添加菌株7-1的发酵上清液;E、F-添加菌株11-3的发酵上清液图4 乳酸菌发酵上清液对大肠杆菌生物膜结构的影响(×200)Fig.4 Effect of the culture supernatant of LAB on E.coli biofilm structure(×200)注:图A、C、E代表活菌,图B、D、F代表死菌。
由图5可知,在相同的荧光强度下,未用任何试剂处理的常态生物膜(图5-A和图5-B),活菌占主导地位,菌体成团块蘑菇状紧密地连接在一起,有孔状通道,具有完整的生物膜结构。而添加了10-1、13-1、A-1菌体的处理组,即图5-C和图5-D、图5-E和图5-F 以及图5-G和图5-H,生物膜结构完全遭到破坏,菌体基本上以散点形式分布,管道结构和团块状结构不复存在,细菌总量明显下降,但是活菌和死菌总量基本相当。与用乳酸菌发酵上清液的处理结果相比较,虽然生物膜结构与前者一样,均完全被破坏,但是细菌总量没有前者减少幅度大,这一结果也与用96平板测得的生物膜量的结果相同。
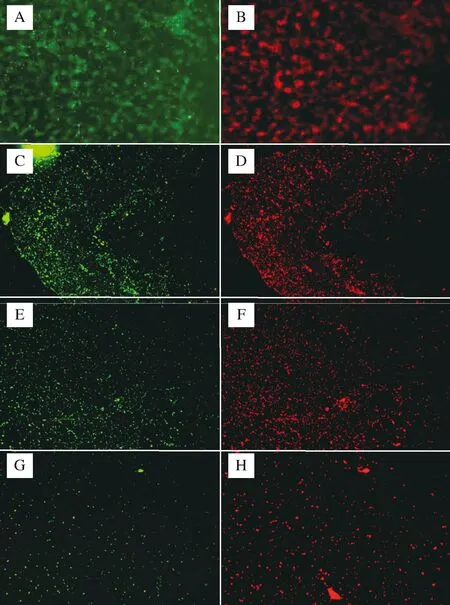
A、B-未添加任何试剂;C、D-添加10-1菌体;E、F-添加13-1菌体;G、H-添加A-1菌体图5 乳酸菌菌体对大肠杆菌生物膜结构的影响(×200)Fig.5 Effect of LAB on E.coli biofilm structure(×200)注:图A、C、E、G代表活菌,图B、D、F、H代表为死菌。
2.5 耐酸性试验结果
由表1可知,当pH>4.0时,各菌株均生长良好。随着pH的降低,各菌株的生长均受到显著抑制。在pH=2.0时,菌株A-1的耐强酸性能最好,OD600可达0.289,与其他菌株有显著性差异(P<0.05),最差的是菌株7-1,其他3个菌株的耐酸性能均在同一水平。在pH=3.0时,菌株A-1的耐酸性能最好,OD600可达0.518,与其他菌株有显著性差异(P<0.05),最差的是菌株10-1,其他3个菌株的耐酸性能均在同一水平。综合以上结果,这5株乳酸菌,耐酸性能最好的是菌株A-1,其次是菌株11-3和13-1。
2.6 耐胆盐试验结果
由表2可知,随着胆盐质量分数的增加,菌株的存活率显著降低。当胆盐质量分数为0.3%和0.5%时,菌株A-1均表现出较强的存活率,存活率分别为60.60%和37.51%,与其他菌株有显著性差异(P<0.05),最差的是菌株7-1,其他3个菌株的耐酸性能均在同一水平。综合以上结果,这5株乳酸菌,耐胆盐性能最好的是菌株A-1,其次是菌株10-1、11-3和13-1。
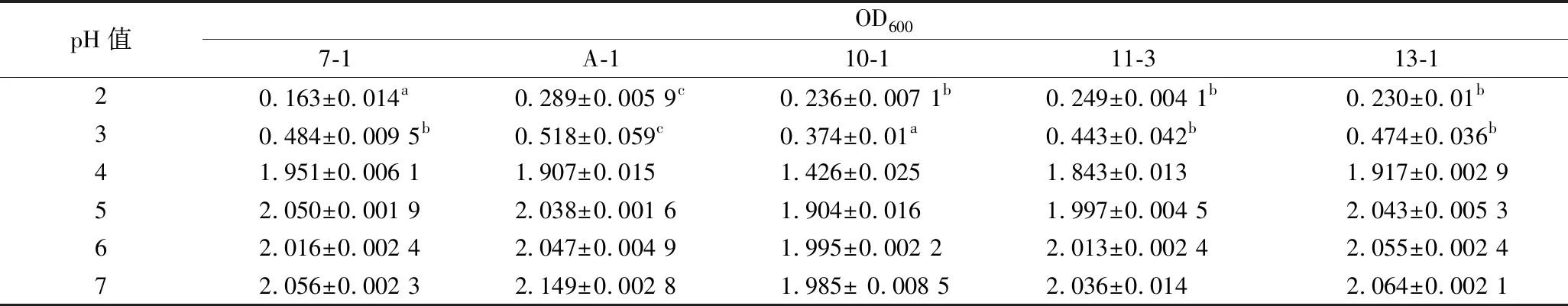
表1 耐酸性实验结果Table 1 Acid proof test result
注:表中不同小写字母代表差异显著,P<0.05。下同。

表2 耐胆盐实验结果Table 2 The results of the test for biliary salt
3 结论
大肠杆菌在人体肠道内属于正常的共生菌,但是如果以生物膜形式大量存在于泌尿系统、消化道、呼吸系统等处,就会造成感染。人体内强调的是一个菌群平衡的概念,虽然大肠杆菌是正常菌群,但是如果在某处以生物膜这种抗逆性强的形式存在,就会对人体有伤害。因此,本文从安徽不同区域采集的传统发酵食品中共分离得到90株乳酸菌,研究其对大肠杆菌的抑制作用。结果表明,大多数乳酸菌对大肠杆菌有抑制作用,但是结果差异较大。而乳酸菌的抑制作用与抑制大肠杆菌生物膜形成能力之间并不存在一定的规律性。从乳酸菌的无细胞发酵上清液和菌体两方面研究其对大肠杆菌生物膜形成的抑制作用,分别筛选出效果较好的不同乳酸菌。两者均可以显著减少生物膜的形成量,完全破坏生物膜的典型结构,使菌体在生物膜中呈零散状分布。但是乳酸菌的无细胞发酵上清液的作用效果要优于乳酸菌菌体,不仅可以显著减少细菌总量,还可以使生物膜活性显著降低。因此,根据实验结果,菌株7-1的无细胞发酵上清液具有潜在的应用价值。人体胃液的pH值为2~3, 人体小肠的胆盐浓度一般为0.03%~0.3%,可以在细胞外产生高渗透压,对菌体细胞造成影响。摄入到体内的乳酸菌,需要经受人体极端的酸性条件和高胆盐环境的考验,才能在人体真正发挥益生作用。在体外有较好益生作用的乳酸菌,必须能够对胃液极端的酸性环境具有耐受性,才能在体内发挥益生作用。根据实验结果,菌株A-1(Lactobacillusacidophilus)具有较好的耐酸耐胆盐性能。在研究乳酸菌菌体对大肠杆菌生物膜形成的影响时,所用到的菌株浓度为OD600=0.01,菌株A-1对大肠杆菌生物膜就表现出较强的抑制作用。经过强酸、强胆盐的处理后,菌株A-1的浓度远远高于体外抑制实验的浓度,故在体内具有应用价值。乳酸菌作为目前使用较多的益生菌,具有巨大的研究价值和广阔的市场前景,是细菌替代疗法的热门研究对象,该结果为今后预防由大肠杆菌引起的感染提供了理论依据。

