基于Spyligase技术的禽流感血凝素H5HA10多聚体抗原的高效制备
贾 宾,陈慧心,韩莹倩,郭玉堃,邵科宇,郭豫杰
(河南农业大学 牧医工程学院/农业部 动物生化与营养重点实验室,河南 郑州 450002)
禽流感病毒(avian influenza virus)属于正粘病毒科,为负链单股RNA病毒,含有8个节段[1]。流感病毒粒子表面有两种蛋白,分别为血凝素(Hemagglutinin, HA)和神经氨酸酶(Neuramindase, NA)。血凝素是流感病毒囊膜纤突的主要成分,为一种糖蛋白,在病毒吸附及穿膜的过程中起关键作用;由于HA具有较高的变异率,因此它是引发流感病毒发生抗原变异的主要因素[2]。目前禽流感免疫主要通过传统的灭活单价苗、多联苗或者类毒素疫苗而实现,这些传统疫苗虽然能够诱导动物产生一定的保护性抗体,但是它们存在安全性不高、稳定性差、免疫后副作用大等缺点[3-4]。基因工程亚单位多价疫苗含有产生保护性免疫应答所必需的有效免疫成分,同时去除了与免疫无关的成分,因而相对于传统疫苗而言其安全性、稳定性更好,而且消除了传统疫苗成分中热原、变应原等反应原,很好地解决了传统疫苗免疫后动物出现的副作用与炎性刺激问题[5]。因此,开发一种能够预防禽流感的基因工程亚单位疫苗成为禽流感病防控技术中迫切需要解决的问题[6]。
CnaB2是酿脓链球菌纤维联接蛋白黏附蛋白FbaB的一个结构域,是细菌侵入人体的必需结构[7]。Mark Howarth研究团队从CnaB2中分离了N-末端带有Lys31、C-末端带有Asp117的能够进行自发共价结合的 SpyTag/SpyCatcher,该反应可以在短时间内自发进行[8-10]。基于此开发了一种新的蛋白质连接技术——Spyligase技术。基于全新的Spyligase蛋白质连接技术, Liu等开发出一种用于人造疫苗的合成新方法,该方法简单易行,在对蛋白进行最小化修饰下,抗原蛋白可以形成环化单体、二聚体甚至多聚体,研究表明多聚体的形成可以增强疫苗的免疫效果[11]。目前在大肠杆菌系统表达HA蛋白方面的报道并不少,但是将环化技术应用到HA蛋白的报道还没有。本研究利用Spyligase技术对禽流感H5亚型HA蛋白进行了改造,并利用DNA重组技术在目的基因序列的两端分别加上SpyTag和KTag序列,成功构建了含9种促溶标签的Spy-H5HA10重组蛋白表达载体和Spyligase重组蛋白表达载体;经用IPTG诱导表达,纯化目的蛋白,体外环化验证,在PCT缓冲液中成功获得了Spy-H5HA10重组蛋白的多聚体混合物。本实验验证了Spyligase技术在体外可以指导H5HA10蛋白形成多聚体,这为后续将H5HA10多聚体抗原应用于基因工程疫苗的研究奠定了理论基础。
1 材料与方法
1.1 实验材料
大肠杆菌E.coliBL21(DE3)感受态细胞、表达载体pET-21b均由本实验室提供;带有不同融合标签的10种质粒pEX-His6-ArsC-TEV-LIC、pEX-His6-Cherry-TEV-LIC、pEX-His6-PAS200-TEV-LIC、pEX-His6-XTEN-TEV-LIC、pEX-His6-PEAT-TEV-LIC、pEX-SiTag3-SUMO-TEV-LIC、pEX-SiTag3-MBP-TEV-LIC、pEX-SiTag3-PAS200-TEV-LIC、pEX-SiTag3-XTEN-TEV-LIC和pEX-SiTag3-ArsC-TEV-LIC为本实验室前期构建并保存;限制性内切酶BamH I、Xho I、Nde I和T4 DNA连接酶(TaKaRa);DNA分子质量标准DL2000、DL5000(TaKaRa); Agarose(GENVIEN公司);考马斯亮蓝R-250、吐温、异丙基硫代-β-D-半乳糖苷(Isopropylthio-β-D-galactoside, IPTG) (北京鼎国昌盛生物技术公司); Ni-NTA Agarose (Qiagen)购自天驰生物科技有限公司; SanPrep柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒(上海生工);柠檬酸、氧化三甲胺(TMAO)(Sigma)。
1.2 Spy-H5HA10基因的设计与合成
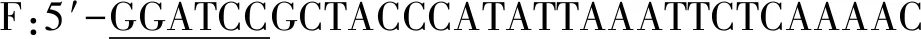
1.3 高效可溶性融合表达载体的构建
将本实验室保存的含有不同促溶标签的质粒pEX-His6-ArsC-TEV-LIC、pEX-His6-PAS200-TEV-LIC、pEX-His6-XTEN-TEV-LIC、pEX-His6-PEAT-TEV-LIC、pEX-SiTag3-SUMO-TEV-LIC、pEX-SiTag3-MBP-TEV-LIC、pEX-SiTag3-PAS200-TEV-LIC、pEX-SiTag3-XTEN-TEV-LIC和pEX-SiTag3-ArsC-TEV-LIC分别用BamH I和Xho I进行双酶切,经1.0%琼脂糖凝胶电泳,用柱式DNA胶回收试剂盒回收,产物于-20 ℃保存。目的基因Spy-H5HA10经PCR扩增,1.0%琼脂糖凝胶电泳分离,用柱式DNA胶回收试剂盒切胶回收,与pMD19-T载体连接,连接产物转化感受态大肠杆菌DH5a,涂布于Amp(100 mg/mL)固体培养基,挑取单克隆进行菌液PCR鉴定并送测序;鉴定成功后提取质粒用限制性内切酶Xho I和BamH I酶切,酶切产物分别与上述回收的9种载体片段连接,于16 ℃过夜,转化感受态大肠杆菌BL21(DE3),挑取阳性克隆测序,将测序正确的9种Spy-H5HA10重组载体保存菌种。目的基因Spyligase和pEX-His6-Cherry-TEV-LIC载体分别经BamH I和Xho I双酶切,琼脂糖凝胶电泳回收目的片段,T4 DNA连接酶连接,构建新的重组载体pEX-His6-Cherry-TEV-Spyligase,测序正确后保存菌种。目的基因在载体中的连接顺序如图1所示。
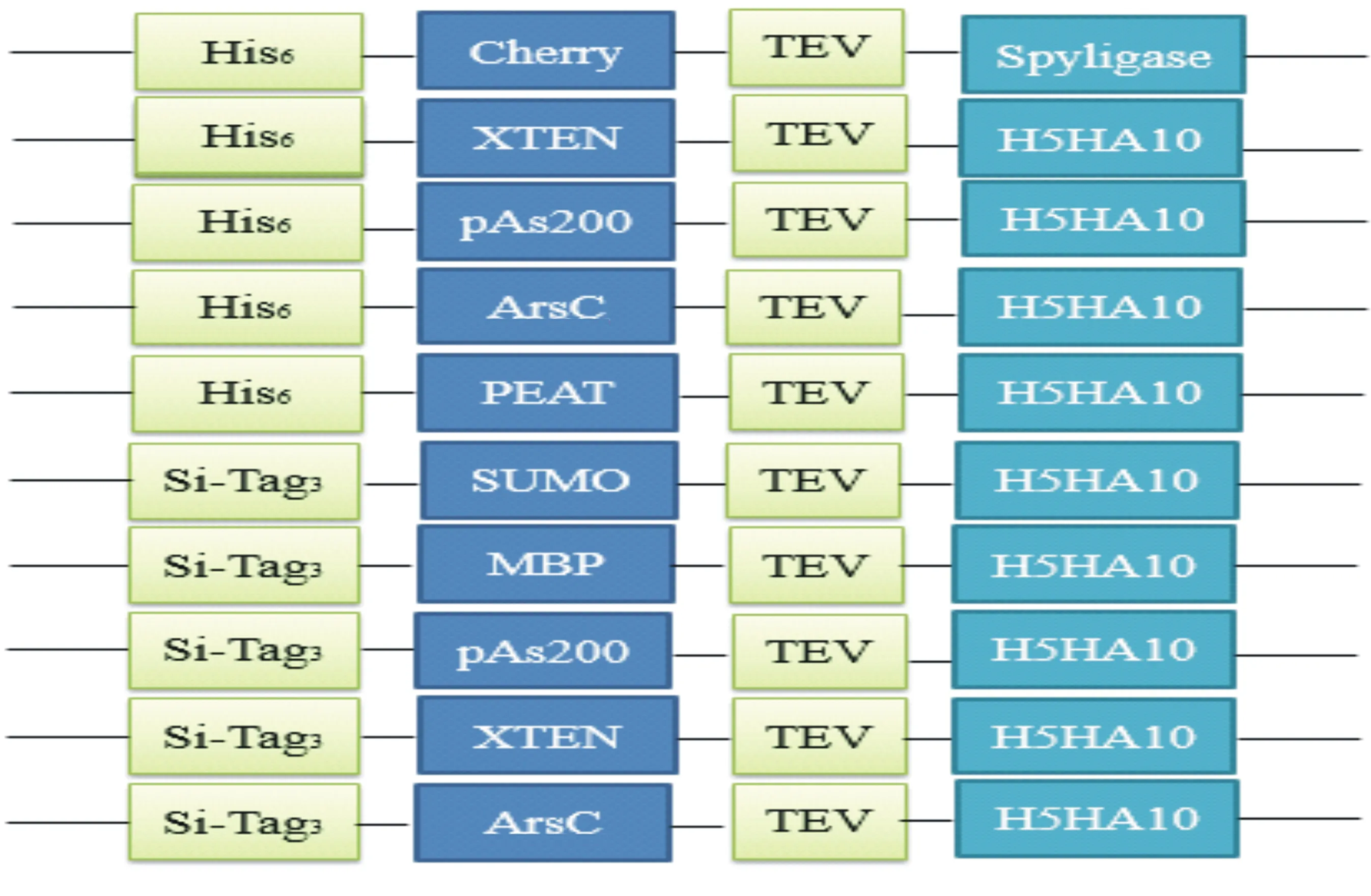
图1 目的基因在重组表达载体中的连接顺序
1.4 蛋白表达与可溶性分析
将含9种Spy-H5HA10重组载体和pEX-His6-Cherry-TEV-Spyligase重组载体的E.coliBL21甘油菌活化后诱导表达,并对IPTG的浓度(0.2、0.5、0.8 mmol/L)及诱导温度(18、25 ℃)进行优化。诱导结束后于4 ℃、9000 r/min离心30 min,分别收集上清和沉淀,经SDS-PAGE凝胶电泳,检测重组蛋白的表达。使用ImageJ进行灰度扫描,分析重组蛋白的可溶性表达水平,筛选出最佳诱导条件。
1.5 蛋白的纯化
将阳性菌液接种至1L LB(Amp 100 mg/mL)液体培养基中,扩大培养,当OD600为0.6~0.8时,加入IPTG,在25 ℃下诱导表达12 h后,于4 ℃、8000 r/min离心10 min,收集菌体,用平衡缓冲液(1 mol/L NaCl、50 mmol/L NaH2PO4、5 mmol/L咪唑)重悬沉淀,低温超声破碎菌体;将破碎后的混合液在4 ℃下以12000 r/min离心30 min,收集上清,加到预处理的Ni-NTA填料中,低温结合1 h,分别用洗杂缓冲液(1 mol/L NaCl、50 mmol/L NaH2PO4、5/10/15/20/25/50/75/100/250/300 mmol/L咪唑)洗脱杂蛋白,筛选洗杂缓冲液后,加大洗脱体积,最后用洗脱缓冲液(1 mol/L NaCl、50 mmol/L NaH2PO4、500 mmol/L咪唑)洗脱,收集洗脱的融合蛋白,用超滤管和脱盐柱脱盐浓缩,再用BCA蛋白定量试剂盒定量,于-80 ℃保存。
1.6 Spy-H5HA10多聚体的形成
将脱盐处理后定量的蛋白按照1∶3到3∶1之间的比例设置浓度梯度进行加样处理,如表1所示,在4 ℃ PCT缓冲液[12]中反应,每6 h取样1次,于99 ℃变性10 min,经SDS-PAGE分析,确定最佳反应条件。
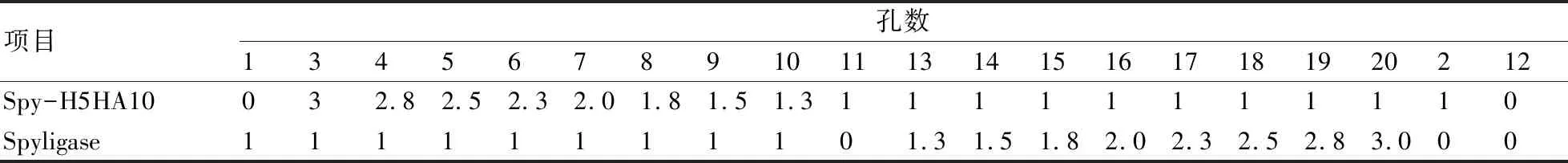
表1 Spyligase与H5HA10反应的比例
注:1、2、11、12孔为对照组。
2 结果与分析
2.1 载体的酶切
经BamH I和Xho I双酶切,获得含有9种促溶标签的线性载体,电泳显示目的片段大小与预期一致(图2A); pET21b-His6-Cherry载体由BamH I和Xho I双酶切线性化,电泳显示获得了含有His6-Cherry可溶性标签的片段,大小与预期相符(图2B)。

M: DL 5000 DNA分子质量标准;1~9: pET21b-His-ArsC、pET21b-His-PAS200、pET21b-His-XTEN、pET21b-His-PEAT、pET21b-SiTag3-SUMO、pET21b-SiTag3-MBP、pET21b-SiTag3-PAS200、pET21b-SiTag3-XTEN和pET21b-SiTag3-ArsC;11~13: pET21b-His6-Cherry。
图2载体的酶切结果
2.2 目的基因Spy-H5HA10和Spyligase的获得
测序正确的pMD19-T-Spy-H5HA10重组质粒通过BamH I和Xho I双酶切获得目的基因Spy-H5HA10,其片段大小为534 bp,琼脂糖凝胶电泳检测显示与预期大小一致(图3A);含有Spyligase序列的重组质粒,经BamH I和Xho I双酶切得到Spyligase基因片段,该片段大小为333 bp,琼脂糖凝胶电泳检测显示与预期大小一致(图3B)。
M: DL 5000 DNA分子质量标准;1~8: Spy-H5HA10经BamH I和Xho I双酶切获得目的基因片段;9~11: Spyligase经BamH I和Xho I双酶切获得目的基因片段。
图3BamHI和XhoI双酶切获得的目的片段
2.3 重组质粒的鉴定
将9种含有目的基因Spy-H5HA10的重组质粒经Xho I 和Nde I双酶切,片段大小分别为1176、1176、966、1434、1191、1434、1713、1089、1089 bp,琼脂糖凝胶电泳结果显示与预期片段大小相符(图4A);同时测序结果显示9种重组质粒序列无碱基突变,重组质粒构建成功。含有Spyligase目的基因的融合标签重组质粒经Xho I 和Nde I双酶切,电泳显示在630 bp处有与预期片段大小相符的条带(图4B),测序结果显示重组质粒pET21b-His6-Cherry-Spyligase构建成功。

1~9: pET21b-His-PAS200-H5HA10、pET21b-SiTag3-PAS200-H5HA10、pET21b-SiTag3-SUMO-H5HA10、pET21b-SiTag3-XTEN-H5HA10、pET21b-His-PEAT-H5HA10、pET21b-His-XTEN-H5HA10、pET21b-SiTag3-MBP-H5HA10、pET21b-His-ArsC-H5HA10、pET21b-SiTag3-AesC-H5HA10;10~12: pET21b-His6-Cherry-Spyligase。
图49种重组质粒NdeI和XhoI双酶切鉴定结果
2.4 含有目的基因Spy-H5HA10的9种重组蛋白的可溶性分析
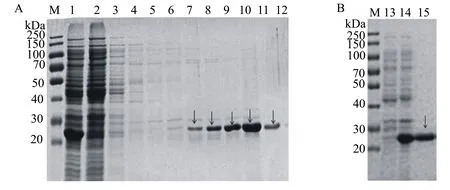
SDS-PAGE凝胶电泳检测显示, pET21b-His-PAS200-H5HA10和pET21b-SiTag3-PAS200-H5HA10(图5A、图5B)条带大小与预期不符;其余7种融合标签重组载体的电泳结果显示在35.42、52.58、43.67、52.58、62.81、39.93、39.93 kDa处有与预期大小相一致的条带(图5C、图5D、图5E、图5F、图5G、图5H、图5I)。ImageJ软件分析表明, pET21b-His-ArsC-H5HA10(图5H )、pET21b-SiTag3-ArsC-H5HA10(图5I)目的蛋白的表达量均高于其他组的,约占菌体总蛋白的30%,且蛋白大部分在上清中,可溶性在90%以上,His-Tag的纯化更为简单,故选择pET21b-His-ArsC-H5HA10做后续研究。
2.5 His-ArsC-H5HA10融合蛋白诱导表达条件的优化
经0.2 mmol/L和0.5 mmol/L终浓度的IPTG诱导后,目的蛋白的表达量相对较高,表达量达30%,但是0.2 mmol/L IPTG诱导时蛋白可溶性为80%,0.5 mmol/L IPTG诱导时蛋白可溶性可达90%以上,终浓度0.8 mmol/L IPTG诱导时效果相对较差,目的蛋白的可溶性降低(图6A); His-ArsC-H5HA10经18 ℃和25 ℃两个温度诱导后,25 ℃下的蛋白表达量较18 ℃有所提高,且可溶性表达水平也高于18 ℃下的,蛋白可溶性水平达90%以上,因此 25 ℃为最佳诱导温度(图6B)。
M:蛋白质相对分子质量标准; A: pET21b-His6-PAS200-H5HA10; B: pET21b- SiTag3-PAS200-H5HA10; C: pET21b-SiTag3-SUMO-H5HA10; D: pET21b-SiTag3-XTEN-H5HA10; E: pET21b-His-PEAT-H5HA10; F: pET21b-His-XTEN-H5HA10; G: pET21b-SiTag3-MBP-H5HA10; H: pET21b-His-ArsC-H5HA10; I: pET21b-SiTag3-ArsC-H5HA10 ;1:未诱导全菌;2:诱导后全菌;3:诱导后超声破碎的上清;4:诱导后超声破碎的沉淀。
图5Spy-H5HA10重组蛋白的SDS-PAGE分析结果
M:蛋白质相对分子质量标准;1:未诱导的全菌;2:0.2 mmol/L IPTG诱导后的全菌;3:0.5 mmol/L IPTG诱导后的全菌;4:0.8 mmol/L IPTG诱导后的全菌;5:0.2 mmol/L IPTG诱导后的上清;6:0.5 mmol/L IPTG诱导后的上清;7:0.8 mmol/L IPTG诱导后的上清;8:0.2 mmol/L IPTG诱导后的沉淀;9:0.5 mmol/L IPTG诱导后的沉淀;10:0.8 mmol/L IPTG诱导后的沉淀;11:未诱导的全菌;12:25 ℃诱导后的全菌;13:25 ℃诱导后的上清;14:18 ℃诱导后的全菌;15:18 ℃诱导后的上清;16:25 ℃诱导后的沉淀;17:18 ℃诱导后的沉淀。
图6His-ArsC-H5HA10融合蛋白诱导表达条件的优化结果
2.6 Spyligase重组蛋白的可溶性分析
重组质粒pEX-His6-Cherry-TEV-Spyligase转化大肠杆菌BL21(DE3),经IPTG诱导表达、超声破碎后取上清和沉淀,用SDS-PAGE凝胶电泳检测。结果显示在26 kDa处有与预期大小相符的目的条带(图7)。ImageJ软件分析数据表明, Spyligase重组蛋白的可溶性约为95%。
M:蛋白质相对分子质量标准;1:未诱导的全菌;2:诱导后的全菌;3:诱导后的上清;4:诱导后的沉淀。
图7Spyligase重组蛋白SDS-PAGE分析结果
2.7 Spyligase重组蛋白诱导表达条件的优化
用终浓度分别为0.2、0.5和0.8 mmol/L的IPTG进行诱导,再经SDS-PAGE电泳, ImageJ软件分析显示:0.2 mmol/L和0.5 mmol/L IPTG诱导时蛋白表达量均高于0.8 mmol/L IPTG诱导时的,但是0.5 mmol/L IPTG诱导时蛋白的可溶性表达水平不及0.2 mmol/L IPTG诱导时的;0.8 mmol/L IPTG的诱导效果最差(图8A)。在18 ℃和25 ℃下分别诱导,经SDS-PAGE电泳, ImageJ软件分析显示,诱导温度为25 ℃时重组蛋白的表达量和可溶性水平均高于18 ℃的,可溶性达95%(图8B)。
2.8 重组蛋白His-ArsC-H5HA10的纯化
用平衡缓冲液重悬菌体,超声破碎后分别用含10、20、30、50、75、100、250、500 mmol/L咪唑的缓冲液洗脱,SDS-PAGE电泳分析显示目的蛋白可以通过镍柱进行亲和纯化,用30 mmol/L的咪唑缓冲液洗脱杂蛋白的效果最佳(图9A)。目的蛋白与镍柱结合后,用10、20、30、500 mmol/L咪唑的缓冲液梯度洗脱,收集目的蛋白,经脱盐处理后得到了高纯度的重组蛋白(图9B)。
M:蛋白质相对分子质量标准;1:未诱导的全菌;2:0.2 mmol/L IPTG诱导后的全菌;3:0.5 mmol/L IPTG诱导后的全菌;4:0.8 mmol/L IPTG诱导后的全菌;5:0.2 mmol/L IPTG诱导后的上清;6:0.5 mmol/L IPTG诱导后的上清;7:0.8 mmol/L IPTG诱导后的上清;8:0.2 mmol/L IPTG诱导后的沉淀;9:0.5 mmol/L IPTG诱导后的沉淀;10:0.8 mmol/L IPTG诱导后的沉淀;11:未诱导的全菌;12:25 ℃诱导后的全菌;13:25 ℃诱导后的上清;14:18 ℃诱导后的全菌;15:18 ℃诱导后的上清;16:25 ℃诱导后的沉淀;17:18 ℃诱导后的沉淀。
图8Spyligase重组蛋白诱导表达条件的优化结果

M:蛋白质相对分子质量标准;1:破碎后上清;2~12:分别含10、20、30、40、50、75、100、200、250、300、500 mmol/L咪唑的洗涤缓冲液;13:未诱导的全菌;14:诱导后的上清;15:纯化的His-ArsC-H5HA10重组蛋白。
图9His-ArsC-H5HA10融合蛋白纯化条件优化结果
2.9 重组蛋白His-Cherry-Spyligase的纯化
操作方法与2.7.1一致,图10A结果显示用含50 mmol/L咪唑的缓冲液洗脱杂蛋白的效果最佳。目的蛋白与镍柱结合后,经10、20、30、50、500 mmol/L咪唑的缓冲液洗脱,收集目的蛋白,经脱盐处理后得到了高纯度的His-Cherry-Spyligase重组蛋白(图10B)。
2.10 Spyligase和Spy-H5HA10反应的最佳比例
将已纯化的重组蛋白Spyligase和His-ArsC- Spy-H5HA10按照表1分别加入到PCT缓冲溶液中,于4 ℃下反应48 h。SDS-PAGE分析显示:在Spyligase量一定的条件下,多聚体的形成量与底物Spy-H5HA10的单体浓度呈正相关(图11B);当Spy-H5HA10的量一定时,多聚体的形成量随着Spyligase浓度的增高而升高,但是当Spy-H5HA10和Spyligase的比例达到1∶2时,再升高Spyligase的量对形成多聚体无明显影响(图11A),因此最终确定Spy-H5HA10和Spyligase反应的最佳比例为1∶2。
M:蛋白质相对分子质量标准;1:破碎后的上清;2~12:分别含10、20、30、40、50、75、100、200、250、300、500 mmol/L咪唑的洗涤缓冲液;13:未诱导的全菌;14:诱导后的上清;15:纯化的His-Cherry-Spyligase重组蛋白。
图10His-Cherry-Spyligase融合蛋白纯化条件优化结果
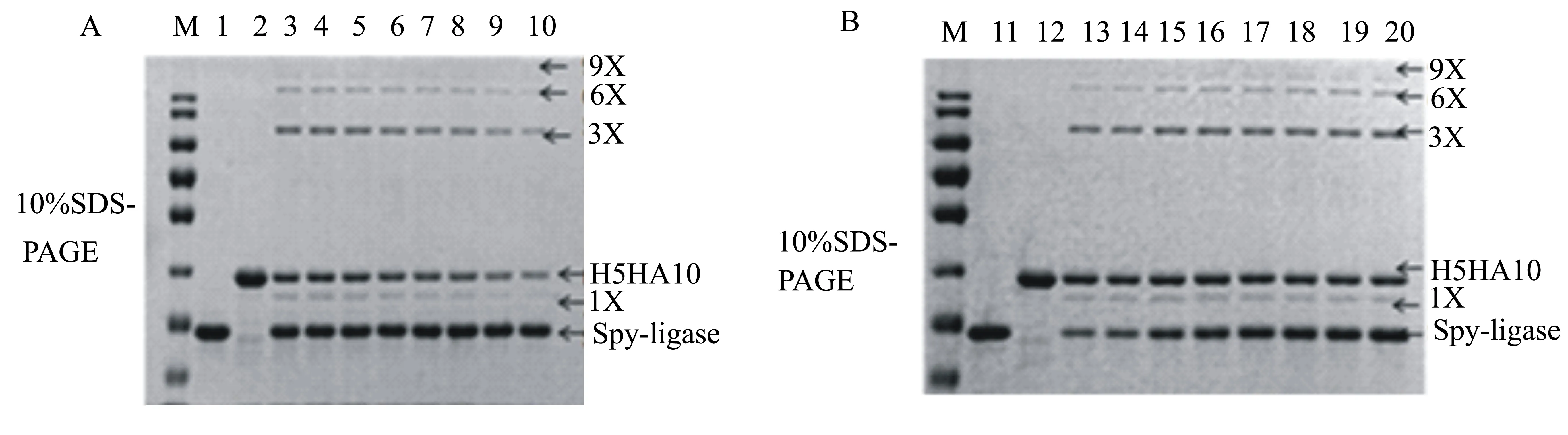
M:蛋白质相对分子质量标准;1~20:与表1中的样孔号对应。
M:蛋白相对分子质量标准;1: Spyligase 融合蛋白;2: Spy-H5HA10融合蛋白;3: Spyligase与Spy-H5HA10以1∶1混合;4:环化6 h;5:环化12 h;6:环化18 h;7:环化24 h;8:环化30 h;9:环化36 h;10:环化42 h;11:环化48 h;12:环化54 h;13:环化60 h;14:环化66 h。
图12Spyligase和Spy-H5HA10反应时间优化结果
2.11 反应时间的优化
将Spy-H5HA10和Spyligase以1∶2混合进行反应,每6 h取样1次,分析反应时间与环化形成量的关系。SDS-PAGE凝胶电泳分析结果(图12)表明:在反应6 h时已发生环化,出现了环化单体和三聚体,且随着反应时间的延长,环化单体和三聚体的数量逐渐增加;在18 h时,开始出现六聚体,随着反应时间的延长,六聚体的数量逐渐增加;在24 h时,开始出现九聚体,继续延长反应时间,环化单体及多聚体的数量都有所增加;在反应30~66 h期间,环化单体、三聚体、六聚体以及九聚体的形成量均无明显增加。
3 讨论
禽流感是由A类病毒引起的一类对养禽业造成严重危害的高度传染性疾病,也是一种人兽共患传染病[13]。目前对于禽流感的防治以灭活苗、弱毒苗或抗原蛋白亚单位疫苗为主,但是这些疫苗免疫保护性水平往往较低。有学者应用Spyligase技术在体外环化生成环化单体、多聚体,增大蛋白分子量,提高蛋白的稳定性,获得了较好的免疫效果[11-12〗。Spyligase技术源于SpyTag/SpyCatcher的连接反应,由SpyTag、KTag和链接酶Spyligase组成[11],可用于蛋白质分子的连接。KTag设计来源于SpyCatcher,在Spyligase的作用下可以与SpyTag形成共价键;Spyligase也来源于SpyCatcher,经人工改造后合成[11]。本实验在大肠杆菌原核表达系统中表达了Spy-H5HA10和Spyligase重组蛋白,原核表达系统生产成本低,操作简单易行[15]。有文献报道在蛋白表达中可以通过促溶标签提高蛋白的可溶性[16]。本研究应用SiTag3[17]、XTEN[18]、MBP[19]、Cherry[21]、SUMO、PAS200等10种促溶标签与目的蛋白进行融合表达,从中筛选出了高可溶性的His6-ArsC-H5HA10重组蛋白。PAS200标签与蛋白的串联结构在表达后, SDS-PAGE电泳显示其融合蛋白偏大,究其原因,可能是由于本实验所用的PAS200标签所含氨基酸序列具有特殊性,使结合的SDS所带负电荷不能完全掩盖蛋白本身所带电荷,导致电泳时迁移变慢。在表达Spyligase蛋白时,本研究在其基因序列前插入了Cherry标签,目的蛋白的表达可以通过观察菌体呈现的颜色进行鉴别,当菌体颜色为红色时说明目的蛋白获得了表达,使检测更为简单方便。低温诱导可以增加目的蛋白的可溶性,故我们在诱导表达中设置了25 ℃和18 ℃两个温度,分析发现25 ℃时重组蛋白的表达量更高,分析原因可能是在18 ℃低温条件下细胞增殖缓慢。虽然18 ℃低温可以促进蛋白正确折叠,提高可溶性,但是目的蛋白的总表达量降低了,故后续实验选择25 ℃进行。实验中用的IPTG终浓度为0.5 mmol/L,考虑到IPTG可能存在的副作用,在实验中分别设计了高剂量组0.8 mmol/L和低剂量组0.2 mmol/L,发现在不同浓度处理间诱导效果存在差异,高剂量的IPTG组蛋白表达量降低,0.2 mmol/L和0.5 mmol/L间差异不大,可能是由于IPTG本身具有一定毒性,不易被细菌代谢[22],而高剂量IPTG会抑制细胞增殖,使蛋白表达量降低,最终His6-ArsC-H5HA10融合蛋白采用 0.5 mmol/L IPTG进行诱导表达。His6-Cherry-Spyligase融合蛋白经0.2 mmol/L IPTG诱导表达,且目的蛋白主要在上清中,两种蛋白均为可溶性表达。在目的蛋白序列中前引入了His6标签[23],目的是方便利用Ni-NTA纯化技术[24], 最终通过亲和纯化得到目的蛋白。在PCT缓冲液中, Spyligase和Spy-H5HA10充分反应,通过SDS-PAGE电泳检测其环化形成了环化单体、三聚体、六聚体以及九聚体,形成的多聚体均为单体分子量的3倍。本研究构建的Spyligase和Spy-H5HA10原核表达载体,通过促溶标签均提高了目的蛋白的可溶性表达水平,避免了包涵体的变性和复性处理,添加了His6标签,便于后期重组蛋白的分离纯化。本实验进一步验证了Spyligase环化技术在H5HA10蛋白的可用性,在体外环境下合成了H5HA10蛋白环化单体、三聚体、六聚体以及九聚体等,为后续多聚体抗原应用于禽流感基因工程疫苗的研发奠定了基础。
——一道江苏高考题的奥秘解读和拓展

