眼点拟微绿球藻养殖过程中致死细菌的分离鉴定与治理
赵鄢鹏,蔡忠贞,王 冰,耿金峰,白雪梅
(新奥集团 新绎健康科技有限公司,河北 廊坊 065001)
藻类是海洋系统中最初级的、最重要的生产者。其种类繁多,它合成的物质量约占全部光合作用合成生物量的1/3。藻类是具有极大应用价值的生物资源,富含对人体有益的、具有重要生理作用和保健功能的长链多不饱和脂肪酸,可用于天然食品、生物肥料、生物饵料等方面,具有重要的社会价值和经济价值[1-3]。
目前国内外很多高校和科研机构都在对微藻进行着深入的、系统的研究[4]。在养殖条件稳定的情况下,微藻的产量较高,例如: Zhang等在日本的北方地区,夏季利用1.5 cm板式反应器培养集胞藻,在试验控温的情况下单位面积产量可达39.0 g/(m2·d)[5];据Moheimani等报道,颗石藻养殖的产量水平达16.0~33.5 g/(m2·d)[6]。但微藻企业在实际户外养殖中的产量均不高,一般在5~10 g/(m2·d)。究其原因,除了受自然天气、环境温度的影响外,还有一个非常重要的原因是敌害生物污染问题。微藻养殖过程如果受到严重的敌害生物污染,那么可能会出现养殖颗粒无收的严重后果[7]。因此,在微藻养殖过程中敌害生物污染严重制约着微藻产量的提升,以及规模化的进程。国内外的科学家对污染的关注度也是越来越高,微藻养殖过程的污染按照物种不同可分为原生动物污染和细菌污染,其中对原生动物污染目前研究成果显著,例如丛立晶等利用酸化法、碱化法等对藻液中的纤毛虫、游捕虫进行治理[8];吴松使用表面活性剂、漂白粉对原生动物进行灭杀[9];规模化养殖上常用的方法还有碳酸铵盐法等[7,10]。微藻敌害生物污染的另一类是细菌污染,其细菌种类繁多,而细菌和微藻是一个共生体[11-14],有些细菌对微藻生长有促进作用,而有些细菌对微藻生长有抑制作用[15-17],甚至有些细菌具有溶藻的特性[18-20],可以导致藻细胞较快死亡,严重时将导致养殖失败。例如朱晓漫等筛选到一种可以溶解铜绿微囊藻的细菌,经分子鉴定为蜡状芽孢杆菌,后续可以将其开发成生物控藻菌剂[19];郗建云等对张俊筛选到的海杆菌属细菌的溶藻特性进行了研究,该细菌对锥状斯氏藻有显著的溶藻作用,但对蛋白核小球藻与四尾栅藻无溶藻作用[20]。针对目前产业化藻株之一的眼点拟微绿球藻,其细菌污染治理方面的报道很少,尤其是在致死细菌的分离鉴定方面未见报道。但眼点拟微绿球藻的细菌污染问题同样是制约其稳定养殖、产量提高、规模化进程的一个关键因素。因此,我们以本公司户外养殖过程中出现的由于细菌污染而快速死亡的眼点拟微绿球藻藻液为研究对象,通过平板划线法和高通量筛选技术分离了导致藻细胞死亡的细菌,通过16S rDNA全长序列扩增及测序等技术鉴定了致死细菌的属、种,并研究了该致死细菌的有效杀灭方法,旨在为眼点拟微绿球藻的户外稳定养殖提供有效的细菌污染治理方法,促进微藻规模化养殖进程。
1 材料与方法
1.1 材料
硫酸庆大霉素(以下简称为庆大霉素),购自烟台只楚药业有限公司,为1 kg独立包装,规格为10亿/桶。将庆大霉素配制成1 g/L的母液后,根据需要进行稀释(母液经0.22 μm滤膜除菌,稀释操作全过程在无菌条件下进行)。本研究所用的其它试剂均为常规分析纯试剂。EXTaq酶、dNTP、MiniBEST Bacteria Genomic DNA Extraction kit购自TaKaRa公司;序列由Sangon公司测定;引物由Sangon公司合成。
1.2 主要仪器
分光光度计,日本岛津UV-2550型。高通量筛选平台,上海定制HYG-CTCYQ。PCR仪, BIO-RAD T100Thermal cycler, USA。
1.3 藻种与培养
眼点拟微绿球藻(Nannochloropsisoculata),由ENN生物质能源技术中心藻种质库提供。所有实验培养基均采用f/2海水培养基[8],盐度为(3.3±0.1)%。实验采用批次培养的方式进行。
细菌污染的藻液,简称污染藻液(下同):来自眼点拟微绿球藻的户外培养过程,细菌数量在106个/mL数量级以上。
1.4 实验方法
1.4.1 接种密度 利用藻液进行的各实验组的接种细胞密度在0.8~0.9 g/L之间,主要以各实验组相同体积下具有相同的生物质量为原则。
1.4.2 实验用反应器规格 为内径5 cm、高度80 cm的玻璃柱式(管式)反应器,一侧密封,另一侧开口。
1.4.3 致死细菌的分离和培养
1.4.3.1 细菌单菌落的分离和二次培养 将在户外养殖过程中存在细菌污染的藻细胞液稀释10倍,利用平板涂布法进行细菌单菌落的分离;对所得到的单菌落进行二次培养,最终获得多株单菌落的细菌细胞。
1.4.3.2 单菌落细菌的液体培养 利用高通量筛选平台,将单菌落细胞加入到5 mL的24孔板中(高通量筛选平台专用),在31 ℃下以140 r/min的转速培养24 h。
1.4.3.3 致死细菌的确定 利用高通量筛选平台,将活化后的细菌液5 mL加入到装有30 mL藻液的100 mL三角瓶中,在25 ℃下以140 r/min培养,加30 μE的人工光源,根据藻细胞的死亡情况最终确定致死细菌编号。
1.4.4 致死细菌的鉴定
1.4.4.1 细菌基因组DNA的提取 使用MiniBEST Bacteria Genomic DNA Extraction kit提取基因组DNA。
1.4.4.2 细菌16S rDNA全长序列扩增及测序 参照Bosshard的方法。16S rDNA通用引物序列如下:8f, 5′-AGAGTTTGATCCTGGCTCAG-3′;1492r,5′-GGTTACCTTGTTACGACTT-3′。25 μL PCR反应体系包括2.5 μL的10×PCR反应缓冲液、1 μL dNTP (2.5 mmol each)、1 U Taq酶、10 μmol的上、下游引物各0.5 μL、DNA模板约50 ng。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s,共30个循环;72 ℃延伸5 min。PCR产物送交Sangon公司测序。
1.4.4.3 致死细菌属、种的确定 根据测序结果,通过NCBI比对,确定致死细菌的属、种。
1.4.5 致死细菌治理方法的研究 将获得的致死细菌进行纯培养,培养条件为37 ℃、120 r/min转速、f/2+LB培养基。将经活化15 h的细菌液5 mL加入到100 mL的三角瓶中,再加入30 mL的f/2培养基,即为获得的细菌培养液。
向次氯酸钠组的细菌培养液中分别添加0.015、0.030 g/L的细菌治理试剂次氯酸钠溶液;向庆大霉素组的细菌培养液中分别添加0.050、0.200 g/L的细菌治理试剂庆大霉素溶液;CK 1组(受到污染的藻液)不添加细菌治理试剂。对各组的细菌培养液在31 ℃条件下以140 r/min的转速在培养箱内培养,8 h和24 h后各测定1次OD750。同时根据需要不定时地取样涂平板,观测细菌情况。每组设3个平行样。
1.4.6 细菌治理效果的验证 将受到细菌污染的藻液装入玻璃柱式反应器中,每个反应器的装液量为800 mL;向实验1组、实验2组和实验3组加入细菌治理试剂次氯酸钠溶液,使有效氯的浓度分别达到0.015、0.020、0.030 g/L; CK 1和CK 2(无污染的藻液)组均不添加细菌治理试剂。在操作时,先将次氯酸钠母液稀释1000倍,然后将其缓慢加入藻液中,混合10 min后,停止通气,避光放置;18 h后在200 μE光强的人工光下通入空气与二氧化碳(5%含量)的混合气,连续培养7 d,每天监控藻细胞的浓度,并在光学显微镜下检查。每组设3个平行样。
1.5 生物量的测定[21]
取体积量为V的藻液,首先利用离心机以3500 r/min进行离心,分离藻细胞和培养液,藻液中的细菌由于自身质量轻、形态小,将在培养液层存在,该培养液层被去除;再加入体积量为5V的一次水进行藻泥层的溶解,待混匀后进行抽滤,此时将藻细胞截留在滤膜(恒定质量,m0)上,并用等体积量的蒸馏水悬浮藻细胞3次,最后将滤膜于105 ℃的烘箱过夜至恒定质量,冷却后称重,得质量m1。藻细胞质量浓度的计算公式为:细胞质量浓度(g/L)=(m1-m0)/V。
2 结果与分析
2.1 致死细菌的分离与鉴定
受到细菌污染的藻液通过稀释、经过平板划线法培养,得到24株单细胞菌落,并对每株单细菌的菌落进行二次分离,最后进行细菌的纯培养,24株细菌的形态如图1所示。
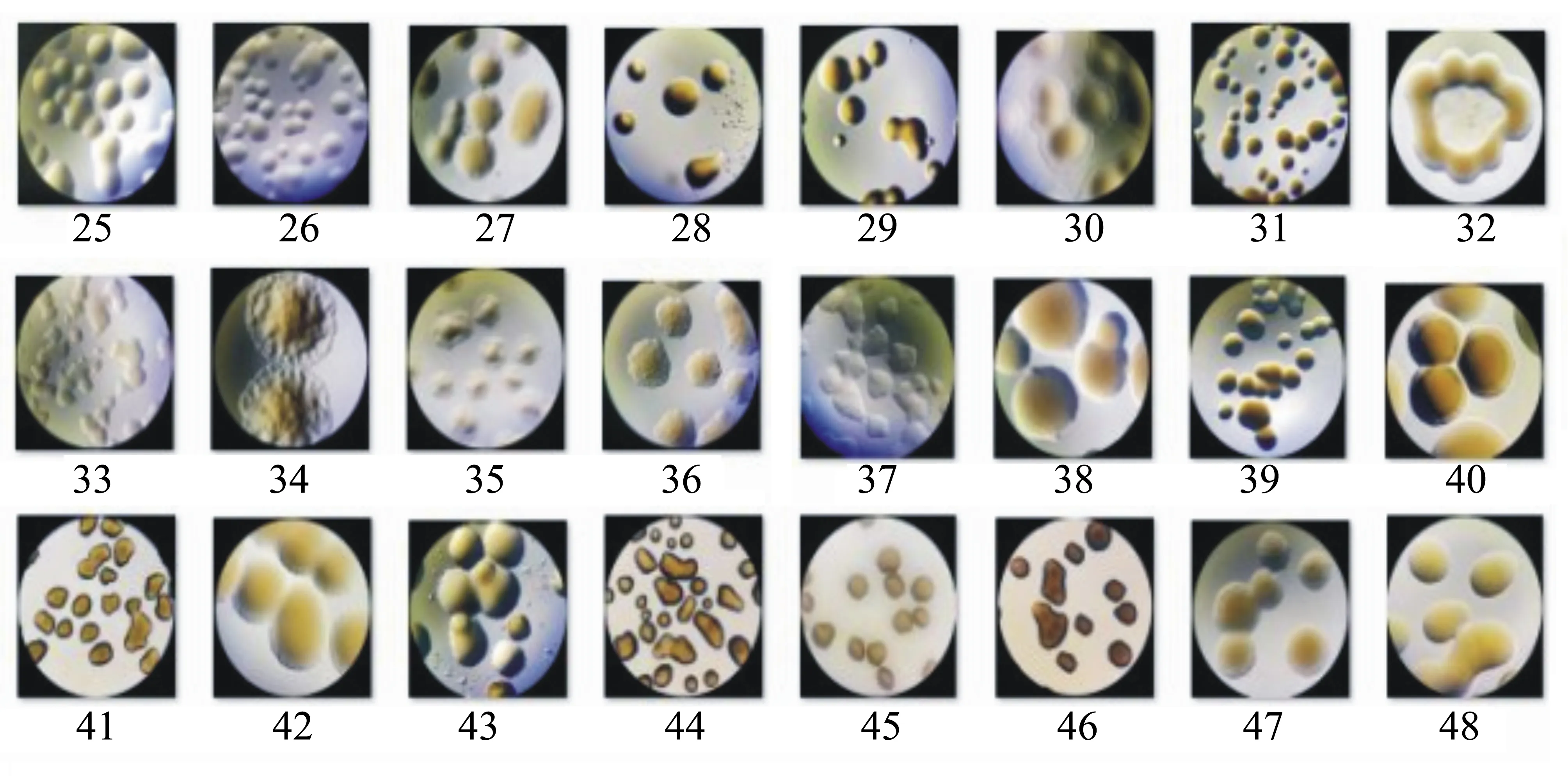
图1 24株分离细菌的形态
将细菌菌液加入藻液中,观察其致死效果。对24株单菌落细菌进行传代培养,将活化后的细菌液体5 mL加到30 mL藻液中,培养24 h后,观察藻细胞生长情况。实验结果如图2所示,47#菌液明显能够导致藻细胞死亡,其具有溶藻作用。因此,对47#细菌进行菌种的分子鉴定。
提取47#致死细菌的基因组DNA,通过细菌16S rDNA通用引物扩增并测序得到47#细菌的16S rDNA序列,在NCBI上进行Blast比对,结果如图3所示,其与噬纤维菌目(Cytophagales)嗜冷菌(Algoriphagusnamhaensis, NR_109104.1)的覆盖率达到99%,一致性达到97%。47#细菌经染色鉴定为革兰氏阴性菌,存在于微藻海水培养液中,菌落颜色为红色,这些与噬纤维菌目的生态特点完全符合。该细菌的菌落形态如图4所示。
2.2 致死细菌的治理方法
2.2.1 治理方法对比 鉴定出的致死细菌属于噬细胞菌属。利用我公司在治理细菌污染方面较有效的两种方法有效氯法和抗生素法对致死细菌进行治理研究。在对噬细胞菌属灭杀过程中菌体浓度的检测结果如图5所示,由图5可见:噬细胞菌在纯海水培养基中生长较慢;在24 h时添加LB培养基后,除0.030 g/L有效氯实验组的OD580值一直较低外,其它实验组的OD580值均先后出现增长现象,说明0.030 g/L有效氯对于噬细胞菌属Algoriphagus的灭杀效果较好,其它方法的灭杀效果均较差。

图2 22株分离细菌对藻细胞生长的影响
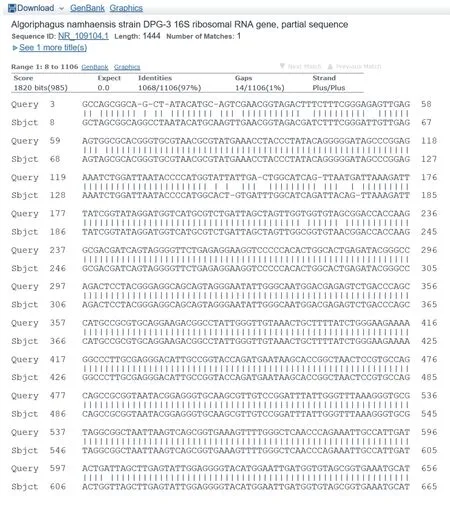
图3 47#细菌与嗜冷菌16S rDNA的部分序列比较
2.2.2 对嗜冷菌Algoriphagus的32 h和48 h杀灭率 从图6可以看出:在32 h时不同浓度有效氯对嗜冷菌Algoriphagus的杀灭效果均较好,杀灭率均在80%以上;在48 h时,0.015 g/L有效氯的杀灭率有所下降,而0.030 g/L有效氯的杀灭率一直较高;0.050 g/L庆大霉素的杀灭效果较差,32 h时的杀灭率仅为20%;0.200 g/L庆大霉素在32 h时的杀灭率较高,但48 h后杀灭率下降。因此,0.030 g/L有效氯对嗜冷菌Algoriphagus的灭杀效果最好。
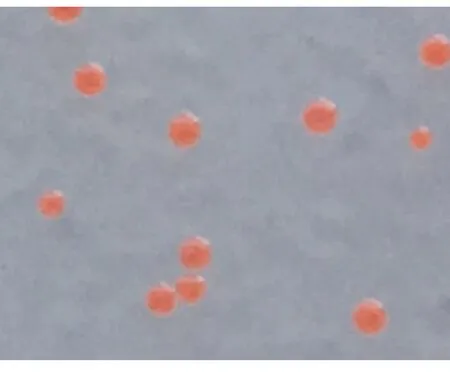
图4 可导致藻细胞死亡的致死细菌嗜冷菌
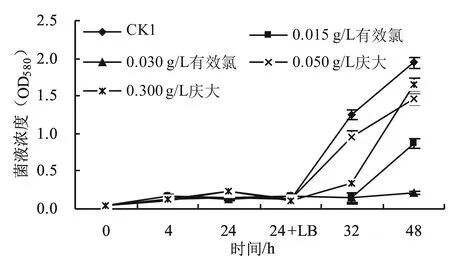
图5 不同治理方法对噬细胞菌属
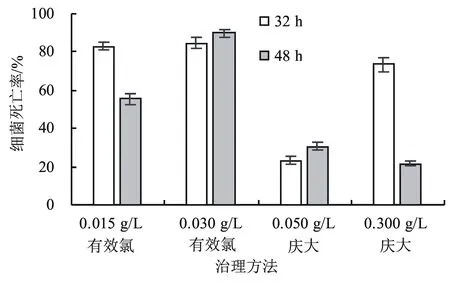
图6 不同治理方法对Algoriphagus的杀灭效果
2.2.3 嗜冷菌Algoriphagus在32 h时的三角瓶照片和在48 h时的涂板结果 从图7上部可以看出:在实验32 h时,有效氯实验组三角瓶中的菌液都较清澈,而庆大霉素实验组的较浑浊,尤其是0.050 g/L庆大霉素组的浑浊度更高,说明32 h时有效氯对嗜冷菌Algoriphagus的灭杀效果比庆大霉素要好。从图7下部的涂板结果可见:在48 h时只有0.030 g/L有效氯实验组的菌落较少,而其它实验组的菌落均较多。上述结果与细菌液的OD580值结果相吻合。
2.3 对嗜冷菌Algoriphagus治理效果的验证
2.3.1 治理前后眼点拟微绿球藻细胞的生长情况 由图8可知,受到噬细胞菌属污染的CK1组藻液经过几日的继续培养,其藻细胞逐渐死亡;通过光学显微镜观察,在藻液中明显有大量短杆状的细菌。而在有效氯治理实验组中藻细胞生长得到明显的恢复,尤其是在开始阶段,细菌受到治理后藻细胞生长恢复到正常。但由于0.015 g/L有效氯(实验1组)不能完全杀灭嗜冷菌,因此在后期藻细胞的生长速度受到了明显的抑制,但在7 d的养殖周期内,由于前期细菌被大量杀灭,藻细胞生长状态逐渐变好,后期藻细胞生长仍较好。实验2组有效氯的添加量为0.020 g/L,此剂量对藻细胞的影响不显著,而且对嗜冷菌具有明显的杀灭作用,因此在该组中藻细胞的生长状态与未污染的藻细胞相当。而在0.030 g/L有效氯实验组(实验3组)中,有效氯的添加量过大,对藻细胞造成了明显的损伤,导致第1天藻细胞浓度出现负增长;但随着养殖时间的延长,嗜冷菌被大量杀灭,因此藻细胞的生长状态得到逐渐恢复,但其仍不如实验2组的。
2.3.2 方差分析结果 污染藻液治理实验进行了3轮重复(实验条件保持不变),均以7 d为培养周期,并以该周期内各实验组藻细胞生物量增量为考查对象。3轮实验数据及其方差分析结果见表1、表2、表3。
对3轮养殖实验数据进行单因素方差分析,F0.05(4,9)=3.48,因此F=593.38>3.48,P<0.05,差异极显著。说明各实验组因素均对实验结果有显著的影响。
3 讨论
微藻户外规模化养殖过程受污染问题导致户外养殖产量低,甚至无法养殖。在微藻养殖过程中主要的生物污染源有原生动物、细菌、真菌和其它藻类。由于细菌种类多,繁殖快,治理难,因此对微藻的规模化养殖影响最大。微藻污染菌类不仅与养殖的藻类有关,与养殖时间、环境也关系密切。由于不同微藻养殖过程中污染的细菌完全不同,针对微藻细菌污染的治理方法也完全不同,因此检测、鉴定微藻养殖过程中污染细菌的属、种是建立有效的污染防治方法的基础。

图7 在实验过程中嗜冷菌被杀灭情况
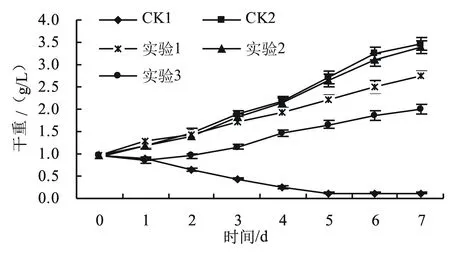
图8 治理前后受污染藻液细胞的生长情况
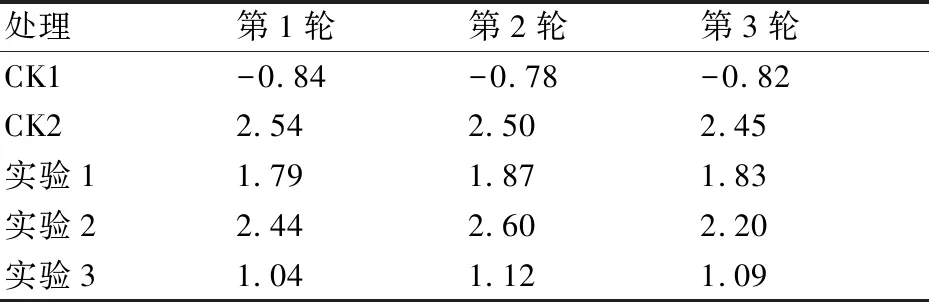
处理第1轮第2轮第3轮CK1-0.84-0.78-0.82CK22.542.502.45实验11.791.871.83实验22.442.602.20实验31.041.121.09
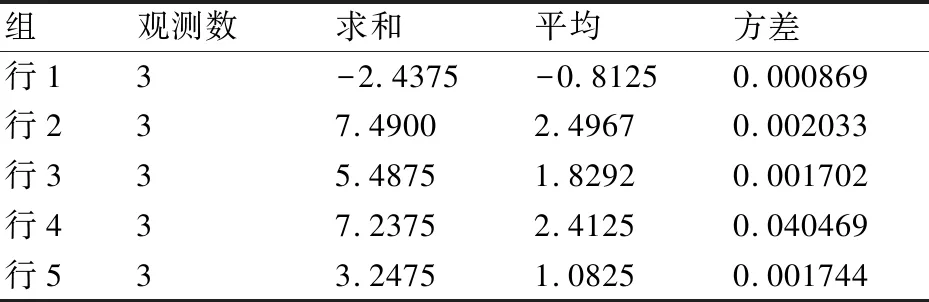
表2 单因素方差分析结果1
自然界中的细菌种类繁多,只要少部分能够通过人工培养繁殖并获得单克隆菌株。如何培养分离获得微藻养殖过程中的致病菌是一个挑战。本实验根据微藻污染细菌的生长特性,尝试用不同的培养基配方和人工培养条件,将微藻自养培养基与LB细菌异养培养基相结合,获得了较好的菌株培养与菌落分离效果。通过形态学与分子鉴定分析,获得了24株不同的细菌菌株,较好地解决了微藻污染菌培养难、分离难的问题。
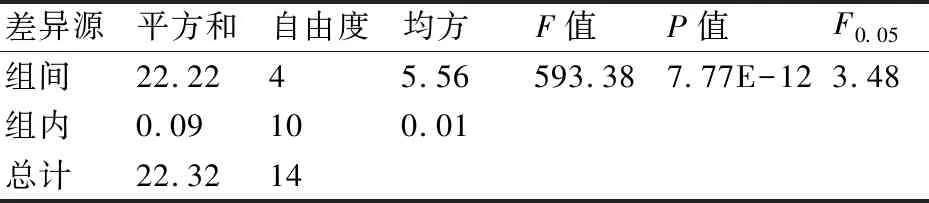
表3 单因素方差分析结果2
本实验经过细菌培养、分离菌落与DNA分子鉴定,对微藻污染菌群的细菌组成进行了分析,发现直接导致微藻死亡裂解的细菌为47#菌,该菌在正常养殖阶段丰度较低,在微藻受污染暴发时,快速生长繁殖。47#菌为嗜冷菌Algoriphagus,能够导致微藻絮凝裂解,是导致微藻养殖失败的主要原因,因此,在微藻养殖过程中如何有效控制47#菌的生长繁殖是微藻污染防治的关键。
目前,在微藻开放池养殖过程中进行细菌防治的方法很多,主要有用次氯酸钠或漂白粉全池泼洒,或用抗生素全池泼洒等方法。本实验结果表明:虽然0.030 g/L有效氯对47#细菌的治理率高达90%,但该浓度有效氯对藻细胞也具有非常大的损伤;0.020 g/L有效氯对该细菌的治理效果比较理想,既能够有效地防止微藻养殖过程中的细菌污染,同时对藻细胞的损伤也低。本实验结果为户外微藻养殖过程中的细菌污染治理提供了参考,也为细菌污染的深入研究提供了基础数据。

