枳实中辛弗林分离纯化及其标准样品定值与不确定度研究
林 涛,邵金良,李茂萱 ,邹艳虹,杨东顺,刘兴勇,刘宏程*
1云南省农业科学院质量标准与检测技术研究所;2农业农村部农产品质量安全风险评估实验室,昆明 650205
辛弗林是枳实中的主要活性成分之一,枳实是从芸香科植物酸橙(CitrusaurantiumL.)的幼果经干燥后所得[1]。辛弗林具有逐风理气,促进食欲等药理作为[2],辛弗林无副作用和阳性反应[3],常作为天然兴奋剂及减肥药物中的有效成分而广泛应用于医药、食品等保健品行业[4,5]。
鉴于辛弗林较好的功能活性,其在枳实药材、柑橘类水果品质评价方面具有重要的作用[6-8]。近年来,对于辛弗林的研究主要包括了提取工艺[9,10]和测定方法[11-15]方面的研究,这些研究都是基于辛弗林对照品而展开的,但是这些对照品的纯度较低,缺乏严格的定值程序,纯度量值准确度较低,无法满足标准样品的要求,严重限制了相关产品中辛弗林的准确定量及相关的品质分析、质量评价等方面的研究。因此,为了提高辛弗林分析测定的准确度和质量评价的一致性等,开展辛弗林标准样品的研究具有十分重要的意义。
1 实验部分
1.1 主要仪器与试剂
制备色谱:P270Ⅱ,大连依利特公司;高效液相色谱仪:Alliance 2695e型,美国Waters公司;气相色谱仪:TRACE 1310型,附带TriPlus? 300型顶空自动进样器,氢火焰离子化检测器(FID),美国Thermo Fisher公司;质谱仪:API 4000型,美国AB公司;核磁共振谱仪:AVANCEⅢ 600 MHz型,美国Bruker公司;红外光谱仪:NICOLET NEXUS 470FT-IR型,美国热电公司;热重分析仪:Pyris1 TGA型,美国Perkin Elmer公司;卡尔费休水分滴定仪:TOLEDO DL39型,瑞士METTLER TOLEDO公司;XBridge BEH C18OBD色谱柱,19 mm × 250 mm,5 μm,美国Waters公司;CAPCELL PAK MGⅡC18色谱柱:4.6 mm×250 mm,5.0 μm,日本Shiseido公司;电子分析天平:AE-100型,瑞士METTLER TOLEDO公司;超声波清洗机:KQ5200DA型,昆山市超声仪器有限公司;旋转蒸发仪:Hei-VAP Value Digital型,德国海道夫公司。
枳实样品:购于云南省昆明市药材市场;AB-8大孔吸附树脂:上海源叶生物科技有限公司;尼泊金乙酯:纯度99.7%,国家二级标准样品,编号为GBW(E)100064,中国计量科学研究院;氘代甲醇:美国Sigma公司;95%乙醇:分析纯,国药集团太仓沪试试剂有限公司;氨水:分析纯,25.0%~28.0%,国药集团太仓沪试试剂有限公司;甲醇:色谱纯,德国Merck公司。
1.2 实验方法
1.2.1 辛弗林纯度标准样品的分离纯化
参照文献[16]中的提取和分离纯化方法,称取枳实粉约5 kg,加入30 L纯水后80 ℃超声提取2次后将提取液合并后减压浓缩后得到枳实水提物1.0 kg,再加入20 L纯水复溶后,利用氨水调节pH至7.5左右,上样量为3 BV,流速为2 BV/h,纯水洗脱至无色后,利用20%乙醇以1 BV/h的流速洗脱,收集洗脱液至3 BV,浓缩干燥后利用甲醇复溶,利用制备色谱进一步纯化,制备色谱条件:流动相为甲醇:水(15∶85),进样量:2 mL;流速:15 mL/min;柱温:30 ℃,检测波长220 nm。经制备色谱纯化得到辛弗林标准样品候选物3 g。
1.2.2 定性分析
采用红外光谱、质谱紫外和核磁分别对辛弗林标准样品候选物的结构进行表征与鉴定。
1.2.3 标准样品分装
辛弗林标准样品经定性确证后,利用2 mL棕色广口钳口瓶进行分装,分装150瓶,每瓶为10 mg,低温下储存。
1.2.4 均匀性检验
均匀性检验的步骤参照GB/T 15000-2008《标准样品工作导则》,分别从已分装的辛弗林中随机抽取20瓶,利用甲醇配制为1.0 mg/mL浓度的溶液,利用液相色谱进行分析测定,每瓶测定3次,并利用液相色谱-面积归一化法计算辛弗林的含量,同时进行均匀性检验(F检验)。
1.2.5 稳定性考察
1.2.5.1 长期稳定性考察。长期稳定性考察时间采用先密后疏的原则,分别在第0、1、3、6个月进行稳定性检测。检验方法与均匀性检验相同,即液相色谱-面积归一化法,操作步骤为:每次考察时分取2个包装,每个包装用甲醇配制为浓度1.0 mg/mL的溶液进行测定,每个包装平行测定3次并计算平均值,再将2个包装的测定结果平均值作为最终的检测结果,计算相对标准偏差。
1.2.5.2 短期稳定性考察。短期稳定性考察也是遵循先密后疏的原则,分别于第0、3、5、7、14天进行样品的稳定性考察。为了模拟长途运输过程中的温度,各取20个包装分别置于20 ℃和40 ℃的恒温箱中储存并定期检验,检验方法与均匀性检验相同。
1.2.6 辛弗林标准样品定值
根据GB/T 15000-2008《标准样品工作导则》的规定,标准样品定值时需采用两种不同原理的方法进行定值。因此,本研究中根据辛弗林的相关物理和化学性质,选取质量平衡法和定量核磁法两种不同原理方法对辛弗林标准样品进行定值,具体方法如下。
1.2.6.1 质量平衡法的测定方法参考文献[17-21]中的方法,主要包括了利用液相色谱-面积归一化法进行主成分含量分析、卡尔费休库伦法测定水分含量、TGA法测定灰分含量、顶空气相色谱法测定挥发性杂质含量以及利用ICP-MS测定无机元素含量等,按式(1)计算辛弗林的纯度。
P1=P0×(1-Xw-Xn-Xv)×100%
(1)
式中:P1——样品纯度,%;
P0——辛弗林的含量,%;
Xw——水分含量,%;
Xn——非挥发性杂质含量,%;
Xv——挥发性杂质含量,%。
1.2.6.2 核磁定量法主要步骤:分别称取辛弗林纯度标准样品和尼泊金乙酯4.2 mg和5 mg,再加入0.5 mL氘代甲醇溶解,混匀后1H-NMR测定。按式(2)计算辛弗林的纯度。
式中:P2——采用核磁共振法测得的被测物的纯度,%;
Ix——样品指定峰的积分面积,%;
Istd——内标物指定峰的积分面积;
nstd——内标物指定峰的核群核个数;
nx——样品指定峰的核群核个数;
Mx——样品的相对分子质量;
Mstd——内标物的相对分子质量;
mstd——内标物添加的质量;
mx——样品的称样量;
Pstd——内标物的纯度,%。
1.2.7 不确定度研究
不确定度uCRM主要包括了标准样品定值过程引入的不确定度uchar、均匀性引入的不确定度ubb、短期稳定性引入的不确定度ults和长期稳定性引入的不确定度usts四个部分,相关计算公式如下:

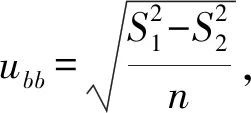
ults=s(blts)×t
ustd=s(bstd)×t

2 实验结果
2.1 定性结果分析
2.1.1 红外光谱分析
辛弗林的红外光谱如图1所示,3 393.30 cm-1特征峰为O-H的伸缩振动峰,2 949.72和2 870.50 cm-1特征峰为CH3和CH2的伸缩振动峰,1 004.52

图1 辛弗林的红外光谱Fig.1 Infrared spectrum of synephrine
~1 604.95 cm-1提示为单、双键的伸缩振动区,其中1 247.88、1 159.59和1 057.62 cm-1为C-O的伸缩振动。
2.1.2 紫外光谱分析
辛弗林的紫外光谱如图2所示,辛弗林在190 nm和220 nm处具有较强的紫外吸收,其中190 nm提示结构中含有R-OH结构。
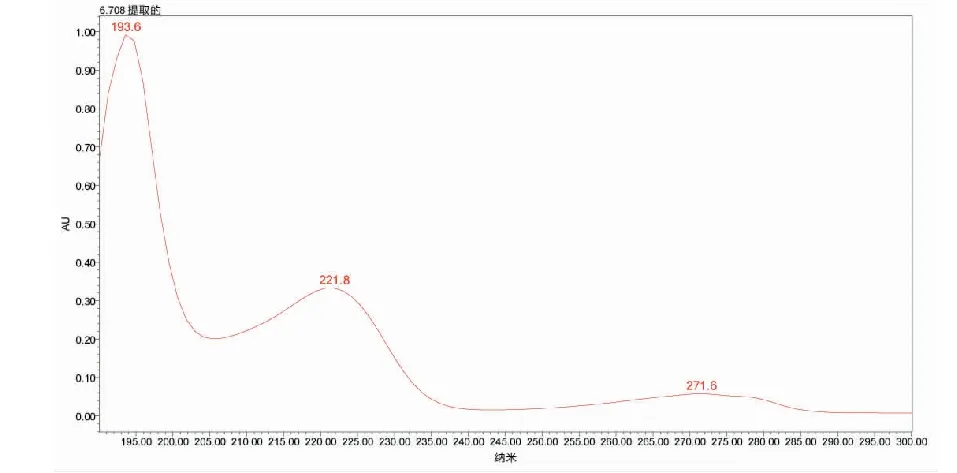
图2 辛弗林的紫外光谱Fig.2 UV spectrum of synephrine
2.1.3 质谱分析
通过对辛弗林进行质谱分析,在正离子模式下,扫描范围为100~300m/z,图3所示,其母离子167.8m/z为[M+H]+,初步确定为辛弗林。

图3 辛弗林质谱图Fig.3 The mass spectrum of synephrine
2.1.4 核磁分析
通过对辛弗林的氢谱和碳谱分析,化学位移归属为:1H NMR (Methanol-D4,600 MHz):δ2.40 (s,3H,CH3-N);δ2.64~2.789 (m,2H,CH2-N);δ4.67 (dd,1H;J=6.0;J=6.0,CH-O);δ6.76 (d,2H,J=6.0 Hz,ArCH);δ7.19 (d,2H,J=12.0 Hz,ArCH);13C NMR (Methanol-D4,150 MHz):δ35.9 (CH3-N);δ59.9 (CH2-N);δ72.9 (CH-OH);δ116.2 (ArCH);δ128.3 (ArCH);δ135.1 (ArC0);δ158.3 (ArCH-OH)。与文献中辛弗林的氢谱和碳谱进行比较,其核磁数据与文献[22]一致,结合红外、紫外和质谱信息,可确定其为辛弗林。
2.2 均匀性检验结果
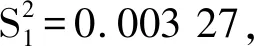
图4 辛弗林核磁谱Fig.4 The nuclear magnetic spectrum of synephrine
2.3 稳定性检验结果
利用趋势分析法对稳定性的结果进行考察,如图5所示。通过对数据进行t 检验,根据判定公式,稳定性分析中所拟合的直线斜率绝对值应小于t(0.95,n-2)×斜率的不确定度,结果如表1所示,短期稳定性和长期稳定性结果均符合要求。因此辛弗林标准样品在6个月内的稳定性较好,且模拟运输条件下的特性量值稳定。
2.4.1 质量平衡法定值结果
(1)液相色谱-面积归一化法测定含量:采用优化后的色谱条件:色谱柱:资生堂C18色谱柱,5 μm,4.0×250 mm;流动相为甲醇:水(10:90),进样量:10 μL;流速:0.5 mL/min;柱温:30 ℃,检测波长220 nm,辛弗林的液相色谱图如图6所示。
(2)采用卡尔费休库伦法测定了水分含量、顶空气相色谱法测定了挥发性杂质含量和ICP-MS测定了无机元素含量等,结果如表2所示,质量平衡法测定的纯度质量分数为99.55%。
2.4 定值结果
2.4.2 核磁定量法定值结果
根据尼泊金乙酯和辛弗林在氢谱中的化学位移,选择了尼泊金乙酯化学位移1.35 ppm和辛弗林化学位移2.45 ppm处的氢作为定量的目标峰,7次测定的结果分别为99.689%、99.695%、99.689%、99.691%、99.693%、99.688%和99.690%,平均值为99.691%,相对标准偏差为0.002%。

表1 辛弗林纯度的稳定性检验结果(%)
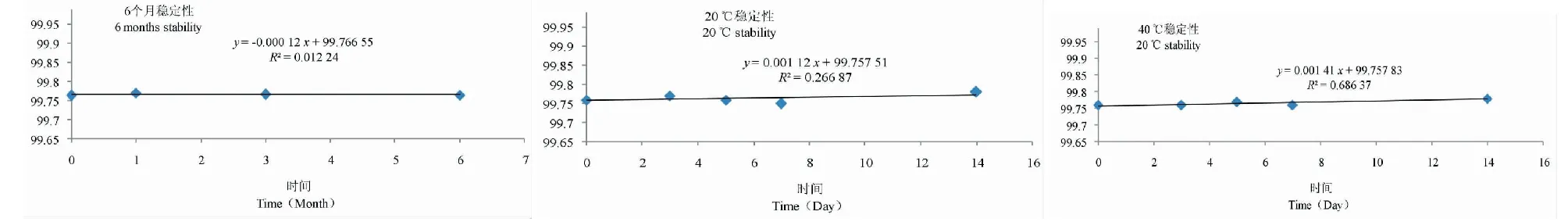
图5 稳定性趋势分析图Fig.5 Trend analysis of stability analysis
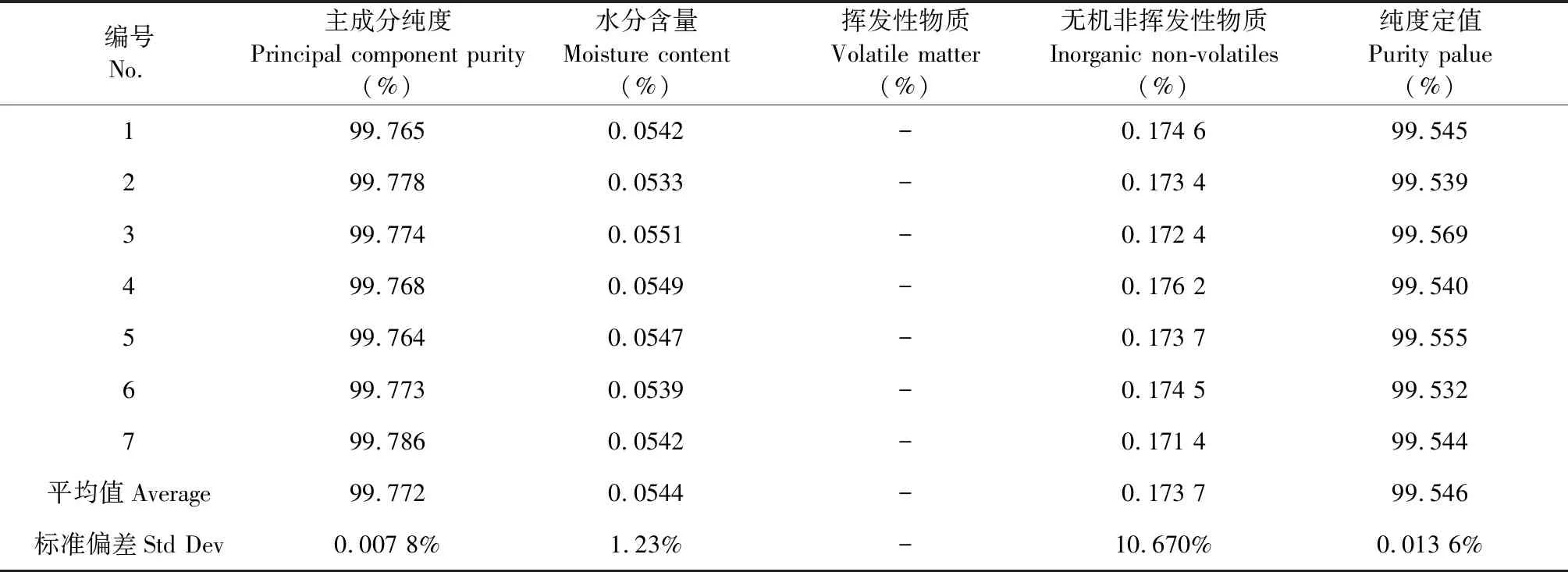
编号No.主成分纯度Principal component purity(%)水分含量Moisture content(%)挥发性物质Volatile matter(%)无机非挥发性物质Inorganic non-volatiles(%)纯度定值Purity palue(%)199.7650.0542-0.174 699.545299.7780.0533-0.173 499.539399.7740.0551-0.172 499.569499.7680.0549-0.176 299.540599.7640.0547-0.173 799.555699.7730.0539-0.174 599.532799.7860.0542-0.171 499.544平均值Average99.7720.0544-0.173 799.546标准偏差Std Dev0.007 8%1.23%-10.670%0.013 6%
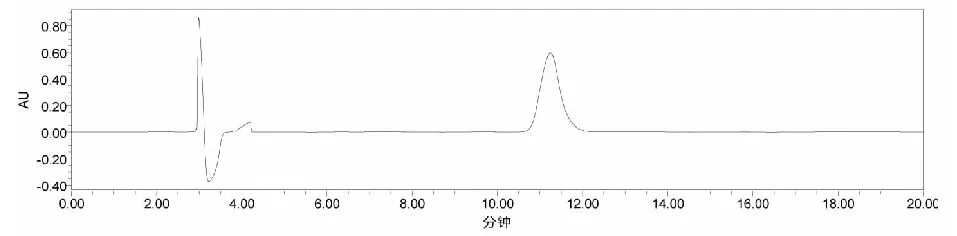
图6 辛弗林液相色谱图Fig.7 Liquid chromatogram of synephrine
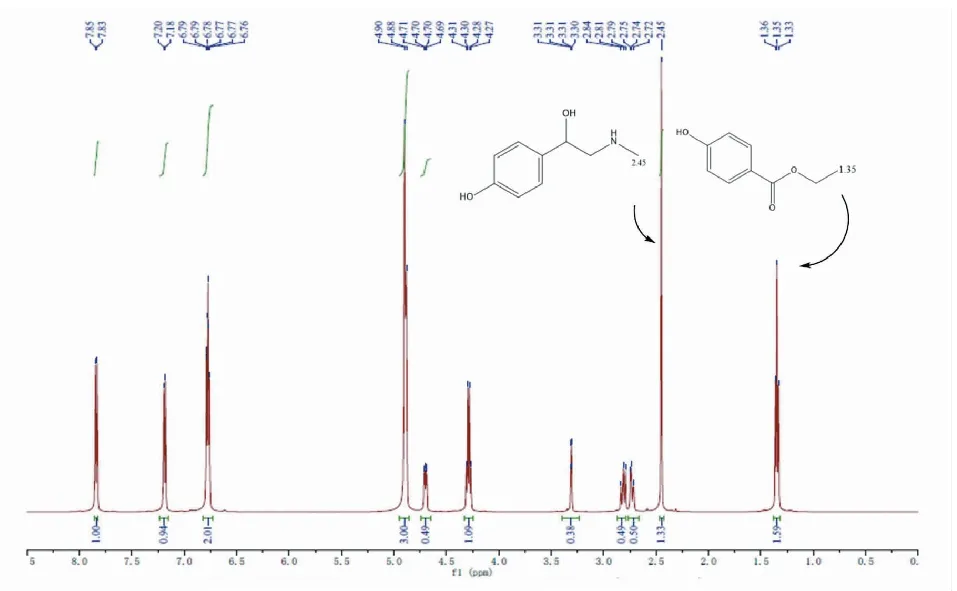
图7 辛弗林定量核磁氢谱Fig.7 Quantitation 1H-NMR of synephrine
2.4.3 两种方法定值结果
根据质量平衡法和核磁定量法的定值结果分别为99.546%和99.691%,可以得到最终的定值结果为(99.546%+99.691%)/2=99.618%。
2.5 不确定度评定结果
2.5.2 不稳定引入的不确定度:根据表1的结果,辛弗林纯度标准样品长期稳定性引入的不确定度为ults=0.009%,辛弗林纯度标准样品短期稳定性引入的不确定度分别为20 ℃的usts,20 ℃=0.004%和40 ℃的usts,40 ℃=0.002%,短期稳定性引入的总的不确定度为usts=0.004 5%。
2.5.3 液相色谱法定性的测量重复性引入的不确定度u1,由测量的相对标准偏差计算为0.007 8%;杂质在不同检测波长下响应差异引入的不确定度u2,本研究中的辛弗林中的杂质的最大吸收波长与主成分一致,可将u2忽略不计;仪器检测线性引入的不确定度u3,本研究中辛弗林在0.05~500.00 mg/L的浓度范围内线性良好(相关系数为0.999 5),可将u3忽略不计;仪器检出限引入的不确定度u4,通过试验可以得到仪器的检出限为0.40 mg/L,u4=0.40/500.00=0.08%。

2.5.5 根据质量平衡法的不确定度uMB的计算公式,可计算得到uMB=0.17%。

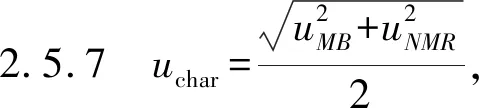
3 结论
本研究采用大孔树脂及制备色谱等现代分离纯化手段,从枳实中分离得到辛弗林,采用质量平衡法和定量核磁法两种不同原理的定值方法对辛弗林进行定值以及均匀性、稳定性和不确定度研究,辛弗林标准样品的定值结果为99.62%,其扩展不确定度为0.8%(k=2),满足国家标准样品的要求,对于相关样品中辛弗林的测定具有重要意义。

