miR-135a在胶质瘤中的表达变化及作用机制
许大远,李志强,宋大勇,权哲,沈冬青
(上海交通大学附属第六人民医院南院·奉贤区中心医院,上海 200000)
胶质瘤是中枢神经系统最常见的、原发于颅内的恶性肿瘤,其恶性程度高,易侵袭和复发,目前主要采用手术及放化疗,但总体有效率较低,5年生存率不高,预后较差[1]。目前胶质瘤发生、发展的分子病理机制尚不明确,针对胶质瘤相关发病基因的探讨仍为目前研究的热点,寻找胶质瘤靶向治疗的有效分子靶点迫在眉睫[2]。研究[3,4]表明,微小RNA(miRNA)在机体细胞各种生理及病理过程发挥着极其重要的调控作用,能够调控细胞增殖、分化和凋亡等细胞活动,并且与恶性肿瘤的发生、发展密切相关。研究发现,大量的miRNA在胶质瘤中异常表达,并在细胞生长和侵袭中起重要作用[5,6]。miR-135a是近年来发现的miR-135家族成员之一,其定位于染色体3p21.1。近期研究显示,miR-135a在多种恶性肿瘤组织或细胞中表达异常,参与恶性肿瘤的发生发展[7]。但目前有关miR-135a在胶质瘤中表达情况的研究甚少,并且具体的作用机制尚不明确。本研究观察了miR-135a在胶质瘤组织和细胞中的表达情况,并探索了miR-135a对胶质瘤细胞增殖、凋亡的影响及其相关分子机制,为胶质瘤的靶向治疗提供依据。
1 材料与方法
1.1 标本来源及主要试剂 收集2015年1月~2018年5月在上海交通大学附属第六人民医院南院手术切除的60例脑胶质瘤组织及相应的癌旁组织标本,组织标本离体后经液氮速冻,-80 ℃保存备用。所有标本由两位病理专家独立诊断,并结合患者临床表现、影像学及组织学特点确诊。根据世界卫生组织中枢神经系统肿瘤分类标准(2010年),Ⅱ级16例,Ⅲ级24例,Ⅳ级20例。标本来源患者男32例、女28例,年龄22~65岁、中位年龄41.4岁,所有患者术前无放化疗及免疫治疗等抗肿瘤治疗史。本研究经医院伦理委员会批准,患者及家属均知情同意。LipofectamineTM2000 试剂、TRIzol试剂购自美国Invitrogen公司;逆转录试剂盒及实时荧光定量PCR试剂盒购自大连宝生物公司;miR-135a模拟物(miR-135a mimics)和模拟物阴性对照(mimics-NC)均购自上海吉玛制药公司;miR-135a及U6引物购自广州锐博生物公司;兔抗人HOXA10多克隆抗体购自美国Santa Cruz公司;兔抗人α-tubulin单克隆抗体购自美国Cell Signaling Technology公司;辣根过氧化物酶标记山羊抗兔二抗购自武汉博士德生物公司;CCK-8试剂盒购自碧云天生物技术有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基生物公司。
1.2 细胞来源、培养和转染 人星形胶质细胞HA1800和人胶质瘤细胞U87、U251、A172均购自中国科学院上海细胞所,均培养于DMEM培养基(含10%小牛血清、100 U/mL青霉素、100 μg/mL链霉素),在37 ℃、5% CO2、饱和湿度的培养箱中培养,根据细胞生长情况进行换液或传代。转染前24 h将胶质瘤U87细胞按3×105个/孔接种到6孔细胞板中,细胞生长融合达60%时更换无血清培养基,将细胞分为miR-135a模拟物组和对照组,按照LipofectamineTM2000试剂按说明书操作分别转染miR-135a mimics和mimics-NC,转染后24 h检测两组细胞中miR-135a的表达水平,确定转染效率。
1.3 miR-135a表达检测 采用实时荧光定量PCR。采用TRIzol法取胶质瘤组织及癌旁组织、胶质瘤细胞U87、U251、A172和人星形胶质细胞HA1800总RNA。以总RNA为模板,按逆转录试剂盒说明书操作逆转录得到cDNA。取cDNA,根据实时荧光量PCR试剂盒说明书配制PCR体系进行反应,分别用miR-135a和U6引物于ABI 7500型荧光定量PCR仪进行qRT-PCR扩增,miR-135a引物序列:上游5′-ACACTCCAGCTGGGTATGGCTTTTTATTCCT-3′,下游5′-GGTGTCGTG GAGTCGGCAA-3′;U6引物序列:上游5′-GCTCTGTCACCAACACTCACT-3′,下游5′-GCTGCCTTTCTTGTGTCGTT-3′。反应条件:95 ℃ 30 s,40个循环(95 ℃ 5 s,60 ℃ 20 s)。以U6为内参,采用2-ΔΔCt法计算miR-135a的相对表达量。
1.4 细胞增殖活性检测 采用CCK-8法。取miR-135a模拟物组和对照组转染24 h后的U87细胞,消化重悬制备单细胞悬液(细胞密度为1×105个/mL)。取200 μL单细胞悬液接种于96孔板,各组设5个复孔,同时设空白对照孔,于24、48、72、96 h各个时点向每孔加入10 μL CCK-8溶液,在37 ℃,5% CO2的培养箱中避光孵育2 h,应用酶标仪测定450 nm波长处各孔不同时点的光密度(OD)值,绘制细胞增殖曲线。
1.5 细胞凋亡率测算 收集miR-135a模拟物组和对照组转染48 h后的U87细胞,PBS清洗细胞2次,胰蛋白酶消化细胞,离心收集细胞制成单细胞悬液。取约5×105个细胞重悬于200 μL binding buffer,按Annexin V-FITC/PI细胞凋亡试剂盒说明书操作,加入10 μL Annexin V-FITC和5 μL PI轻轻混匀,避光室温反应15 min,加入300 μL binding buffer,采用流式细胞仪测算细胞凋亡率。
1.6 HOXA10蛋白表达检测 采用Western blotting法。收集miR-135a模拟物组和对照组转染24 h后的U87细胞,加入RIPA裂解液进行裂解,提取细胞总蛋白质,BCA法测定蛋白浓度。每孔取30 μg蛋白于10% SDS-PAGE实验分离蛋白质,然后转移至PVDF膜上,加入5%脱脂奶粉进行封闭2 h后,再加入一抗HOXA10和α-tubulin(稀释比例1∶1 000),4 ℃摇床孵育过夜,TBST洗膜后,加入二抗(稀释比例1∶10 000),室温孵育2 h,TBST洗膜后加入ECL显影液显影,分析条带灰度值。以α-tubulin作为内参,计算HOXA10蛋白相对表达量。

2 结果
2.1 胶质瘤组织及细胞中miR-135a表达情况 胶质瘤组织、癌旁组织中miR-135a相对表达量分别为0.40±0.10、1.01±0.05,两者比较P<0.01。胶质瘤细胞U87、U251、A172中miR-135a的相对表达量分别为0.21±0.10、0.53±0.08、0.42±0.07,低于人星形胶质细胞HA1800(1.03±0.04)(P均<0.01)。Ⅱ、Ⅲ、Ⅳ级胶质瘤组织中miR-135a的相对表达量分别为0.59±0.16、0.39±0.09、0.36±0.06,两两比较P均<0.01。
2.2 两组miR-135a表达比较 miR-135a模拟物组和对照组U87细胞中miR-135a相对表达量分别为16.45±1.22、1.03±0.06,两组比较P<0.01。
2.3 两组细胞增殖活性比较 miR-135a模拟物组U87细胞在48、72、96 h时OD值低于对照组﹙P均<0.05﹚。
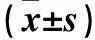
表1 两组细胞不同时间OD值比较
注:与对照组比较,*P<0.05。
2.4 两组细胞凋亡率比较 miR-135a模拟物组和对照组U87细胞凋亡率分别为(52.14±3.50)%、(8.45±1.45)%,两组比较P<0.01。
2.5 两组HOXA10蛋白表达比较 miR-135a模拟物组和对照组U87细胞HOXA10蛋白相对表达量分别为0.35±0.13、1.06±0.15,两组比较P<0.01。
3 讨论
miRNA是一类由19~25个核苷酸组成的内源性非编码单链小分子RNA,通过与靶基因mRNA的3′UTR特异性碱基配对,导致靶基因mRNA降解或抑制其翻译,在转录后水平调控基因的表达,在器官形成、细胞增殖凋亡,造血、肿瘤形成等一系列生命过程中起着重要的调控作用[3,4]。胶质瘤是世界范围内中枢神经系统的常见原发性恶性肿瘤,其增殖速度快,恶性程度高,预后较差。近年发现,大量miRNA在胶质瘤的发生、发展中起着重要的调控作用,但是至今控制胶质瘤生长的主要的异常miRNA基因仍不明确。
miR-135a是近期发现的miRNA家族重要成员之一。有研究发现,miR-135a异常表达在恶性肿瘤的发生、发展中起着重要的调控作用。miR-135a在髓母细胞瘤[8]、乳腺癌[9]、鼻咽癌[10]、胃癌[11]等恶性肿瘤中异常低表达,起着类似抑癌基因的作用,上调肿瘤细胞中miR-135a的表达能够抑制细胞的生长及转移速度。但在肝细胞癌[12,13]、膀胱癌[14]、结肠癌[15]中却发现miR-135a的表达异常增高,起着类似原癌基因的作用,下调肿瘤细胞中miR-135a的表达能够抑制细胞的生长及转移速度。由此可见,miR-135a在不同的肿瘤中存在明显的异质性。至今有关miR-135a在胶质瘤中表达情况的研究甚少。本研究中我们应用实时荧光定量PCR法检测胶质瘤组织和细胞中miR-135a的表达情况发现,miR-135a在胶质瘤组织中的表达低于癌旁组织,并且miR-135a在胶质瘤细胞U87、U251、A172中的表达水平低于人星形胶质细胞HA1800,说明miR-135a在胶质瘤中表达异常降低。进一步分析发现,胶质瘤组织中miR-135a的表达随着胶质瘤病理分级的增高而逐渐下降,提示胶质瘤中miR-135a的异常低表达与胶质瘤恶性进展有关,可能在胶质瘤中起着抑癌基因的作用。
为了明确miR-135a对胶质瘤可能的作用机制,本研究采用CCK-8实验和流式细胞术观察了miR-135a对胶质瘤细胞增殖、凋亡等恶性肿瘤生物学行为的影响。在体外细胞学实验中,本研究通过脂质体转染法转染miR-135a模拟物成功上调U87细胞中miR-135a的表达水平,结果发现上调miR-135a表达水平后,细胞增殖活性明显降低,凋亡率明显增高,证实miR-135a可以通过抑制胶质瘤细胞增殖并促进其凋亡在胶质瘤中起着抑癌基因的作用,能够抑制胶质瘤细胞的生长。目前已经发现了miR-135a调控肿瘤细胞增殖、凋亡、侵袭及转移等生物学行为的许多下游靶基因。近期较多的研究表明miR-135a可以通过靶向调控HOXA10基因的表达调控肿瘤细胞的增殖及侵袭[16~19]。为了探索miR-135a在胶质瘤是否也能够通过调控HOXA10基因的表达发挥作用,本研究发现,上调U87细胞中miR-135a的表达能够明显抑制U87细胞中HOXA10蛋白的表达,提示miR-135a对胶质瘤细胞增长的抑制作用可能与下调HOXA10基因的表达有关。HOXA10是同源框基因(HOX)家族成员之一。HOX家族是一类在进化上高度保守的转录调节因子家族,分为A、B、C、D四簇,在细胞增殖、分化、组织发育、肿瘤发生发展中发挥着重要的作用[20]。研究显示,HOXA10在多种恶性肿瘤组织中表达升高,起着类似癌基因的作用。沉默HOXA10基因的表达能够明显抑制肿瘤细胞的增殖、侵袭和迁移等行为[20]。已有研究证实,HOXA10在胶质瘤中表达增高[21],并且随着胶质瘤病理分级的升高而升高[22],与胶质瘤的不良预后密切相关,高表达HOXA10的胶质瘤患者预后较差[23]。并且有研究发现,HOXA10基因与胶质瘤的多药耐药性密切相关,抑制HOXA10的表达能够逆转胶质瘤细胞对替莫唑胺的耐药[24]。
综上所述,miR-135a在胶质瘤组织和细胞中表达降低,上调胶质瘤细胞中miR-135a的表达,能够明显抑制肿瘤细胞的增殖并促进其凋亡,其机制可能与下调HOXA10基因的表达有关,为胶质瘤的靶向治疗提供了新的方向,并且有可能成为未来胶质瘤基因靶向治疗的有效作用靶点。

