肝豆灵片对硫酸铜模拟铜负荷诱导TX小鼠原代肝细胞凋亡的影响
陈永华, 杨文明, 江海林, 唐露露
(1.安徽中医药大学第一附属医院脑病中心,安徽合肥230031;2.安徽中医药大学研究生院,安徽合肥230038)
Wilson病是因遗传性ATP7B基因突变导致的铜代谢障碍性疾病[1],铜蓄积中毒是其肝细胞损害的主要原因,内质网应激凋亡信号通路是重要肝细胞凋亡途径[2-3],对此通路的干预可能是患者肝损害新的治疗靶点。中医证候学调查研究显示,铜邪毒与痰瘀血互结是Wilson病患者常见证候[4],清热解毒、祛瘀通腑方肝豆灵片可改善肝损害,减少铜负荷诱导的肝细胞凋亡[5],但其确切作用机制尚不明确,故本实验探讨该制剂治疗肝损害的分子机制。
1 材料
1.1 动物 2对Wilson病模型小鼠 (TX小鼠)及DL小鼠的种鼠均购于美国Jackson实验室,小鼠肝细胞用原代方法进行培养及分离得到[6]。SD大鼠44只,体质量 (195±15)g,购于安徽省实验动物中心,许可证号SYXK-2017-004,适应性饲养7 d后进行实验。
1.2 试药 肝豆灵片 (安徽省中医院制剂中心,0.3 g/片,批号20160012),由川黄连、紫丹参、血风藤、蜀大黄、蓬莪术、毛姜黄等组成,制备方法为用65%乙醇提取各药材有效成分,合并滤液,合适温度下烘制成干膏,加入炼蜜及淀粉,最后压片包装。硫酸铜 (国药集团化学试剂有限公司);达尔白克必需基本培养基 (DMEM)购自美国Gibco公司,批号12400035;胎牛血清 (FBS)购自美国Hyclone公司,批号10099-156;HumanPERK、CHOP引物[宝生物工程 (大连)有限公司];Salubrinal(特异性eIF2a磷酸化抑制剂,美国西格玛公司)。
1.3 仪器 二氧化碳培养箱 (上海基汇生物科技有限公司);高性能超净工作台 (广东坤灵净化设备有限公司);BG-Power300基本电泳仪电源 (北京百晶生物技术有限公司);Gstorm梯度多重控温梯度PCR仪 (武汉成名仪器有限公司);Amnis高速成像流式细胞仪 [德国默克密理博(中国)有限公司];分光光度计 [北京北分瑞利分析仪器(集团)有限责任公司]。
2 方法
2.1 药物血清、硫酸铜培养基制备 SD大鼠随机分为空白组及肝豆灵片低、中、高剂量组,每组11只。参照韩辉等[7]报道方法,将肝豆灵片溶于5 mL灭菌用水中,配制成0.06、0.12、0.24 g/mL溶液,根据成人常规用药量标准换算成大鼠用药量 (1.20 g/kg),设置肝豆灵片低、中、高剂量组分别为0.60、1.20、2.40 g/kg,每天早晚2次灌胃给药,连续4 d。第4天给药结束后抽取1 h腹主动脉血,分离得到相应剂量含药血清,连同空白血清置于-20℃冰箱中保存。
前期预实验显示,在基础培养基中添加300 μmo1/L硫酸铜铜离子模拟的铜负荷继续培养TX小鼠原代肝细胞24 h时,原代肝细胞产生明显细胞毒性,其凋亡明显增加[2];继续培养24 h时,不产生明显细胞凋亡作用。TX小鼠原代肝细胞由于ATP7B基因突变,导致铜转运出细胞外发生障碍,引起过量铜在肝细胞内蓄积,从而引起肝细胞毒性作用;DL小鼠原代肝细胞由于正常ATP7B基因编码表达正常肝细胞ATP7B蛋白酶,可正常转运肝细胞内的铜,并不会出现过量铜蓄积导致细胞中毒作用及凋亡[2],故用300 μmol/L硫酸铜铜离子模拟原代肝细胞铜负荷进行实验,其配制方法为0.2495 gCuSO4·5H2O溶于10 mL DMEM中,得到含铜离子100 mmo1/L的母液, 稀释至300 μmo1/L后再加入 DMEM 培养基[7-8]。
2.2 肝细胞培养 采用两步灌注法分离和取TX、DL小鼠肝细胞,DMEM培养基进行培养,在37.1℃、6%CO2、相对饱和空气湿度条件下进行细胞培养,肝细胞呈贴壁生长,3.5 h后更换培养基。
2.3 分组及给药 设置有正常组、对照组、Salubrinal组及肝豆灵片低、中、高剂量组,其中正常组为DL小鼠分离的原代肝细胞,在用含10%血清培养基培养的基础上加用硫酸铜模拟的铜负荷;对照组为TX小鼠分离的原代肝细胞,在用含10%血清培养基培养的基础上加用硫酸铜模拟的铜负荷;肝豆灵片组为TX小鼠分离的原代肝细胞,在用含10%血清培养基培养的基础上加用硫酸铜模拟的铜负荷,加入通过原子吸收法检测的低、中、高剂量肝豆灵含药血清;Salubrinal组为TX小鼠分离的原代肝细胞,在用含10%血清培养基培养的基础上加用硫酸铜模拟的铜负荷,然后加入Salubrinal继续培养,6组培养原代肝细胞24 h。
2.4 肝细胞凋亡检测 取指数生长期的DL、TX小鼠原代肝细胞,按 “2.3”项下方法分组,通过流式细胞仪检测肝细胞凋亡。
2.5 PERK、p-eIF2a蛋白表达检测 取指数生长期的DL、TX小鼠原代肝细胞,按 “2.3”项下方法分组,通过Western Blot法检测肝细胞PERK、p-eIF2a蛋白表达,然后进行灰度值比对。
2.6 CHOP mRNA水平检测 取指数生长期的DL、TX小鼠原代肝细胞,按 “2.3”项下方法分组,通过RT-PCR法检测肝细胞CHOP mRNA水平。
2.7 统计学分析 通过SPSS 21.0软件进行处理,数据以(±s) 表示,组间资料比较采用t检验。以P<0.05为差异有统计学意义。
3 结果
3.1 肝豆灵片对原代肝细胞凋亡的影响 图1显示,与正常组比较,对照组原代肝细胞凋亡率显著增加 (P<0.01),而肝豆灵片组呈剂量依赖性地显著抑制其凋亡 (P<0.05,P<0.01)。
3.2 肝豆灵片对PERK蛋白表达的影响 图2显示,与正常组比较,对照组PERK蛋白表达 (P<0.01)显著增加,而肝豆灵片组呈剂量依赖性地显著抑制其蛋白表达 (P<0.05, P<0.01)。
3.3 肝豆灵片对p-eIF2a蛋白表达的影响 图3显示,与正常组比较,对照组 p-eIF2a蛋白表达显著增加 (P<0.01),而肝豆灵片组呈剂量依赖性地显著抑制其蛋白表达 (P<0.05, P<0.01)。
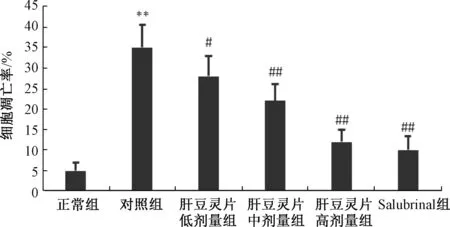
图1 肝豆灵片对原代肝细胞凋亡的影响 (n=3)
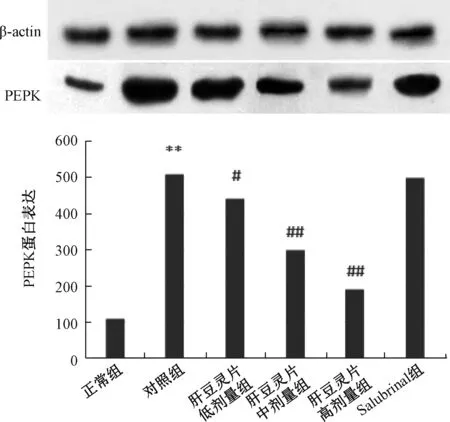
图2 肝豆灵片对PERK蛋白表达的影响 (n=3)

图3 肝豆灵片对p-eIF2a蛋白表达的影响 (n=3)
3.4 肝豆灵片对CHOP mRNA水平的影响 图4显示,与正常组比较,对照组 CHOP mRNA水平显著增加 (P<0.01),而肝豆灵片组呈剂量依赖性地显著降低其mRNA水平 (P<0.05, P<0.01)。
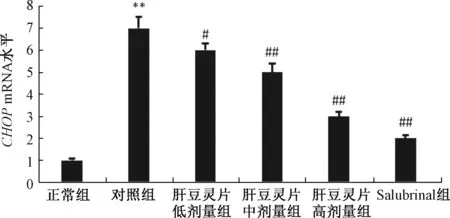
图4 肝豆灵片对CHOP mRNA水平的影响 (n=3)
4 讨论
Wilson病在我国也称为肝豆状核变性,是少见的可治疗的常染色体隐性遗传性铜代谢障碍性疾病,其最常见临床特点之一是肝损害,铜在肝脏中的过量蓄积是最主要原因,但其引起肝细胞凋亡的确切分子病理机制尚不明确[9]。近年研究显示,内质网应激是铜沉积引起肝损害的新的潜在机制之一,Wilson病发生过程存在内质网应激,并且肝细胞功能恢复与内质网应激缓解也密切相关的[2]。长期铜过量蓄积在肝细胞可引起肝细胞内过度内质网应激,从而诱发和激活内质网应激反应的凋亡途径,损伤肝细胞功能,最终则引起其凋亡[2]。当机体长期处于高铜环境的情况下时,会引起细胞内氧化应激反应、脂质代谢异常、钙离子超载等细胞内环境紊乱,均会引起过度内质网应激,会触发细胞内未折叠蛋白质反应 (UPR)[10]。
UPR可通过解除GRP78与3种内质网跨膜蛋白的结合,从而启动下游信号通路,PERK蛋白是三者之一,受到内质网应激而激活分离出的PERK蛋白又能诱导CHOP蛋白表达,它为细胞凋亡途径的重要标志性蛋白,随后内质网应激持续过度存在将继续激活半胱天冬酶级联反应,最终引起肝细胞凋亡[11-13]。前期预实验显示,原代肝细胞PERK/eIF2α凋亡信号通路是肝细胞内质网应激凋亡途径中最主要的,故本实验选择内质网应激中该凋亡信号通路作为研究对象,发现硫酸铜模拟的铜负荷可引起肝细胞内质网应激,最终导致肝细胞凋亡,而肝豆灵片可抑制上述现象,并且可显著抑制TX小鼠原代肝细胞凋亡及PERK、p-eIF2a蛋白表达,显著降低CHOP mRNA水平,这些分子均为PERK/eIF2α/CHOP凋亡信号通路的关键信号物质。
中医认为[14],Wilson病的外在病因为铜中毒,其主要内在病因为先天禀赋不足,机体阴阳平衡失调,脏腑功能紊乱,从而导致肝气不能正常疏泄,胆汁不能正常分泌,气运不能通达,最终导致铜毒邪内蕴不能正常向外排泄,蕴积体内化瘀化热,并且产生铜中毒,铜浊毒邪蓄积于人体各个脏腑、组织并产生相应症状,若毒邪经久不去,停滞于体内,则损伤脏腑及经络,积聚不能散除,经脉络脉闭塞,气运不畅,从而气机阻滞,痰随气阻,血行不畅,痰浊与瘀血相结,故该病的主要病理机制为铜毒邪内蕴体内,痰浊瘀血阻滞经脉。安徽中医药大学第一附属医院院内制剂肝豆灵片具有清热解毒、化瘀通腑的作用[14],由川黄连、紫丹参、血风藤、蜀大黄、蓬莪术、毛姜黄等药材组成,具有保护Wilson病模型TX小鼠肝细胞功能的作用[15],其机制可能与上调肝细胞组织miRNA-122表达有关;对铜负荷大鼠肝细胞损伤具有较好的干预作用,其机制可能与下调 Bax表达、上调 Bcl-2表达有关[16];对Wilson病模型铜负荷大鼠的肝细胞的损伤具有一定保护及修复作用,其机制可能与调节胆汁酸和氨基酸代谢、改善脂质代谢有关[17];近年来还发现,它减轻铜负荷大鼠肝细胞的保护作用机理可能与下调肝细胞组织NF1cB和Caspase-3表达、抑制肝细胞凋亡相关[18],与本实验结果基本一致。由此可认为,肝豆灵片改善Wilson病小鼠肝损害作用与其清热解毒、化瘀通腑、解毒排铜功效有关,分子生物学机制主要是通过干预内质网应激 PERK/eIF2α/CHOP凋亡信号通路来保护肝细胞。
然而,本实验未检测代表细胞凋亡外源性途径[19]、线粒体途径等相应关键信号通路标志物的表达[20],无法明确在铜负荷诱导肝细胞凋亡过程中2种途径的作用,以及两者与内质网应激凋亡途径信号通路相关交叉作用,需作进一步实验研究。
——以硫酸铜饱和溶液析出晶体的计算为例

