11S通过NF-κB信号通路引起猪小肠上皮细胞损伤
彭成璐,张 瑜,丁雪东,李 玉,冯士彬,王希春,李锦春,吴金节
(安徽农业大学 动物科技学院,安徽 合肥230061)
大豆球蛋白是大豆中最大的单体成分,其主要成分11S球蛋白占大豆籽实总蛋白的19.5%~23.1%,占总球蛋白的40.0%[1]。大豆球蛋白由5个亚基组成,分别被命名为A1aB2 (G1)、A1bB1b (G2)、A2B1a (G3)、A3B4 (G4)和A5A4B3 (G5),每个亚基由碱性多肽(约20 ku)和通过二硫键连接的酸性多肽(约40 ku)组成[2-3]。大豆蛋白质中的大多数抗原表位存在于大豆球蛋白的酸性亚基中[4-5]。含有大豆蛋白的日粮饲喂仔猪后,大部分的11S(大豆球蛋白)和7S(β-伴大豆球蛋白)被消化酶降解成不具有抗原性的肽和氨基酸,然后被机体吸收;一些未消化的11S和7S可以进入肠道抑制肠细胞增殖,损伤细胞骨架,引起小肠细胞凋亡,或者经肠道消化后,小部分抗原蛋白能完整地进入淋巴和血液中,引发肠道过敏[3,6-7]。肠道是机体与外界环境接触最为密切的部位,不仅是消化、吸收营养物质的重要场所,也是机体的重要免疫屏障[8]。小肠上皮细胞的增殖、迁移、分化、凋亡的动态平衡是肠屏障功能正常发挥的前提和基础[9]。然而,细菌产物、毒素和其他过敏原的病理性吸收不仅能够激活免疫细胞,而且直接影响肠上皮细胞的功能[10]。
吡咯烷二硫代氨基甲酸盐(PDTC)是一种小分子巯基化合物,它具有改变氧化还原状态、重金属的螯合及抑制酶等作用。PDTC现被用作NF-κB的强效抑制剂,它既能抵抗自由基的毒性作用,也能抑制促炎性细胞因子的生成[11]。Nω-硝基-L-精氨酸甲酯(L-NAME),属于一种非特异性一氧化氮合酶(NOS)抑制剂,能同时抑制神经元型一氧化氮合酶(nNOS)、内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶(iNOS)的表达[12]。
猪小肠上皮细胞(IPEC-J2)来源于仔猪空肠上皮,其功能包括消化食物、吸收营养物质、分泌消化液和免疫屏障等[6],是非转化的非致瘤性肠上皮细胞系,具有与体内活性相当的分化特征,适用于体外模型[13]。本研究在前期研究的基础上,通过体外培养猪小肠上皮细胞,在分子水平上研究不同浓度11S、PDTC和L-NAME对猪小肠上皮细胞存活率以及相关炎性因子、蛋白和mRNA表达量的影响。
1 材料与方法
1.1 材料
11S由中国农业大学食品工程学院提供,安徽农业大学动物科技学院进一步提纯(11S纯度为90.8%)。IPEC-J2购自武汉市农业科学院细胞库。BCA蛋白浓度测定试剂盒购自Biosharp,β-actin抗体购自北京锐抗生物科技有限公司,羊抗兔和羊抗鼠二抗购自Biosharp,p-NF-κB抗体购自Santa cruz,诱导型iNOS和环氧化酶2蛋白(COX-2)抗体购自Novus,PDTC和L-NAME购自碧云天生物技术公司。白细胞介素6(IL-6)、一氧化氮(NO)、5-羟色胺(5-HT)、白细胞介素10(IL-10)、二胺氧化酶(DAO)ELISA试剂盒购自江苏酶标生物有限公司。
1.2 方法
将对数生长期的IPEC-J2细胞,以1×105mL-1的密度接种于6孔细胞培养板。置于37 ℃、5%(体积分数)CO2饱和湿度下培养至细胞贴壁。将细胞分为6组:A(对照组)、B (1 mg·mL-111S)、C (5 mg·mL-111S)、D(10 mg·mL-111S)、E(5 mg·mL-111S+1 μmol·L-1PDTC)和F(5 mg·mL-111S+1 μmol·L-1L-NAME),各组中分别添加0、1、5、10、5、5 mg·mL-1的11S,并且在E组和F组分别添加1 μmol·L-1NF-κB p65(PDTC)和1 μmol·L-1iNOS(L-NAME)抑制剂。每组均设置3个重复(预实验发现D组存活率过低,C组适中,因此选用C组作为对照组添加抑制剂)。
1.3 细胞存活率
在各组猪小肠上皮细胞中添加不同浓度的11S和抑制剂后继续培养8、16、24 h,之后向每孔中加入10 μL CCK-8试剂,放入细胞培养箱中继续培养,直至出现明显的颜色反应。在酶标仪450 nm波长下读取吸光度,计算细胞存活率。
1.4 5-HT、IL-6、IL-10、NO和DAO含量测定
猪小肠上皮细胞经过不同浓度11S和相应抑制剂处理培养24 h后,收集细胞,1 000g离心5 min,用PBS洗涤3次。之后向每个样品中加入500 μL含0.1%(体积分数)Triton X-100的0.1 mol·L-1Tris-HCl(pH=7.4),将样品放入0 ℃水中进行超声裂解。将细胞裂解液以1 000g离心10 min,收取上清液。按照ELISA试剂盒说明书中详细操作步骤进行测定,计算5-HT、IL-6、IL-10、NO和DAO的含量。
1.5 Western blot法检测p-NF-κB p65、iNOS、COX-2蛋白表达量
收集猪小肠上皮细胞,加入混有蛋白酶抑制剂和蛋白磷酸酶抑制剂的RIPA裂解液,漩涡振荡器混合均匀,置于冰上20 min使细胞充分裂解。之后14 000g离心10 min,收集上清液。按照BCA蛋白浓度测定试剂盒说明书进行操作,并根据标准曲线算出蛋白浓度。将提取的蛋白质样品煮沸5 min,在SDS-PAGE凝胶中电泳,然后转移到PVDF膜。用牛血清白蛋白(BSA)在室温下封闭膜4 h,后放入一抗在4 ℃孵育过夜。将膜洗涤3次,并用二抗在室温下水平震荡孵育45 min,洗膜后放入凝胶成像系统(Bio-Rad)中成像。
1.6 qPCR法检测NF-κB p65、iNOS、IKKβ、IKKα和COX-2 mRNA相对表达量
目的基因及β-actin内参引物序列由生工生物工程(上海)股份有限公司合成,采用2-ΔΔCt法计算mRNA的转录水平,引物序列及参数见表1。
1.7 数据处理
2 结果与分析
2.1 11S对猪小肠上皮细胞存活率的影响
由图1可知:各组猪小肠上皮细胞活性差异在处理24 h时最显著,细胞的存活率随着11S浓度的增加而降低。与A组相比,B组细胞存活率无显著差异(P>0.05),C、D组细胞存活率极显著降低(P<0.01)。与C组相比,E、F组细胞存活率显著增加(P<0.05)。
2.2 11S对猪小肠上皮细胞生长状态的影响
由图2可知:A组细胞多为不规则多边形,轮廓清晰,贴壁状态良好。随着11S浓度增加,B、C、D组贴壁细胞数量减少,部分细胞脱落,形态异常。与C组相比,E、F组贴壁不完全的细胞较少,脱落细胞较少。
2.3 11S对猪小肠上皮细胞NO、5-HT、IL-6、IL-10和DAO含量的影响
由图3可知:处理24 h后,与A组相比,B组NO含量显著升高(P<0.05),IL-10含量显著降低(P<0.05),C、D组NO、5-HT、IL-6、DAO含量极显著升高(P<0.01),IL-10含量极显著降低(P<0.01)。与C组相比,E、F组NO、5-HT、IL-6、DAO含量极显著降低(P<0.01),IL-10含量极显著升高(P<0.01)。
表1基因引物参数
Table1Primer parameters of genes

基因Gene登录号Accession No.引物Primer序列(5′→3′)Sequences (5′→3′)产物Product/bpNF-κB p65ID: 100514505ForwardCTCGCTCGCACTCTTGCTCTC168ReverseAATAGGCGGACGAGGCAGAAGiNOSNM_001143690.1ForwardGGGTCAGAGCTACCATCCTC114ReverseCGTCCATGCAGAGAACCTTGIKKβNM_001099935.1ForwardACCTGGCTCCCAACGACTT184ReverseAGATCCCGATGGATGATTCTGIKKαNM_001114279.1ForwardCACTCTTACAGCGACAGCAC145ReverseCCACCTTGGGCAGTAGATCACOX-2NC_000845.1ForwardTGCACGGCGGCAATATTAAA156ReverseAGTGGAAGTGTGCGACTACAactin414396ForwardCTGGACTTCGAGCAGGAGATGG168bpReverseTTCGTGGATGCCGCAGGATTC
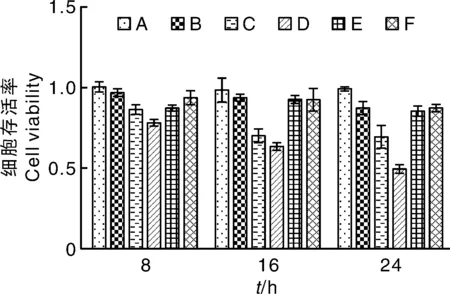
A,对照; B,1 mg·mL-1 11S;C,5 mg·mL-1 11S;D,10 mg·mL-1 11S;E,5 mg·mL-1 11S+1 μmol·L-1 PDTC;F,5 mg·mL-1 11S+·1 μmol·L-1 L-NAME。下同。A, control group; B, 1 mg·mL-1 11S; C, 5 mg·mL-1 11S; D, 10 mg·mL-1 11S; E, 5 mg·mL-1 11S+1 μmol·L-1 PDTC; F, 5 mg·mL-1 11S+1 μmol·L-1 L-NAME. The same as below.图1 猪小肠上皮细胞存活率Fig.1 Viability of porcine intestinal epithelial cell
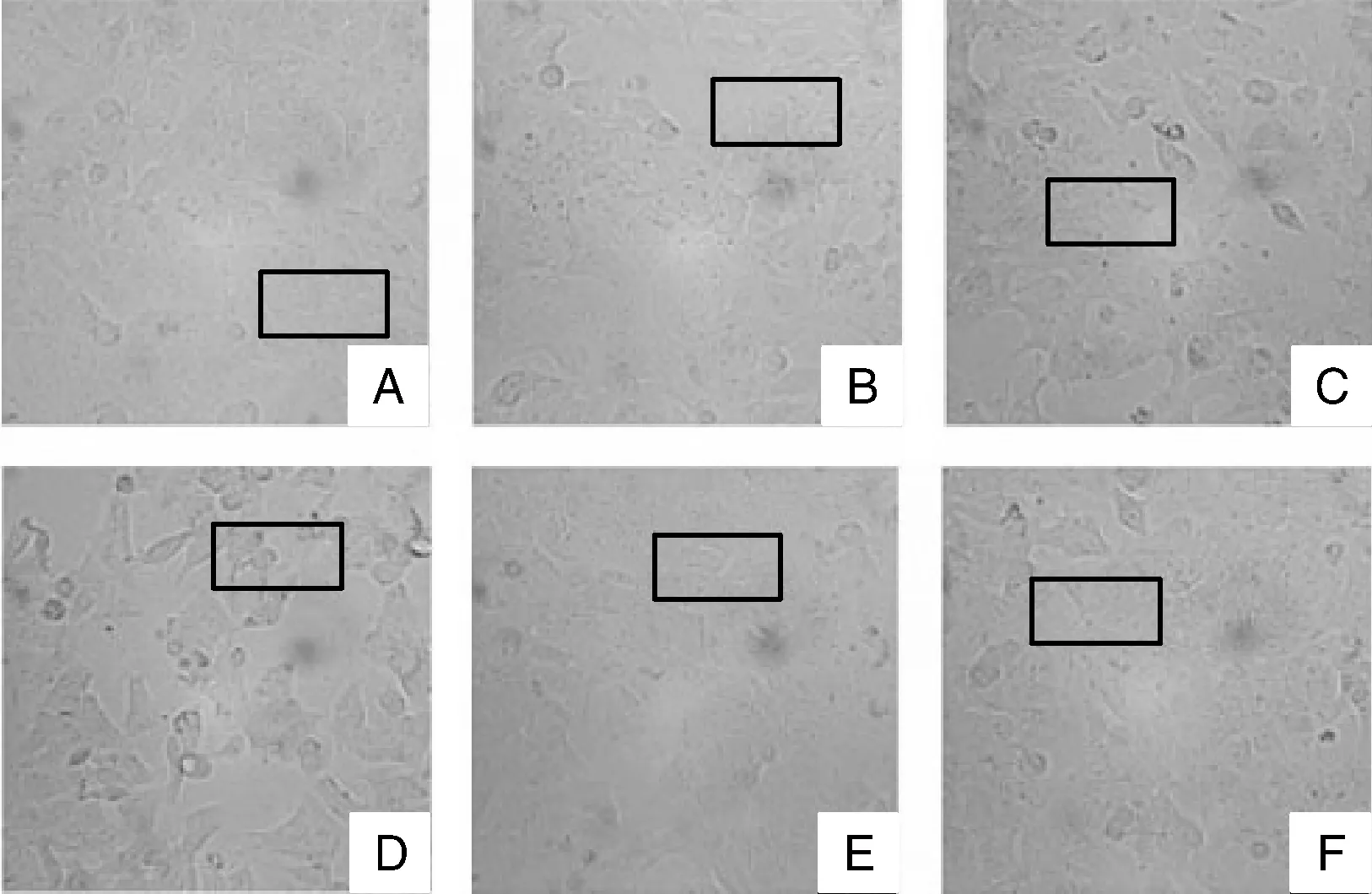
黑色方框表示具有代表性的区域。Black square frame represented typical area.图2 11S对细胞生长状态的影响(400×)Fig.2 Effect of 11S on growth state of porcine intestinal epithelial cell (400×)
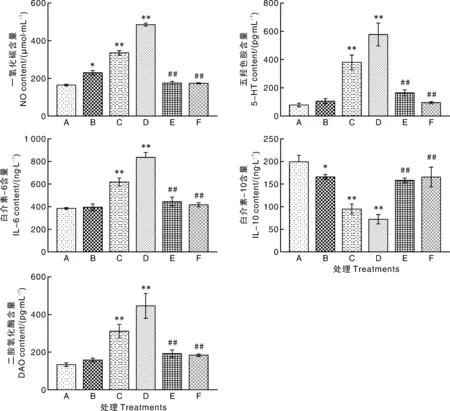
*和**表示与对照组相比,差异显著(P<0.05)和极显著(P<0.01);##表示与C组相比,差异极显著(P<0.01)。下同。* and ** indicated significant differences at P<0.05 and P<0.01 compared with control group;## indicated significant differences at P<0.01 compared with group C. The same as below.图3 11S对猪小肠上皮细胞NO、5-HT、IL-6、IL-10和DAO含量的影响Fig.3 Effect of 11S on NO, 5-HT, IL-6, IL-10 and DAO contents in porcine intestinal epithelial cell
2.4 11S对猪小肠上皮细胞p-NF-κB p65、iNOS和COX-2蛋白表达量的影响
如图4所示,处理24 h后,与A组相比,C、D组p-NF-κB p65、iNOS和COX-2蛋白表达量显著或极显著升高(P<0.05或P<0.01);与C组相比,E、F组显著或极显著降低(P<0.05或P<0.01)。
2.5 11S对猪小肠上皮细胞NF-κB p65、iNOS、IKKβ、IKKα和COX-2 mRNA相对表达量的影响
如图5所示,处理24 h后,与A组相比,B组NF-κBp65、iNOS、COX-2 mRNA相对表达量显著(P<0.05)或极显著(P<0.01)升高,C、D组NF-κBp65、iNOS、COX-2 mRNA相对表达量极显著升高(P<0.01)。与C组相比,E、F组NF-κBp65、iNOS、COX-2 mRNA相对表达量极显著降低(P<0.01)。
3 结论与讨论
本研究结果表明,11S通过NF-κB信号通路引起猪小肠上皮细胞损伤,促进细胞分泌NO、5-HT和IL-6,抑制IL-10的分泌,增加p-NF-κB p65、iNOS和COX-2的蛋白表达量及NF-κBp65、IKKβ、iNOS、IKKα和COX-2 mRNA的相对表达量,添加PDTC和L-NAME后抑制了11S对细胞的损伤作用。
Sun等[14]研究发现,11S可通过诱导超敏反应、结合于动物肠道组织来影响动物肠道健康,其诱导的超敏反应主要是一个Th2型的免疫应答,由IgE抗体介导,可导致仔猪腹泻和生产性能降低,过敏性反应的严重程度取决于11S的剂量。徐君[2]用不同浓度的大豆抗原蛋白处理小鼠肠上皮细胞,小鼠肠上皮细胞总数量减少,不规则形状和轮廓不清晰的细胞明显增多,细胞脱落程度加大。本试验在各组猪小肠上皮细胞中添加不同浓度的11S后,猪小肠上皮细胞的存活率及贴壁细胞数量随着11S浓度的增加和培养时间的延长而降低,添加5 mg·mL-111S+1 μmol·L-1PDTC或5 mg·mL-111S+1 μmol·L-1L-NAME的处理细胞存活率及贴壁细胞数量高于仅添加5 mg·mL-111S的处理。韩蕊[6]用不同浓度的11S处理猪小肠上皮细胞24 h,随着11S浓度的升高,猪小肠上皮细胞的存活率显著降低,本实验结果与此相一致。说明11S引起猪小肠上皮细胞损伤,PDTC或L-NAME可以抑制11S引起的损伤。
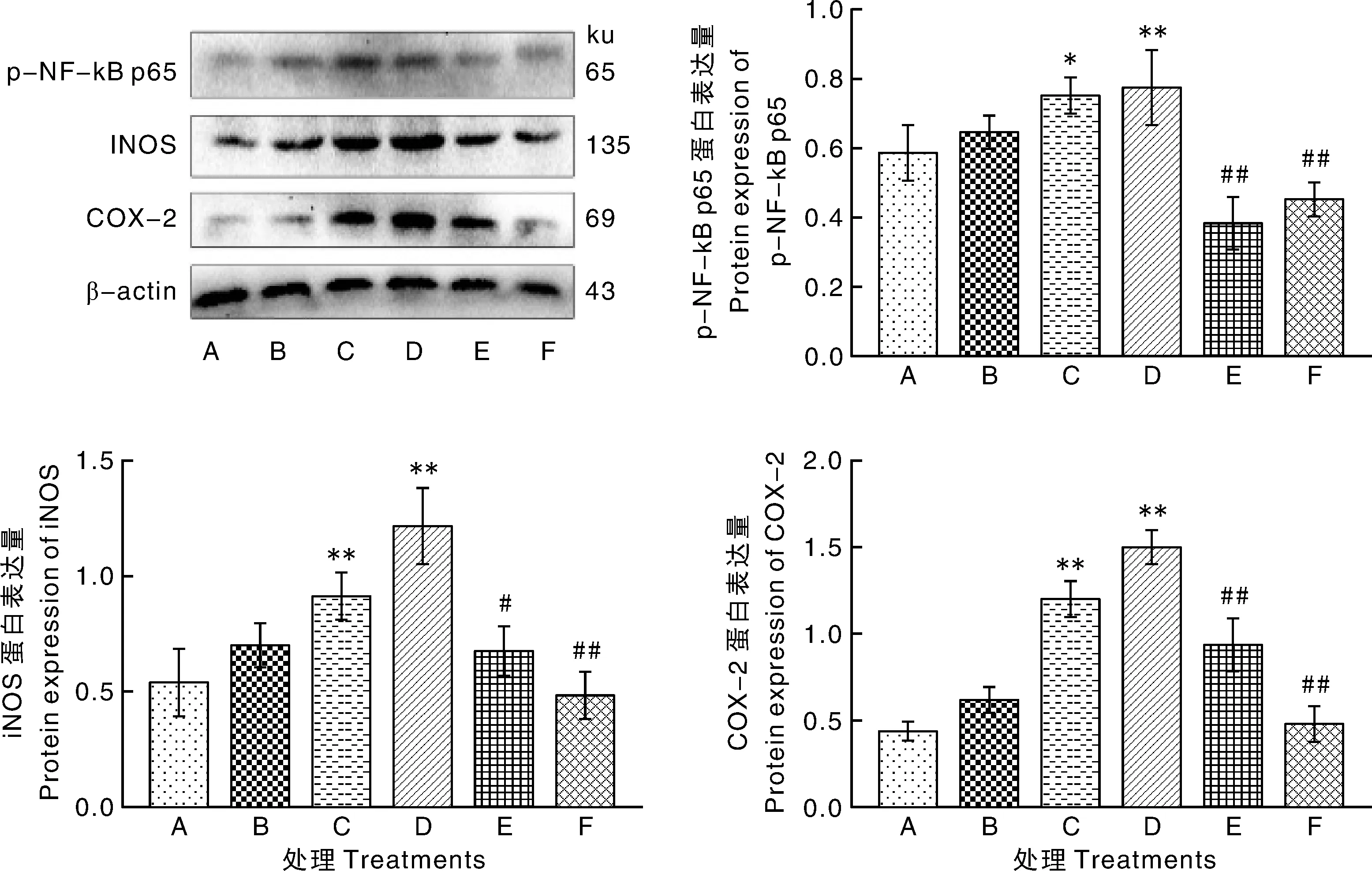
图4 11S对猪小肠上皮细胞p-NF-κB p65、iNOS和COX-2蛋白表达量的影响Fig.4 Effect of 11S on expression of p-NF-κB p65, iNOS and COX-2 proteins in porcine intestinal epithelial cell
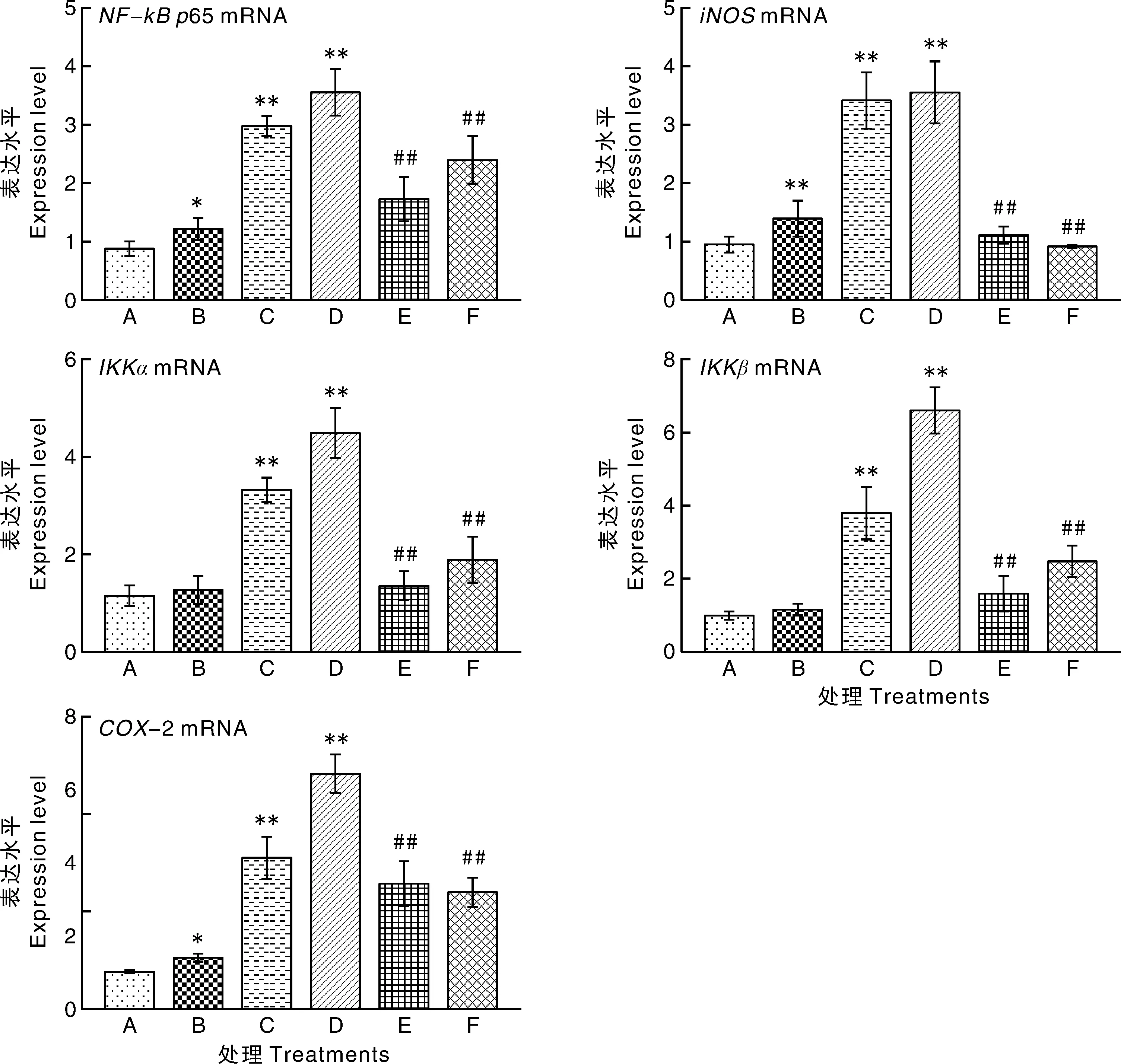
图5 11S对猪小肠上皮细胞NF-κB p65、iNOS、IKKβ、IKKα和COX-2 mRNA的影响Fig.5 Effect of 11S on relative expression of NF-κB p65, iNOS, IKKβ, IKKα and COX-2 mRNA in porcine intestinal epithelial cell
DAO主要分布于哺乳动物肠道(占95%),活性高,以空肠和回肠活性最高,是哺乳动物肠绒毛上皮细胞的标记酶,其活性与绒毛高度、黏膜细胞的核酸和蛋白质密切相关,可作为判断肠黏膜屏障功能损伤的敏感指标[15-17]。本试验中,随着11S浓度增加,DAO含量极显著升高,添加抑制剂后DAO含量极显著降低。曹程鸣等[18]通过体内试验发现,大豆抗原蛋白可以降低仔猪肠道绒毛长度,增加断奶仔猪血浆DAO水平,本试验结果与此一致。
张建中等[19]研究发现,大豆抗原蛋白对断奶仔猪肠道造成损伤的原因可能与其提高肠道黏膜NF-κB活性,引起细胞因子过度表达,导致肠道炎症反应有关。本试验发现,11S可诱导猪小肠上皮细胞p-NF-κB p65、iNOS和COX-2蛋白表达和NF-κBp65、iNOS、COX-2、IKKα和IKKβmRNA的相对表达量,在5 mg·mL-111S的基础上,添加PDTC和L-NAME后11S的作用受到抑制。说明PDTC和L-NAME可以通过抑制NF-κB信号通路进而抑制11S对猪肠上皮细胞的损伤。王新等[20]研究发现,给大鼠胃内注射L-NAME抑制剂,能使肝硬化大鼠胃肠道中各型NOS的表达减少,这说明L-NAME抑制剂能干预调节NOS的表达,本研究结果与此一致。周艳梅[11]研究发现,PDTC既能抵抗自由基的毒性作用,又能抑制促炎性细胞因子的生成。本试验ELISA检测发现,随着11S浓度增加,NO、5-HT、IL-6含量极显著升高,添加抑制剂后显著降低。刘欣[21]通过灌胃小鼠11S和7S,发现小鼠小肠组织中IL-10 mRNA的表达量降低,本试验结果与此一致。NO诱导细胞凋亡的机制主要在于激活凋亡的死亡受体途径和线粒体凋亡途径[19],NO还能够影响炎症反应的进程,进而影响IL-6、组胺、5-HT、TNF-α等炎症因子的表达[22],本试验结果与此一致。表明11S激活通过NF-κB信号通路,促进炎性因子分泌,造成猪肠上皮细胞损伤,PDTC和L-NAME可以抑制这种损伤。11S引起的细胞损伤由多个信号通路介导,各个通路之间的相互作用及影响还有待研究。

