黄心乌20 ℃贮藏期间不同部位品质劣变及生理生化变化
,,,,
(1.安徽师范大学环境科学与工程学院,安徽芜湖 241003; 2.南京师范大学金陵女子学院,江苏南京 210097; 3.南京农业大学食品科学技术学院,江苏南京 210095)
乌塌菜(Brassicacampesttrisssp.chinesis(L.)Makinovar. rosularis Tsen et Lee),又名乌菜、塌棵菜等,是不结球白菜的一个变种,为十字花科芸薹属芸薹种白菜亚种的一个变种,起源于中国,在我国长江中下游地区栽培普遍[1]。《食物本草》中载:“乌塌菜甘、平、无毒”,能“滑肠、疏肝、利五脏”。乌塌菜地方品种资源丰富,有黄心乌、黑心乌、宝塔乌、柴乌等百十个品种,其中黄心乌种植面积最广,深受消费者欢迎[2]。黄心乌塌地而生,叶色外绿内黄,心叶反卷呈黄色,形如盛开的菊花,因黄心乌生长季节气候冷凉,极少用农药,拥有“无公害蔬菜”之美誉。
由于黄心乌种植地域的特异性,国外对它的研究报导较少。目前国内研究主要集中在黄心乌的生物学特性[3]、栽培技术[4]、育种技术[5]等方面,取得了许多成果。而很少有报道关于黄心乌采后贮藏期间外观、营养和生理生化的变化。
黄心乌采后呼吸旺盛,外叶逐渐变黄,内叶出现深黄色斑点,导致外观品质迅速下降,极大地影响了黄心乌的食用和加工品质。由于我国黄心乌生产管理模式还不成熟,缺乏配套的冷链输送系统,因此本文主要研究黄心乌采后20 ℃贮藏期间绿色的外叶、淡绿微黄的内叶和白色的茎三个部位的品质及生理生化变化规律,阐明黄心乌采后品质劣变的生理生化基础,为黄心乌生产贮运中控制其品质劣变提供理论依据和实践指导。
1 材料与方法
1.1 材料与仪器
黄心乌 采摘于安徽芜湖北埂桥种植地,品种为南京绿领,黄心乌外层叶片绿色,内层浅绿微黄,叶茎白色,挑选新鲜、无烂斑、无病虫害、无机械损伤、个体大小和成熟度一致的黄心乌采摘,并保留2~3 cm根部,采后立即放入盛有冰块的泡沫箱内,2 h内运回实验室;15 mm PE保鲜膜(65 cm×75 cm) 广州家亮化工有限公司;乙醇、丙酮、石英砂、碳酸钙、2,4-二硝基苯肼、十六烷基磺酸钠、硫酸、草酸、氢氧化钠、碳酸氢钠、十二水磷酸氢二钠、磷酸二氢钠、邻苯二酚、对氨基苯磺酸、盐酸羟胺、硫代巴比妥酸、二硫苏糖醇、氮蓝四唑、核黄素、愈创木酚 均为分析纯(≥99.5%),芜湖标科试验器材有限公司;石英砂 ≥95%,芜湖标科试验器材有限公司。
752型紫外分光光度计 上海佑科仪器仪表有限公司;TGL-20 M型冷冻离心机 湘仪科学仪器厂;Minolta-CR 400色差仪 日本美能达公司;HSU-80手持式糖度仪、LHS-250 SC恒温恒湿箱 上海精密仪器仪表有限公司;KW-1000 DC恒温水浴锅 江苏金坛市亿通电子有限公司。
1.2 实验方法
1.2.1 样品前处理 将黄心乌用保鲜袋按每袋6~8颗装,共重复装15袋,每袋约1200 g左右,挽口(保鲜膜挽口可以抑制蒸腾,在一定程度上降低呼吸,而封口势必会造成无氧呼吸),置于(20±2) ℃,相对湿度为75%的恒温恒湿箱内贮藏,每天测定相关指标。
固定3个装有黄心乌的保鲜袋用来测定外观指标(色泽、黄化指数、腐烂指数和外观指数)和呼吸速率,另外12袋用来测定黄心乌品质和生理指标。从12个保鲜袋中分别随机挑选1颗(200 g左右),然后按照绿色的外叶、淡绿微黄的内叶、白色的茎3个部位分别取样,靠近黄心乌菜心向外数第1、2层的黄色叶子为内叶,以黄心乌向内数第2、3层的绿色叶子为外叶,叶片摘掉剩余的柄部混合为茎。
1.2.2 黄心乌贮藏期间品质和生理生化指标测定方法
1.2.2.1 色差 用CIELab表色系统测定样品的L*(明度,反映色泽的明度,从 0~100 变化,0 代表黑色,100 代表白色),色泽角H值(H=180,绿色;H=90,黄色)。测定时每个叶片或茎分别选取顶部和周边4点,选取20个叶片或茎。
1.2.2.2 叶绿素含量 叶绿素的测定参考Song[6]的方法。称取样品0.5 g于研钵中,加石英砂、碳酸钙粉及95%乙醇5 mL研磨,用95%乙醇定容到10 mL,高速冷冻离心(4 ℃、12000 r/min)10 min后取上清液,在665、649 nm处测吸光度。
1.2.2.3 黄化指数 黄化指数的测定参考Song[6]的方法。根据叶片黄化面积占总叶面积的百分率(黄化面积率)对叶片分级。0级,黄化面积率为0;1级,黄化面积率≤ 5%;2级,5%<黄化面积率≤ 10%;3级,10%<黄化面积率≤ 25%;4级,25%<黄化面积率≤ 50%;5级,黄化面积率> 50%。计算见下列公式:
黄化指数(%)=[∑(黄化级别×对应级别叶片个数)]/(总叶片个数×最高黄化级别)×100
1.2.2.4 腐烂指数 腐烂指数的测定参考Song[6]的方法。根据叶片腐烂面积占总叶面积的百分率(腐烂面积率)对叶片分级。0级,无腐烂出现;1级,腐烂面积<25%;2级,25%<腐烂面积≤ 50%;3级,腐烂面积> 50%。计算见下列公式:
腐烂指数(%)=[∑(腐烂级别×对应级别叶片个数)]/(总叶片个数×最高腐烂级别)×100
1.2.2.5 失重率 采用称量法进行测定,计算见下列公式:
失重率(%)=(样品贮藏前重量-试验测定重量)/样品贮藏前重量×100
1.2.2.6 外观指数 根据Li等[7]制定的感官评价标准,结合黄心乌的特点,制定感官评价表(表1)。采用7分制(1分极端不好;2分非常不好;3分不好;4分一般;5分好;6分非常好;7分极端好),挑选培训过的20名评价员对不同组别、不同贮藏时间的黄心乌进行评分,取其平均值。

表1 黄心乌感官评价标准Table 1 Sensory evaluation standard of yellow heart cabbage
1.2.2.7 主要营养成分的测定 可溶性糖含量(TSS)参考吴雪俊[8]的方法。
VC含量采用2,4-二硝基苯肼法测定(GB/T 5009.86-2003 蔬菜、水果及其制品中总抗坏血酸的测定)。
可溶性蛋白质含量采用 GB5009.5-2010测定。
纤维素含量采用酸性洗涤法测定[9]。称取样品5.0 g,加入100 mL的十六烷基三甲基溴化铵酸性洗涤剂100 ℃回流1.0 h,趁热过滤,热蒸馏水(95~100 ℃)洗涤三次,再用丙酮洗三次,于100 ℃烘干,称重。计算出每100 g鲜重的样品所含纤维素的克数。计算见下列公式:
纤维素(%)=(样品重量-洗涤后烘干至恒重的样品重量)/样品重量×100
1.2.2.8 呼吸速率 参考Song[6]的方法。吸取0.4 mol/L NaOH溶液20 mL于培养皿中,立即放入干燥器中,把黄心乌样品放在隔架上,密闭1 h后取出培养皿,将培养皿中的NaOH用漏斗小心地移入250 mL三角瓶中,用重蒸馏水冲洗培养皿3~4次,再加入饱和BaCl2溶液5 mL和酚酞2滴,用0.100 mol/L草酸滴定至终点,以不放样品的空白组为对照,采用相同的步骤滴定。计算见下列公式:
呼吸速率(CO2mg kg-1·h-1)=[(样品消耗草酸的体积-空白消耗草酸的体积)×草酸的摩尔浓度×44]/(样品重量×测定时间)


称取黄心乌2.0 g于碾钵中,加入5%三氯乙酸(TCA)5.0 mL,在冰浴上研磨匀浆,转移至离心管3000 r/min,4 ℃离心10 min。取上清液2 mL,加0.67%硫代巴比妥酸(TBA)2.0 mL,混匀后于100 ℃水浴30 min,冷却后,4 ℃再次离心10 min(3000 r/min),弃去沉淀,分别测定上清液在450、532、600 nm处的消光值,计算出MDA的含量。计算见下列公式:
MDA浓度(μmol·L-1)=6.45(A532-A600)-0.56A450
MDA含量(μmol·g-1)=(MDA浓度×提取液总体积)/(测定用样品液体积×样品质量×1000)
1.2.2.10 抗氧化酶活性的测定 过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的测定参考Luo[9]方法。POD以愈创木酚法进行测定,以每分钟在470 nm处的吸光度变化0.01为1个活力单位;SOD活性以抑制NBT光还原50%为1个酶活力单位;CAT以反应液每分钟在240 nm处吸光值变化0.001为1个酶活力单位。酶活的结果表示为U·min-1·g-1FW。
1.3 数据处理
试验每个处理均重复三次,并使用统计软件SPSS 18.0及Excel进行显著性和相关性分析。
2 结果与分析
2.1 黄心乌贮藏期间不同部位色泽、叶绿素含量和黄化指数的变化
南京绿领黄心乌外层叶片绿色,内层叶片浅绿微黄,茎白色,因此本试验选择色泽角H值表示贮藏期间叶片由绿色向黄色的转变程度,L*表示白色茎的变化情况。由图1(a)可知,随着贮藏时间的延长,黄心乌叶片H值不断下降,贮藏至第5 d时,外叶组和内叶组的H值分别下降5.1%、2.9%,表明黄心乌采后外叶和内叶的色泽都有黄化趋势。Xu等[10]对青花菜的研究结果同样表明,采后青花菜色泽H值不断下降,黄化现象加重。从图1(b)可以看出,茎的L*值在贮藏期间不断下降,这也说明了黄心乌采后茎逐渐由亮白色转变成灰白色。
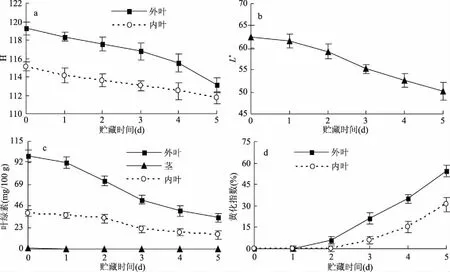
图1 黄心乌20 ℃贮藏期间不同部位色泽H值(a)、明度L*值(b)、叶绿素含量(c)和黄化指数(d)的变化Fig.1 H value(a),L* value(b),chlorophyll content(c)and etiolation index(d) change in different parts of yellow heart cabbage during storage at 20 ℃
叶绿素是构成绿色蔬菜叶片颜色的主要色素。图1(c)显示,黄心乌外叶和内叶的叶绿素含量都不是十分高,外叶为99.46 mg/100 g,内叶仅为38.45 mg/100 g,低于空心菜(197.37 mg/100 g)[11]、菠菜(152.21 mg/100 g)[12]的叶绿素含量,贮藏期间外叶和内叶的叶绿素持续下降。黄心乌茎的叶绿素含量较低,刚采摘的叶绿素含量仅有0.6 mg/100 g,贮藏前2 d不断下降,之后稍有增加,可能是贮藏后期茎中有新的叶绿素合成。
图1(d)显示,外叶在贮藏第2 d出现较为明显的黄化现象,贮藏结束时个别外叶整片黄化;内叶在3 d后出现黄化斑点,且斑点数量和面积逐渐增多,这与实验中观察到的现象一致。表明黄心乌的绿色外叶和浅绿微黄内叶在贮藏期间都存在黄化现象,且随着贮藏时间的延长,外叶和内叶的黄化指数都大幅度上升。
2.2 黄心乌贮藏期间不同部位腐烂指数的变化
腐烂指数是衡量蔬菜腐烂程度的重要指标。由图2可知,黄心乌外叶在贮藏第3 d时最先出现局部小面积的腐烂,内叶和茎在第4 d开始腐败;贮藏结束时黄心乌外叶组、内叶组和茎组的腐烂指数分别达到36.9%、27.8%、18.5%。外叶组的腐烂指数在整个贮藏过程中是最大的,原因可能是外叶位于黄心乌的最外部,且叶片舒展,受到微生物的浸染的面积最大;内叶腐烂指数相对较低,可能与其处在黄心乌菜的内部,机械外伤较少有关,也可能是由于内叶组织的自身免疫能力强于其他部位。
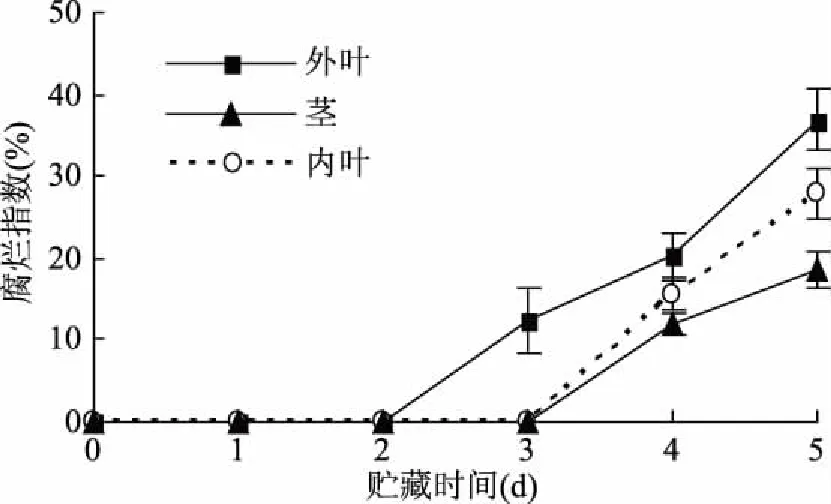
图2 黄心乌20 ℃贮藏期间不同部位腐烂指数的变化Fig.2 Decay index change in different parts of yellow heart cabbage during storage at 20 ℃
2.3 黄心乌贮藏期间失重率和外观指数的变化
新鲜蔬菜失重率达到 3%~5%就可导致萎蔫,失去新鲜状态[14]。图3(a)显示,贮藏期间黄心乌失重率不断上升,前2 d上升速率较缓,2 d后水分散失猛增,在贮藏第4 d时黄心乌水分损失达到5.03%,超过了5%的公认水平,叶片出现轻微的萎蔫。贮藏5 d后水分损失达到6.79%,黄心乌出现较明显萎蔫现象,食用品质急剧下降。
感官评分是反映蔬菜品质变化最直观的指标。由图3(b)可知,随着贮藏时间的延长,黄心乌的感官品质逐渐下降。贮藏第3 d,黄心乌的叶片和茎已出现黄化和腐烂现象,感官评分为5.0,感官品质尚好;第4 d,黄心乌感官评分为4.1,仍具有商品价值。贮藏结束时,黄心乌个别叶片出现面积较大的黄化和腐烂现象,感官评分为3.12,已超过消费者可接受的程度,丧失商品价值,但尚有食用的价值,此时的外叶和内叶的黄化指数分别为35%,15%;外叶、内叶和茎的腐烂指数分别为20%、15%、12%。

图3 黄心乌20 ℃贮藏期间失重率(a)和外观指数(b)的变化Fig.3 Weight loss(a)and appearance index(b)change of yellow heart cabbage during storage at 20 ℃
黄心乌外观指数和失重率存在负相关关系(外叶r=-0.9062**,内叶r=-0.8573**,茎r=-0.9792**,p<0.05),说明水分散失对黄心乌外观品质有显著影响。
2.4 黄心乌贮藏期间不同部位可溶性糖、VC、可溶性蛋白质和纤维素含量的变化
可溶性糖、蛋白质和VC都是黄心乌菜内的重要营养成分,它们的变化可以反映黄心乌贮藏效果的优劣及其衰老的程度。
从表2可知,黄心乌刚采摘时叶片的可溶性糖含量较高(外叶8.16%,内叶10%),与周玉丽对乌塌菜不同品种可溶性糖含量的研究结果一致[15]。黄心乌TSS含量贮藏前2 d持续上升,之后迅速下降,第2 d达到最高值。贮藏前期TSS含量上升可能是一部分总糖水解成了可溶性糖,而后期TSS含量快速下降可能是呼吸消耗速率大于分解速率所致。贮藏期间内叶的TSS含量始终最高,外叶次之,茎含量最低。黄心乌贮藏过程中VC和蛋白质持续下降,其中内叶的VC和可溶性蛋白质含量始终最高,外叶组次之,茎组最低,组间差异显著(p<0.05)。由于VC具有一定的抗氧化性质,能清除组织内的自由基,这可能也是内叶能够更好地维持其新鲜品质的原因之一。王玉婵等[16]的研究表明,白子菜叶中的营养价值和药用成分远大于根和茎。张德双等[17]发现不同白菜叶片中,软叶和茎的营养成分由外向内逐渐增加;同一叶片中,软叶的营养价值高于茎。本实验表明,刚收获时黄心乌主要营养成分的含量十分丰富,大于菠菜[18]、青菜[19]、油菜[19]等一般的深绿色叶菜类,其中叶片的营养价值较高,尤其是内叶,茎的营养价值较低。贮藏期间,黄心乌营养物质逐渐下降(TSS先增加后下降),其中内叶营养保存率大于外叶。
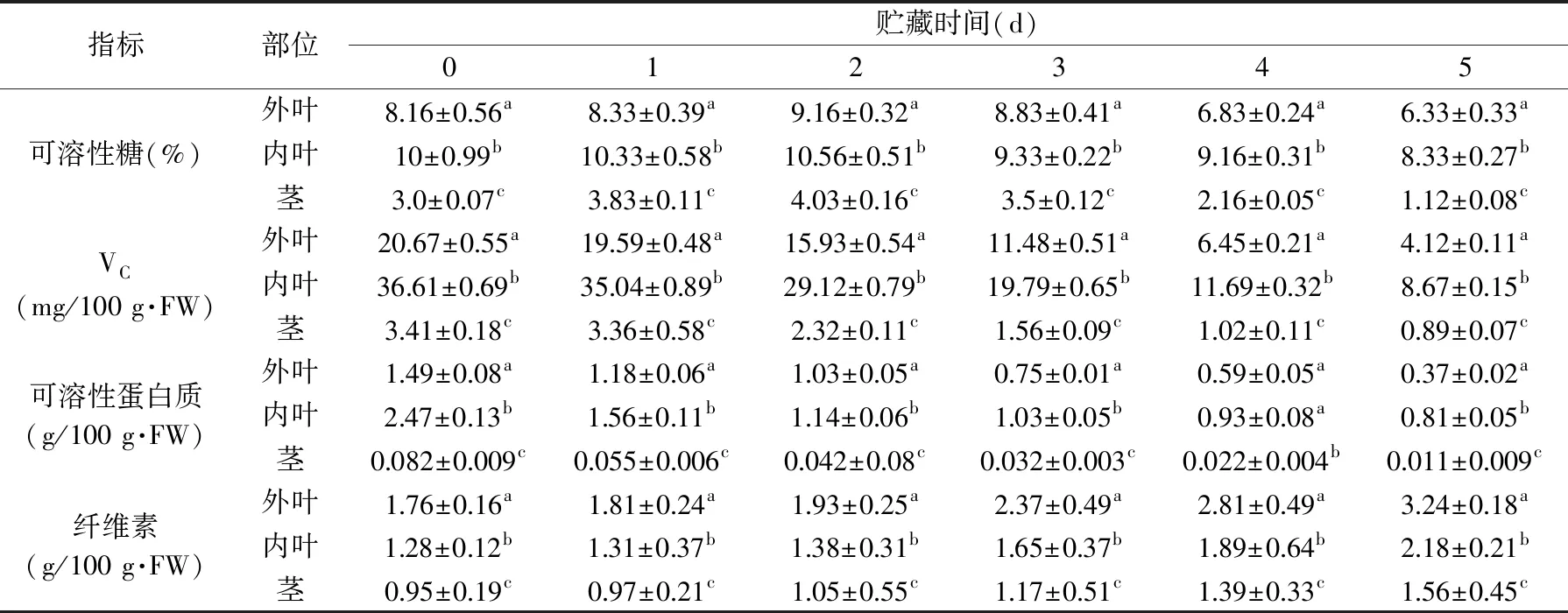
表2 黄心乌20 ℃贮藏期间不同部位TSS、VC、可溶性蛋白质和纤维素含量的变化Table 2 TSS,VC,soluble protein and cellulose content change in different parts of yellow heart cabbage during storage at 20 ℃
纤维素是细胞壁的重要组成物质,直接影响着黄心乌的口感,其含量变化也是黄心乌菜的重要感官品质之一。由表2可知,黄心乌叶片和茎的初始纤维素含量都较低,低于荠菜[20]。贮藏期间不同部位的纤维素均呈现上升趋势,贮藏结束时外叶纤维素含量最高,茎最低,外叶、内叶和茎的纤维素含量比入贮时分别增加了84.1%、70.3%、64.2%,表明黄心乌采后各部位有明显的纤维素增加情况发生。这一方面可能来源于新的纤维素的合成,部分原因与水分损失有关,因为黄心乌不同部位的纤维素含量与水分损失变化的统计分析结果显示两者的相关性外叶组r=0.9771,内叶组r=0.9841,茎组r=0.9922,均达到了极显著的水平,表明这一可能性的存在,该结论与李延清等[21]对溧阳白芹的研究结果相似。
2.5 黄心乌贮藏期间呼吸速率的变化
呼吸强度是衡量植物组织代谢速度的重要指标,呼吸强度大,则组织衰老的快。图4显示,黄心乌刚采后的呼吸速率为28.47 mg CO2·kg-1·h-1,低于矮箕青菜(呼吸速率为120 mg CO2·kg-1·h-1)[20]、菠菜(呼吸速率为281.97 mg CO2·kg-1·h-1)[22]等叶菜类。

图4 黄心乌20 ℃贮藏期间呼吸速率的变化Fig.4 Respiratory rate change of yellow heart cabbage during storage at 20 ℃
从图4还可知,黄心乌的呼吸强度在采后衰老过程中呈现跃变型变化,贮藏前2 d快速上升,第2 d达到呼吸速率的峰值,之后呼吸速率又开始下降。呼吸的大幅度增加可作为衰老开始的标志,提示黄心乌(20±2) ℃下贮藏2 d后进入快速衰老期,2 d后呼吸速率的下降可能与呼吸底物的过度消耗有关。黄心乌黄化指数和失重率的快速上升以及可溶性固形物、VC营养物质的急剧下降,出现的时间(贮藏2 d后)正好在呼吸高峰出现之后。
2.6 黄心乌贮藏期间不同部位超氧阴离子产生速率和丙二醛(MDA)含量的变化

图5 黄心乌20 ℃贮藏期间不同部位超氧阴离子产生速率(a)和丙二醛含量(b)的变化Fig.5 Superoxide anion radical production rate(a) and malondialdehyde content(b)change in different parts of yellow heart cabbage during storage at 20 ℃

2.7 黄心乌贮藏期间不同部位POD、SOD和CAT酶活的变化


图6 黄心乌20 ℃贮藏期间不同部位POD(a)、SOD(a)和CAT(b)的变化Fig.6 POD activity(a),SOD activity(b)and CAT activity(b)change in different parts of yellow heart cabbage during storage at 20 ℃
黄心乌SOD活性贮藏期间先上升后下降,第3 d时达到最大值,CAT活力在贮藏期间不断下降。比较不同部位的酶活发现,贮藏期间外叶组的SOD和CAT活力始终高于内叶组和茎组,差异达到显著水平(p<0.05),茎组活力在整个贮藏期间变化幅度不大且始终保持较低水平。原因可能是贮藏前期外叶组自由基的大量产生(如图5)刺激了SOD和CAT活性,使得其活力在各部位中最高,该结论与姚亚明等[25]对黄花菜酶活变化的分析结果一致。茎的抗氧化酶活性在整个贮藏期间都比叶片低,这可能是由于茎产生的自由基数量低于叶片(因此诱发的抗氧化酶活性也较低)。以上表明,黄心乌采后外叶衰老得最快,内叶次之,茎衰老最慢。
3 结论
黄心乌在20 ℃,相对湿度为75%条件下贮藏4 d即丧失商品价值,易出现失水、褪绿黄化、腐烂和质地老化现象,贮藏期间叶片色泽H值和叶绿素含量不断下降,失重率、黄化指数、腐烂率和纤维素含量不断增大,其中外叶的外观品质下降最快,内叶次之,茎最慢。
相关性表明,黄心乌叶片色泽H值大小和叶绿素含量存在极显著的正相关关系(外叶r=0.9348**,内叶r=0.9596**,p<0.05),黄化指数大小和叶绿素含量存在极显著的负相关关系(外叶r=-0.9614**,内叶r=-0.9347**,p<0.05),表明叶绿素降解与黄心乌采后叶片黄化显著相关。黄心乌外观指数和失重率存在负相关关系(外叶r=-0.9062**,内叶r=-0.8573**,茎r=-0.9792**,p<0.05),黄心乌纤维素含量和失重率存在显著正相关关系(外叶r=0.9771,内叶r=0.9841,茎r=0.9922,p<0.05),提示水分散失对黄心乌外观品质和组织老化有显著影响。
黄心乌主要营养成分(可溶性糖、可溶性蛋白、VC)的含量十分丰富,其中叶片的营养价值较高,特别是内叶。贮藏期间主要营养成分逐渐下降(TSS先增加后下降),其中内叶的营养保存率大于外叶,茎的营养含量低且贮期变化不明显。

