肺淋巴管平滑肌瘤病1 例并文献复习
孙兰 华毛 拉周措毛 李杨
肺淋巴管平滑肌瘤病(pulmonary lymphangioleio mymatosis,PLAM/LAM)是一种罕见的肺部弥漫性疾病。Enterline 和Roberts 在1955年首次报道,并由Cornog 和Enterline 于1966年正式将其命名为肺淋巴管平滑肌瘤病,而我国在1986年首次报道该病,全世界每年约新增100 例,随着CT 的广泛应用,有关本病的报道也逐渐增多。我国2015年的一项回顾性研究表明,LAM 通常发生在女性(99.2%)群体中,最常见的临床表现是呼吸困难(94.6%),最常见的肺外表现为腹膜后淋巴结转移(52.1%),最常见的胸部影像学表现为双肺弥漫性分布多个大小不等的薄壁囊性阴影(93.8%),最常见的肺活检方法为支气管镜活检(41%)。在肺功能不全患者中,阻塞性通气功能障碍和弥散功能障碍的发生率分别为65.1%和38.4%。目前LAM 缺乏有效的内科治疗手段,肺移植可能是治愈该病的唯一方法[1]。
1 临床资料
患者,女,53岁,因“反复咳嗽、咳痰、气喘20年,加重20 天”于2017年12月6日入住我科。患者20年前因反复受凉、感冒后出现咳嗽,咳少量白色泡沫样痰,于当地卫生院抗感染治疗后症状缓解。6年前患者受凉后渐出现气喘,症状缓解期自觉闻及喉间喘鸣音。2年前患者咳嗽、气喘症状加重,伴活动耐量降低,平地步行不足100m 即感胸闷、气短明显,于市级医院就诊,诊断为“慢性阻塞性肺疾病、支气管哮喘”,给予布地奈德福莫特罗粉吸入剂吸入治疗,症状无明显缓解。20d 前患者受凉后胸闷、气喘明显加重,不能自行穿衣,夜间可平卧,咳少量白痰,遂收住我科。入院查体:口唇略发绀,桶状胸,叩诊双肺呈过清音,肺下界下移,听诊双肺呼吸音低,未闻及明显干湿性啰音及哮鸣音。心、腹、神经系统查体均正常。外院胸片提示:两肺野透亮度增强,两肺可见多发类圆形透亮区,两肺纹理增多。门诊肺功能提示:FEV1/FVC 57.89%,FEV1 占预计值51.4%,FVC 占预计值75.5%,RV/TLC 50.82%,TLCO SB 占预计值73%,中重度阻塞性通气功能障碍,残气/肺总量中度增高,弥散功能正常。支气管舒张试验阴性。
入院后查血气分析:pH 7.40,PaO255mmHg,PaCO242mmHg,SaO288%。雌二醇5.00pg/ml。血常规、血生化、尿便常规等均未见明显异常。胸部高分辨CT 可见双肺弥漫性分布大小不一的囊性透亮区,直径最大约6.90cm,囊性病灶周边可见血管贴边影,囊性病灶间肺组织正常,见图1、2。入院后予以多索茶碱舒张支气管对症治疗,但患者胸闷、气短症状无明显缓解,且进行性加重,查体见右侧胸廓饱满,右侧肩胛下线第9 肋以下叩诊浊音,呼吸音消失,胸腔彩超提示右侧胸腔积液,行右侧胸腔穿刺术,胸腔积液化验:外观为乳白色,比重1.015,pH 7.50,白蛋白50g/L,细胞数100×106/L,以淋巴细胞为主,甘油三酯2.94mmol/L,胆固醇1.2mmol/L。综合分析,患者于育龄期发病,以活动呼吸困难为主要表现,胸部高分辨CT 可见双肺弥漫分布大小不一的囊性透亮区,周边可见血管贴边影,病变之间肺组织正常,胸腔积液为乳糜胸,肺功能提示阻塞性通气功能障碍,血气分析提示低氧血症,故该患者诊断为LAM。但该患者因经济原因未行肺活检等以进一步证实,仅予以舒张支气管对症治疗,目前仍在随访中。
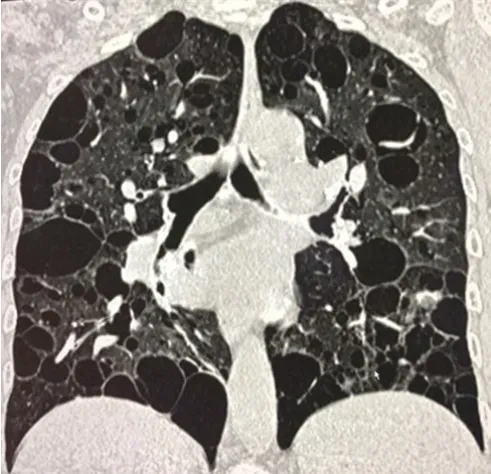
图1 胸部高分辨CT 冠状位成像

图2 胸部高分辨CT
2 讨论
2.1 病因及发病机制 目前该病病因尚未十分明确,目前认为有以下几种发病机制。
2.1.1 TSC 基因突变 LAM 的发病与结节性硬化症(TSC)密切相关。TSC 是一种常染色体显性遗传性疾病,可累及多个系统,是由于TSC1、TSC2 基因突变所致,特征为面部皮脂腺瘤、智能减退、癫痫发作[2]。散发型肺淋巴管肌瘤病(S-LAM)、结节性硬化症相关型(TSC-LAM)的发病分别与TSC2、TSC1 基因突变有关[2,3],两者均为抑癌基因,其编码的TSC1 与TSC2蛋白结合成功能性复合物从而对下游信号发挥调节作用。LAM 患者由于TSC1 或TSC2 基因突变导致所编码的蛋白功能缺陷,从而引起哺乳类西罗莫司靶蛋白激酶mTOR 通路持续活化;另一方面,TSC2基因突变后,其抑制mTOR 复合物2(mTORC2)的程度降低,下游Rho-鸟苷三磷酸酶(Rho-GTPases)活性提高,最终促进细胞的增殖、分化和粘附,导致平滑肌细胞不适当的增殖、迁移和侵入[4]。
2.1.2 雌激素 绝大多数LAM 患者为育龄期妇女,妊娠、月经、使用雌激素或避孕药时其症状会加重,提示雌激素可能在LAM 的发病中起重要作用。已被证实LAM 组织中雌、孕激素受体阳性,而且在体外和动物实验中,雌激素可促进TSC 缺乏的平滑肌细胞增殖[5,6]。
2.1.3 基质金属蛋白酶(MMPs) MMPs 可促进胶原蛋白、蛋白多糖、弹性纤维等细胞外基质成分降解。LAM 的典型影像学特点是双肺广泛的囊性透亮区,而有研究发现LAM 患者血清MMP-9、MMP-2 明显高于正常人,其天然拮抗剂TIMP-1 明显低于正常人,表明MMPs 及其拮抗剂的表达失衡可能参与LAM 的发生[5]。
2.1.4 淋巴系统 LAM 常累及淋巴管系统,LAM 组织中富含淋巴管。血管内皮生长因子(VEGF-D)是一种淋巴管生长因子,LAM 患者血清的VEGF-D水平显著高于健康人,并与疾病的严重程度相关。
2.2 临床表现 LAM 最常见的表现为活动后呼吸困难、反复发生自发性气胸、咳嗽、血痰、胸痛和乳糜胸腹水等。早期症状不明显,50%的患者以自发性气胸为首发症状,80%的患者在疾病发展过程中发生气胸,常表现为复发性、双侧性,其中TSC-LAM 患者自发性气胸的发生率约为47%,S-LAM 患者自发性气胸的发生率高达57%[7];呼吸困难进行性加重,TSC-LAM、S-LAM 患者呼吸困难的发生率均约为70%[8]。TSC-LAM 患者中90%以上合并有腹腔、盆腔血管平滑肌脂肪瘤,而S-LAM 患者上述疾病的发生率相对较低,为30%~40%[8,9]。同时,TSC-LAM 患者还伴有TSC 的皮损表现,如面部皮脂腺瘤、腰骶部鲨鱼皮斑、甲床下纤维瘤等[8],常见肺外表现主要有淋巴结肿大、腹部肿块所致的相应症状,以及肾脏血管平滑肌脂肪瘤所致的血尿等。
2.3 辅助检查
2.3.1 影像学检查 早期胸部X 片可无异常表现;晚期表现为两肺弥漫性网状影、网状结节影、囊性变及肺气肿。胸部HRCT 早期即可出现特征性改变—弥漫性分布大小不一的薄壁囊性气腔,大多数囊壁<2mm,周围肺组织正常,囊腔直径从几毫米到几厘米不等,血管影位于囊状影边缘;少数患者可见少许小叶间隔光滑性增厚或肺内密度增高影(包括肺实变影和毛玻璃影),还可见纵隔及肺门淋巴结肿大;晚期CT 显示呈双肺弥漫性间质纤维化及蜂窝肺改变,小囊泡融合成大囊泡。大约60%的S-LAM和90%的TSC-LAM 患者合并肾脏血管平滑肌脂肪瘤,腹部CT 可见肾脏实质性肿块,常呈多发性及双侧性,大小不一,可见后腹膜、盆腔淋巴结肿大,淋巴管造影可呈现充盈异常和淋巴结内囊性改变。
2.3.2 VEGF-D 检测 VEGF-D 被称为淋巴管生长因子,可结合血管内皮细胞表面受体VEGFR-3/Flt-4,调节血管和淋巴管的生理功能,LAM 患者血清VEGF-D 异常升高,当其>800pg/ml 时有助于诊断S-LAM。
2.3.3 组织活检病理学检查 可通过开胸肺活检、经胸腔镜肺活检或经支气管镜肺活检取得肺组织标本。病理改变可分为两种类型:一种是囊性改变为主型,另一种是未成熟平滑肌增生型,免疫组化显示病变组织肌动蛋白、肌纤维蛋白阳性,并有LAM特征性改变单克隆抗体、HMB45 阳性。大部分LAM 细胞有雌激素或孕激素受体表达。
2.4 诊断和鉴别诊断
2.4.1 诊断标准 2016年ATS/JRS 制定的淋巴管肌瘤病指南指出:若患者高分辨率CT(HRCT)有LAM 特征,并具备≥1 项以下特征,便可确诊LAM[10]:①有TSC;②有肾血管平滑肌脂肪瘤;③血清VEGF-D ≥800pg/ml;④生化证实液体(胸水或腹水)为乳糜状渗出液;⑤有淋巴管平滑肌瘤(淋巴管肌瘤);⑥渗出液或淋巴结细胞学检查确定为LAM 细胞或LAM 细胞簇;⑦肺活检、腹膜后或盆腔肿块的组织病理学证实为LAM。在某些情况下,无症状的典型临床表现患者以及HRCT 显示轻度囊性改变,此时依据HRCT 可得出LAM 的可能性诊断。
2.4.2 鉴别诊断 LAM 临床表现为呼吸困难时,需与支气管哮喘、COPD、α1-抗胰蛋白酶缺乏症相鉴别;临床表现为自发性气胸者,需与特发性气胸相鉴别;肺部CT 表现为弥漫性囊性病变时,需与肺朗格汉斯细胞增多症、淋巴细胞间质性肺炎、肺气肿、结缔组织相关性疾病等相鉴别。
2.5 并发症 LAM 常并发自发性气胸、乳糜性胸腹水;晚期可出现肺心病和呼吸衰竭。
2.6 治疗
2.6.1 对症治疗 气道阻塞者吸入支气管舒张剂可改善气短症状,发生气胸、胸腔积液时给予相应的抽气、抽液治疗或胸腔切开闭式引流;反复发生气胸或胸腔积液不能控制者,有必要行胸腔镜下胸膜固定术,但胸膜固定术有可能增加肺移植时手术难度,以及围术期发生出血的风险;乳糜胸腹水者建议低脂或无脂饮食。
2.6.2 mTOR 抑制剂 mTOR 通路的异常活化是LAM的发病机制之一,因此mTOR 抑制剂可以治疗LAM,主要有西罗莫司和依维莫司。有研究发现,西罗莫司可以使肾血管平滑肌脂肪瘤(AML)体积缩小、稳定或改善肺功能,且对乳糜性积液有较好疗效,其不良反应主要有腹泻、胃炎、感染、AML 出血、口腔溃疡、高脂血症、周围性水肿、痤疮样皮疹等[10]。西罗莫司治疗LAM 的疗效确定,且已得到美国和日本国家药监部门的批准,然而对治疗剂量、患者选择、药物选择、治疗时机和疗程等均需要更多的研究。McCormack 等[11]的一项国际多中心随机双盲的临床试验(MILES)研究结果显示西罗莫司维持血液浓度的剂量为5~15ng/ml。近期也有回顾性研究表明,低剂量西罗莫司(血液浓度<5ng/ml)也能稳定FEV1、提高肺活量,减少药物不良反应发生[12]。2016年ATS/JRS 淋巴管肌瘤指南建议[10]:对于肺功能异常或肺功能恶化的LAM 患者,推荐西罗莫司治疗(强推荐);对于伴有症状的乳糜性积液的LAM 患者,建议先给予西罗莫司治疗,再考虑侵入性治疗,如间断性胸腔穿刺引流和留置胸腔引流管引流(有条件推荐)。2.6.3 肺移植 肺移植术被认为是治疗LAM 最有希望的手段,已经成功地应用于晚期患者,有单肺及双肺移植,肺移植后1年生存率高达90%,生存期约67 个月[13]。但也有报道移植成功的供体肺脏也发生了LAM 的改变。
虽然mTOR 抑制剂可用于治疗LAM,但不推荐在肺移植前后的一段时间内使用mTOR 抑制剂,因为其影响肺移植术后支气管吻合口的愈合,所以对于肺移植后患者,可在支气管镜下观察支气管吻合口愈合情况,在愈合良好后再考虑使用mTOR 抑制剂。肺移植等待供体需要很长时间,在此期间,如果不使用mTOR 抑制剂,LAM 患者可能因呼吸功能迅速恶化而失去手术机会甚至死亡,在此期间mTOR 抑制剂的使用还有待进一步研究。但有学者指出,在权衡收益风险比的情况下,可使用代谢较快的依维莫司来治疗LAM,使血药浓度维持在一个相对较低的水平(3~8ng/ml)[14]。
2.6.4 其他 2016年ATS/JRS 淋巴管肌瘤指南[10]不推荐MMPs 抑制剂、抗雌激素治疗LAM,他汀类药物、芳香化酶抑制剂、奥曲肽、COX 抑制剂、尼达尼布等药物仍处于临床试验阶段[14]。
2.7 预后 LAM 预后较差。近年来随着对疾病的认识及mTOR抑制剂应用于本病,其预后有较大改善,近年报道的生存时间较前明显延长,在非肺移植患者中10年生存期为86%,从症状出现后平均生存期为29年[14]。
LAM 较为少见,临床医师对此病认识不足,故经常误诊,临床医师应提高对此类罕见病的认识,对于育龄期女性反复出现呼吸困难、气胸、胸腔积液甚至咯血等表现时需考虑LAM 的可能,应尽早完善胸部高分辨CT 检查甚至肺活检。

