巨噬细胞对单侧输尿管结扎小鼠肾纤维化的影响
吴清凤,孙世仁,陈阳,宁晓暄*
(空军军医大学第一附属医院:1老年病科,2肾脏内科,西安 710032)
近年来,发生慢性肾脏病(chronic kidney diseases,CKD)的老年人数逐年增加,并且CKD的病因明确困难,现有的治疗手段效果又不佳,因此CKD已成为老年人健康的巨大威胁[1]。肾纤维化是各种CKD进展至终末期肾脏疾病(end-stage renal disease,ESRD)的共同通路[2]。炎性因子在肾纤维化过程中发挥重要作用,其与肾小管上皮间质及内皮细胞转分化,周细胞、系膜细胞及成纤维细胞激活相关[3]。曾有研究表明巨噬细胞是参与肾脏炎症反应的主要细胞,因其具有强可塑性,参与肾纤维化整个进程。研究发现在不同的肾脏微环境下巨噬细胞可活化为不同的表型:即经典激活的M1型巨噬细胞和选择激活的M2型巨噬细胞[4]。不同表型的巨噬细胞通过分泌不同细胞因子发挥抗炎、促炎及促进组织重塑作用[5]。据报道M1型巨噬细胞主要参与固有免疫应答,分泌促炎因子加重肾损伤,启动肾纤维化[6];M2型巨噬细胞通过分泌促纤维化因子参与损伤组织的修复和重塑[7]。但最新研究发现M2型巨噬细胞还具促纤维化作用[8],同时有研究报道减少M2型巨噬细胞可减轻肾脏纤维化[9]。因此,不同极化类型的巨噬细胞在肾脏纤维化中的作用仍存在争议。为此,我们检测了单侧输尿管结扎(unilateral ureter obstruction,UUO)肾纤维化模型中巨噬细胞的极化类型,为深入研究巨噬细胞在肾纤维化中的作用奠定基础。
1 材料与方法
1.1 动物模型及取材
无特定病原体(specific pathogen free,SPF)级8周龄雄性C57BL/6J小鼠39只(空军军医大学动物中心),采用随机数表法完全随机分为4组。麻醉小鼠后,用胶带固定四肢,局部剃毛,左侧下腹部切口约0.5 cm,依次切开皮肤至腹膜后,用镊子游离输尿管,用组织钳将左侧输尿管中段部位钳起,穿插进一段缝合线,分别在近肾脏及膀胱侧结扎,从两结扎线间剪断输尿管,然后连续缝合肌肉层,间断缝合皮肤。假手术组(sham组)除不结扎输尿管外,其余处理同模型组。模型组小鼠分别于UUO术后3 d(UUO-3d组)、7 d(UUO-7d组)、14 d(UUO-14d组)腹腔注射水合氯醛麻醉,用生理盐水经左心室灌注至肾脏发白,取下左侧肾脏,沿肾门纵切,一半肾脏做流式细胞术分析,另一半肾脏存于4%多聚甲醛中固定,脱水后石蜡包埋待切片。
1.2 病理染色
1.2.1 HE染色 将切片依次放入二甲苯 Ⅰ、Ⅱ 各20 min,无水乙醇Ⅰ、Ⅱ各5 min,75%乙醇5 min脱蜡。将切片放入苏木素染液3~5 min,自来水洗1次,分化液分化,返蓝液返蓝,流水冲洗。梯度乙醇脱水,伊红染液染色5 min。无水乙醇Ⅰ、Ⅱ、Ⅲ各5 min,二甲苯Ⅰ、Ⅱ各5 min脱蜡,中性树胶封片。每组随机选取3个样本,每个样本随机选取3个视野,显微镜检查,采用 Image-Pro Plus 6.0软件计算肾间质蓝色颗粒(炎性细胞)数量,计算平均值。
1.2.2 Masson染色 切片脱蜡步骤同HE染色,重铬酸钾浸泡过夜,自来水洗1次;铁苏木素染液染色3 min,自来水洗1次,分化液分化,返蓝液返蓝,流水冲洗。丽春红浸染10 min,自来水漂洗,磷钼酸溶液浸染1~3 min,苯胺蓝染液染3~6 min,1%冰醋酸分化,无水乙醇Ⅰ、Ⅱ、Ⅲ各5 min,二甲苯Ⅰ、Ⅱ各5 min脱蜡,中性树胶封片。每组随机选取3个样本,每个样本随机选取 3个视野,显微镜检查,采用 Image-Pro Plus 6.0软件计算,肾间质蓝色区域为胶原纤维。
1.3 免疫荧光染色
将固定于4%多聚甲醛中的肾组织取出,放入30%蔗糖溶液脱水OCT包埋,-80℃冰箱冷冻4 h后切片,厚度约4 μm。稀释的第一抗体[F4/80(巨噬细胞标志物),ab6640,10 μg/ml,于4℃用微量离心机以13 500g离心2 min]孵育过夜。稀释的第二抗体(Cy3-山羊抗大鼠,1∶300稀释)孵育1 h。细胞核标志物DAPI(货号ServicebioG1012)1∶300稀释;封片避光-80℃保存。荧光显微镜观察,每组随机选取3个样本,每个样本随机选取 3个视野,采用 Image-Pro Plus 6.0软件计算肾间质红色荧光和蓝色荧光merge的细胞,即巨噬细胞的数量,计算平均值。
1.4 流式细胞术
将肾脏剪碎(约1 mm×1 mm×1 mm 大小)放入1×Hank′s 液(含1 mg/ml Ⅳ型胶原酶)中,37℃摇床消化30 min,取出消化好的细胞悬液,加入2 倍体积含5%血清的 1640 培养基终止消化,70 μm 尼龙膜过滤,15 ml 离心管收集细胞悬液,离心(50 g,4℃,5 min),取上清,重复3次,再离心(1 300 转/min,4℃,5 min),加1 ml 裂红液,裂红5 min,加12 ml 流式液(1×PBS 含5%胎牛血清,4%叠氮钠)终止裂红,离心(1 300转/min,4℃,5 min),用1 ml 流式液重悬细胞,计数后,按1×106细胞/管量分装到流式管中,离心(1 300转/min,4℃,5 min),去上清,10 μl 大鼠血清封闭30 min, 加入抗体[PE-CD86(M1型巨噬细胞标志物),FITC-F4/80]避光孵育30 min,流式液洗涤,加入400 μl PBS 重悬,准备上机。加FITC-F4/80避光孵育30 min后,流式液洗涤,加入500 μl固定液固定30 min,1 ml破膜液洗2 遍,PE-CD206(M2型巨噬细胞标志物) 避光孵育30 min,流式液洗涤,加入400 μl PBS 重悬,准备上机。用Flow Jo软件分析结果。
1.5 统计学处理

2 结 果
2.1 各组小鼠肾脏形态学变化
假手术组小鼠肾小球结构改变无明显差异,肾间质无炎性细胞浸润,无胶原蛋白沉积。与假手术组相比,3个模型组小鼠肾间质炎性细胞浸润均增多[(169±16)vs(1 068±164),(2 159±432),(3 536±318),P<0.05],胶原蛋白沉积面积均增加[(7.8±1.5)%vs(14.1±2.7)%,(27.4±3.1)%,(39.3±2.7)%,P<0.05],且随UUO术后时间延长,肾间质炎性细胞及胶原蛋白沉积增加越多(P<0.05,图1)。
2.2 各组小鼠肾间质巨噬细胞浸润情况
与假手术组相比,UUO-3d模型组中肾脏每高倍镜视野下巨噬细胞数量显著增加[(2.00±1.21)vs(8.00±2.54),P<0.05],UUO-7d模型组肾脏巨噬细胞较UUO-3d模型组巨噬细胞比例增加[(8.00±2.54)vs(18.00±2.74),P<0.05],与UUO-7d模型组相比,UUO-14d模型组肾脏巨噬细胞浸润比例增加[(18.00±2.74)vs(32.00±3.28),P<0.05;图2A]。
流式细胞术(巨噬细胞标志物F4/80)分析表明,假手术组、UUO 3d、7d、14d小鼠肾组织中巨噬细胞比例分别为(20.8±2.7)%,(31.1±1.3)%,(49.5±2.1)%,(69.6±1.8)%,随着UUO时间延长,肾组织中巨噬细胞显著增加(P<0.05;图2B)。
2.3 各组小鼠肾脏巨噬细胞亚群比例变化
流式细胞术检测肾组织中巨噬细胞的活化状态,结果显示:与假手术组相比,UUO-3d模型组小鼠肾间质中M2型巨噬细胞(F4/80+CD206+)显著增加[(3.2±1.9)%vs(34.1±2.1)%,P<0.001],UUO-7d模型组小鼠肾间质中M2型巨噬细胞较UUO-3d模型组增加[(34.1±2.1)%vs(52.6±1.6)%,P<0.001],与UUO-7d模型组相比,UUO-14d模型组小鼠肾间质中M2型巨噬细胞增加[(52.6±1.8)%vs(76.7±2.3)%,P<0.001](图3A)。各组间M1型巨噬细胞(F4/80+CD86+)[(76.4±3.6)%,(81.8±2.8)%,(80.6±4.4)%,(85.5±2.6)%]变化差异无统计学意义(图3B)。

图1 各组小鼠肾纤维化情况
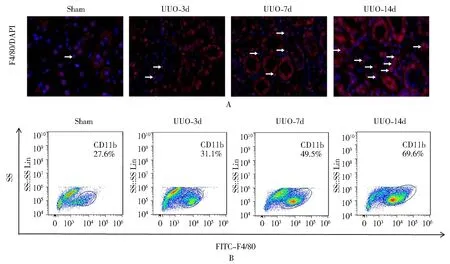
图2 各组小鼠肾脏巨噬细胞浸润情况
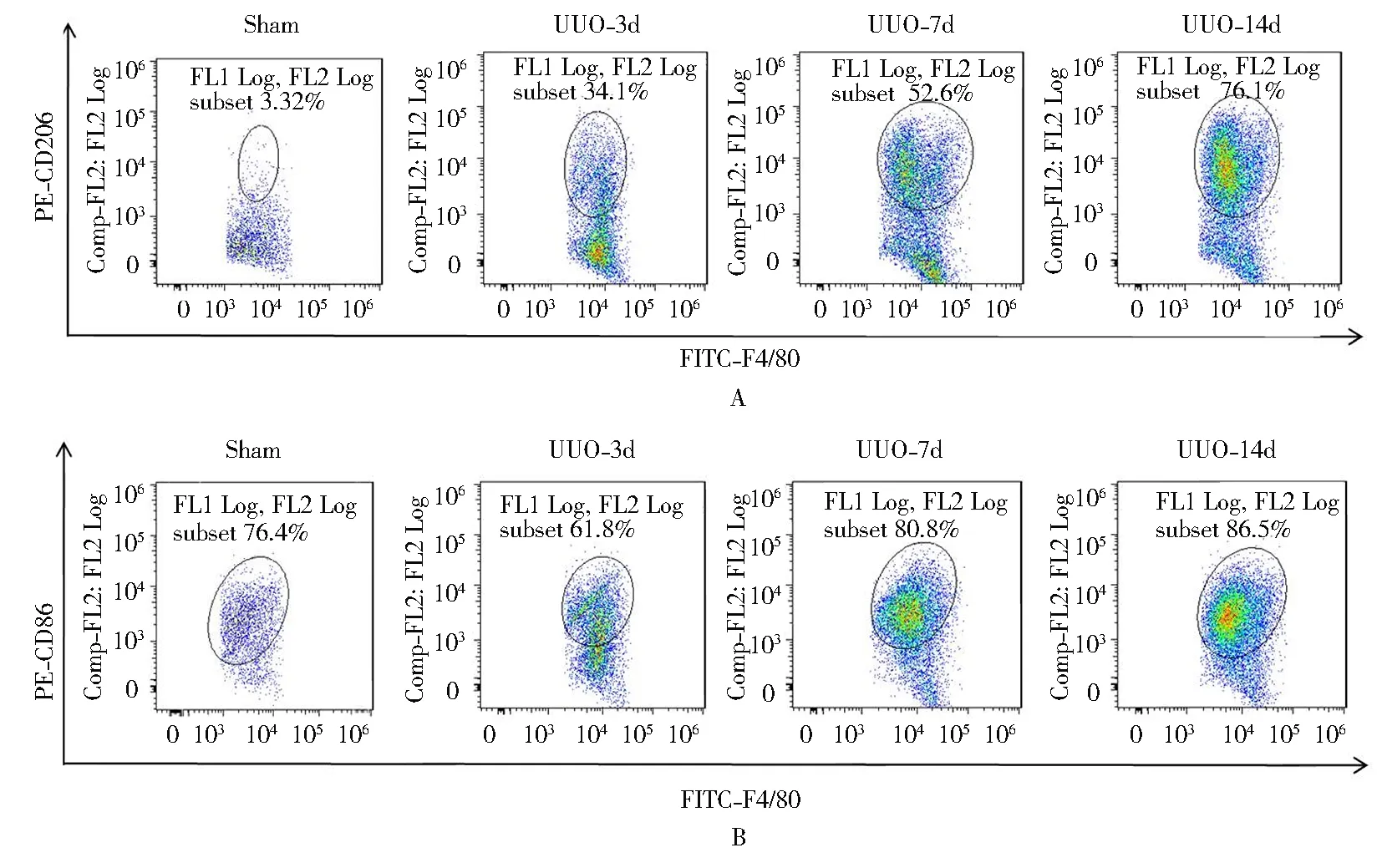
图3 各组小鼠肾脏巨噬细胞亚群比例
3 讨 论
既往研究发现巨噬细胞在肾纤维化过程中具有保护作用[10]。近年来研究表明,不同亚型巨噬细胞在肾纤维化中的作用存在争议[11]。本文拟对巨噬细胞在慢性肾脏病中的作用进行研究,并进一步探讨巨噬细胞亚型对肾纤维化的影响。
单侧输尿管结扎模型鼠是CKD病理过程研究较理想的模型[12]。在该研究中,我们分别收取假手术组和模型组3 d,7 d及14 d的小鼠肾脏组织,通过观察发现随着UUO时间延长,小鼠肾间质胶原蛋白沉积增多,炎性细胞浸润增加,免疫荧光及流式细胞术检测结果进一步证实肾间质中巨噬细胞浸润增多。
巨噬细胞因其高度异质性、强可塑性及免疫功能多样性,在损伤后肾脏中可根据不同微环境极化为M1和M2两种亚型,M1型巨噬细胞特异性表达CD86分子,主要通过分泌肿瘤坏死因子α (tumor necrosises factor-α,TNF-α)、白细胞介素-2和白细胞介素-6等促炎因子促进炎症反应,杀伤机体病原体;M2型巨噬细胞特异性表达CD206分子,主要分泌转化生长因子(transforming growth factor-β,TGF-β)、炎症区分子1(found in inflammatory zone 1,FIZZ1)和精氨酸酶1 (arginase-1,Arg1)等抑炎因子抑制炎症反应,促进组织重构和纤维化过程[13,14]。最近研究表明各亚型巨噬细胞均参与肾纤维化形成[15]。为进一步探索巨噬细胞亚型在肾纤维化进程中的作用,我们构建不同时间段的UUO模型鼠,分别检测M1(CD86)和M2(CD206)型巨噬细胞的表达变化,结果发现假手术组及模型组3,7和14 d的肾组织中M1型巨噬细胞没有明显差异,而随着UUO时间的延长,M2型巨噬细胞所占比例逐渐增大,该结果提示主要是M2型巨噬细胞而非M1型巨噬细胞极化参与肾纤维化进程。据文献报道,其促纤维化机制可能与M2型巨噬细胞分泌TGF-β相关[16],但在肾纤维进程中是否与M2型巨噬细胞分泌TGF-β相关还需进一步证实。
另有研究提示IRAK、SMAD3、Wnt/β-catenin、AMPK-PPARγ等信号通路可能参与巨噬细胞选择性激活,促进纤维化[8,17],但肾纤维化进程中的具体分子机制还需进一步探究,为巨噬细胞靶向治疗肾纤维化提供思路。

