脓毒症儿童CD4+T淋巴细胞肌醇需求酶1信号通路的变化
商跃云, 张慧, 林书祥, 舒剑波
1天津市儿童医院急诊内科(天津 300134); 2天津市儿科研究所(天津 300134)
脓毒症(sepsis)是由感染、创伤等因素引起的全身炎症反应综合征,是临床常见的急危重症,是危重患者死亡的主要原因之一。既往把脓毒症定义为感染导致的全身反应综合征,2016年2月,美国重症医学会与欧洲重症医学会联合发布了脓毒症3.0定义,即脓毒症是宿主对感染的特异性反应导致的威胁生命的器官功能障碍。新定义更强调了脓毒症“器官功能障碍”的结果与本质。多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)在脓毒症中具有非常重要的地位,具有来势凶猛、进展迅速、预后差的特点。目前脓毒症引起MODS的机制并不十分明确,因其难治性及高病死率一直是急危重症的重点和难点[1]。外周血CD4+T淋巴细胞参与T细胞活化信号的传导和免疫激活,在脓毒症所致MODS中起重要作用,影响脓毒症患者的预后[2]。内质网是真核细胞特有的膜性细胞器,遍布于整个细胞质中,是连接核膜和胞膜的主要组成,为细胞内蛋白的折叠、修饰、加工、合成提供场所,是细胞的蛋白加工厂。外来刺激的作用下,未折叠或错误折叠的蛋白蓄积过度,内质网腔内的内环境稳态发生紊乱可以引发内质网应激(endoplasmic reticulum stress,ERS)。近年来的研究发现,ERS在炎症反应、细胞死亡及氧化应激过程中发挥重要作用[3]。其中细胞凋亡相关肌醇需求酶1(inositol requiring enzyme 1,IRE1)通路是ERS未折叠蛋白反应(unfolded protein response,UPR)的经典通路,IRE1通路的激活意味着ERS的存在[4]。本研究通过检测脓毒症外周血CD4+T细胞免疫球蛋白重链结合蛋白(binding immunoglobulin heavy chain protein,Bip)、IRE1及X-盒结合蛋白1(Xbox-binding protein 1,XBP1)水平变化,初步探讨CD4+T细胞ERS IRE1通路在脓毒症中的作用,以期为其治疗提供依据。
1 资料与方法
1.1 一般资料 收集2017年1—12月于天津市儿童医院确诊的脓毒症儿童,根据出院结局分为存活组和死亡组,每组随机选取30例,纳入标准:均符合脓毒症诊断标准[5],且经过血、尿、痰标本培养及X线胸片、超声、CT检查确定感染部位。同时选取天津市儿童医院同期体检的健康儿童30例为对照组。排除标准:既往患有自身免疫性疾病、正在应用免疫抑制剂、AIDS和肿瘤患者。对照组30例,男15例,女15例,年龄(6.27±3.50)个月;存活组30例,男14例,女16例,年龄(7.37±3.92)个月;死亡组30例,男16例,女14例,年龄(7.03±3.76)个月,3组性别和年龄差异均无统计学意义(2=0.27,F=0.69,P>0.05),有可比性。本研究获医院伦理委员会批准,且受试者家长均知情同意。
1.2 方法
1.2.1 诊治方法 所有确诊患儿均以迈瑞(Mindray)PM-9000便携式多参数监护仪予生命体征监测,以迈瑞全自动五分类血液分析仪BC-5140行血常规,以优利特(Urit)全自动生化分析仪8020A行电解质、肝肾功能、心肌损伤标志物、C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)、白细胞介素-6(interleukin-6,IL-6)及血乳酸,以贝克曼ACLTOP 300全自动血凝分析仪行D-二聚体,以雅培(ABBOTT)i2000全自动免疫分析仪行脑尿钠肽(brain natriuretic peptide,BNP),以雷度(Radiometer)ABL80血气分析仪行血气分析等相关检查,经过血、尿、痰标本培养及X线胸片、超声、CT检查确定感染部位。并予心电图、超声心动图监测心脏损害。根据小儿危重病例评分法(草案)进行小儿危重病例评分(pediatric clinical illness score,PCIS)[6]并根据2016年脓毒症与脓毒性休克处理国际指南[7]给予脓毒症集束化治疗,包括液体复苏、抗生素、糖皮质激素等治疗。
1.2.2 分离外周血CD4+T淋巴细胞 对照组、生存组及死亡组于确诊后抽取外周静脉血3 mL,乙二胺四乙酸二钠盐抗凝静脉血,聚蔗糖-泛影葡胺密度梯度离心法(北京索莱宝科技有限公司,批号:P8610)分离外周血单个核细胞。按试剂盒(Invitrogen Technologies Inc,USA,批号:15596-06)说明,采用免疫磁珠分离外周血CD4+T淋巴细胞,锥虫蓝染色判定细胞活力>95%,流式细胞术检测细胞纯度>97%,备用。
1.2.3 Bip、IRE1及XBP1 mRNA水平的测定 取已分离外周血单个核细胞,按试剂盒说明书(Tiangen)步骤分离总RNA,紫外分光光度计测定RNA含量,吸光度260/280比值判定纯度,琼脂糖凝胶凝胶电泳检测完整性。经逆转录合成cDNA后(Tiangen),进行PCR扩增。内参照肌动蛋白(β-actin)与目的片段IRE1、ASK1及JNK的引物应用软件Gene Runner、并根据GenBank所发布的目的基因序列自行设计, 同时经NCBI BLAST检索无显著同源性。引物由生工生物工程(上海)股份有限公司合成,具体引物序列和扩增产物片段长度见表1。

表1 Real-time PCR引物序列
采用实时荧光定量聚合酶链反应(real time polymerase chain reaction,Real-time PCR)法测定mRNA水平,Real-time PCR反应体系参照SYBR Green Real time PCR Master Mix试剂盒(Tiangen)说明书。PCR循环参数:95℃预变性5 min,95℃变性15 s,60℃退火15 s,72℃延伸34 s,进行40个循环。温度变化速度为3℃/s,在每个循环延伸阶段检测荧光信号,进行实时监控,最后进入解链阶段,绘制产物的融解曲线,以了解样品扩增的特异性,保证测定结果的准确可靠。数据的收集由ABI 7500定量PCR仪自带软件完成。每管样品重复测定4次,Real-time PCR产物行琼脂糖凝胶电泳,用GelDoc凝胶成像分析仪扫描电泳结果,根据产物分子量大小来进一步鉴定产物特异性。
1.3 统计学方法 以SPSS 13.0统计软件进行统计分析。计数数据用2检验,计量数据(均符合正态分布)以表示,两组间比较用t检验,多组间比较用单因素方差分析(One Way ANOVA),差异有统计学意义者进一步两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 脓毒症存活组与死亡组生化指标比较 存活组与死亡组CRP、PCT、IL-6、血乳酸、D-二聚体、BNP及PCIS的差异有统计学意义(P<0.01)。存活组CRP、PCT、IL-6、血乳酸、D-二聚体及BNP均低于死亡组,PCIS高于死亡组。见表2、3。
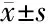
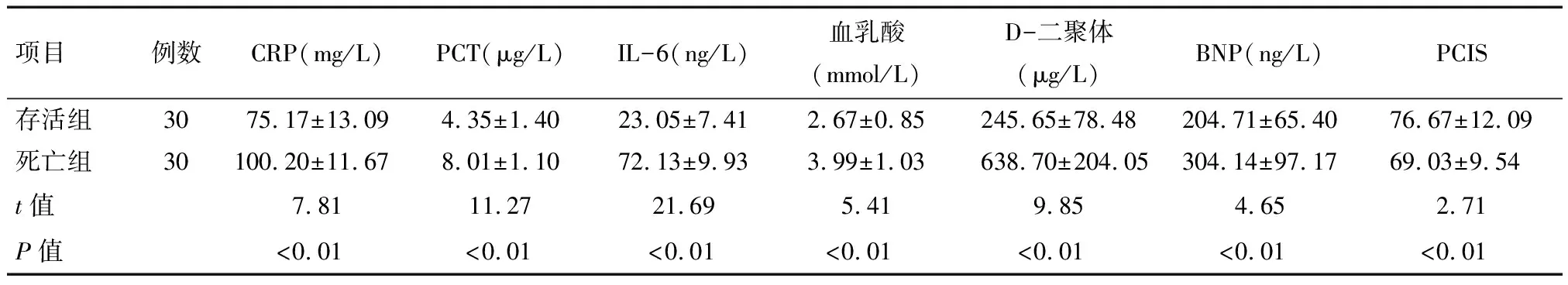
项目例数CRP(mg/L)PCT(μg/L)IL-6(ng/L)血乳酸(mmol/L)D-二聚体(μg/L)BNP(ng/L)PCIS存活组3075.17±13.094.35±1.4023.05±7.412.67±0.85245.65±78.48204.71±65.4076.67±12.09死亡组30100.20±11.678.01±1.1072.13±9.933.99±1.03638.70±204.05304.14±97.1769.03±9.54t值7.8111.2721.695.419.854.652.71P值<0.01<0.01<0.01<0.01<0.01<0.01<0.01
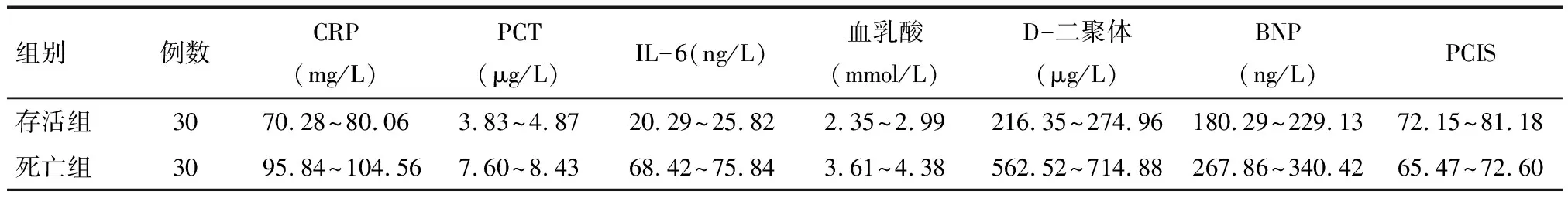
表3 脓毒症存活组与死亡组生化指标比较 95% CI
2.2 对照组、存活组与死亡组Bip、IRE1及XBP1 mRNA相对表达水平的比较 对照组、存活组与死亡组Bip、IRE1及XBP1 mRNA相对表达水平的差异有统计学意义(P<0.01),存活组Bip、IRE1及XBP1 mRNA相对表达水平高于对照组(均P<0.01),而低于死亡组(均P<0.01)。见表4、5。
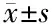
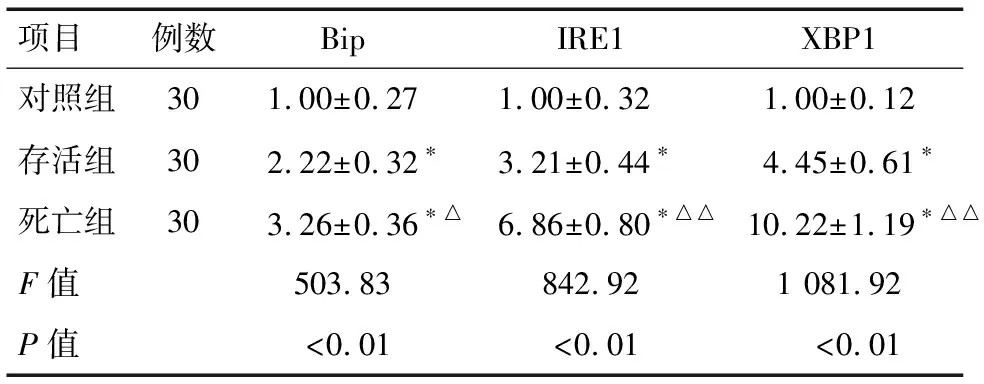
项目例数BipIRE1XBP1对照组301.00±0.271.00±0.32 1.00±0.12存活组302.22±0.32∗ 3.21±0.44∗ 4.45±0.61∗死亡组303.26±0.36∗△6.86±0.80∗△△10.22±1.19∗△△F值503.83842.921 081.92P值<0.01<0.01<0.01
*与对照组比较P<0.01;与存活组比较△P<0.05,△△P<0.01
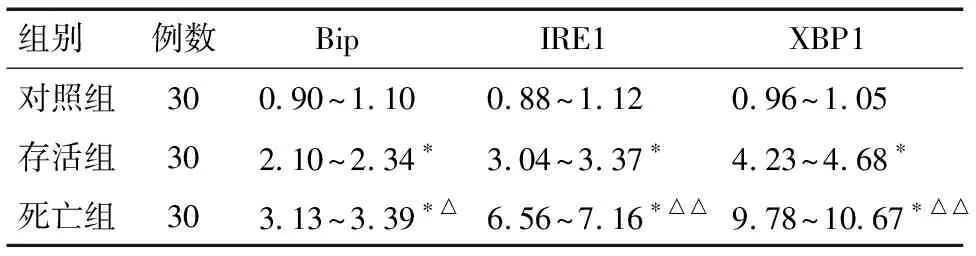
表5 3组Bip、IRE1及XBP1 mRNA相对表达水平比较 95% CI
*与对照组比较P<0.01;与存活组比较△P<0.05,△△P<0.01
2.3 Real-time PCR产物琼脂糖凝胶电泳 产物位于预期位置,进一步确定产物特异性,见图1。
3 讨论
内质网是新合成的多肽链折叠成熟的场所。不同生理病理因素阻碍新合成多肽链的折叠成熟,致大量未折叠和错误折叠蛋白在内质网聚集,为应对这种紊乱产生的一系列应激反应,称为ERS,包括UPR、内质网超负荷反应和固醇调节级联反应等[8]。当内质网腔内未折叠形态的蛋白聚集时,固有的伴侣蛋白从内质网膜蛋白的腔面解离下来,结合到未折蛋白。内质网膜蛋白与伴侣蛋白分离从而被激活,启动UPR。这些跨内质网膜的蛋白一般是N-端向腔内,C-端向胞浆。正常情况下这些蛋白的N-端结合了内质网伴侣蛋白Bip,阻止了蛋白之间的聚集。当存在异常折叠蛋白堆积时,Bip解离下来,跨膜蛋白之间聚集活化,启动UPR。IRE1、双链依赖的蛋白激酶R样内质网激酶和激活转录因子6作为UPR通路中的3个关键因子,在UPR时有序激活,并发挥作用,降低未折叠蛋白浓度[9]。多种因素如缺血再灌注损伤、氧化应激、同型半胱氨酸等化学物质处理、细胞内蛋白质合成过快以至于超过蛋白折叠能力、内质网钙代谢紊乱、卵磷脂合成障碍等多种物理、化学或遗传因素等均可引发ERS,刺激过强或过久则会发生细胞损伤及炎性反应,最终导致致细胞凋亡[10]。正常状态下,Bip与IRE1结合位于内质网膜上处于无活性状态,ERS时,未折叠蛋白在内质网内堆积使Bip从IRE1解离,转而去结合未折叠蛋白,解离后的IRE1构象和极性发生变化,磷酸化并二聚化,从而激活其RNA酶的活性,改变XBP1 mRNA的开放阅读框,其翻译产物XBP1能促进内质网Bip、钙网蛋白等表达,以减轻或中止ERS,从而恢复细胞内环境稳态[11]。因此Bip和XBP1表达上调常被当作ERS的标志[12]。
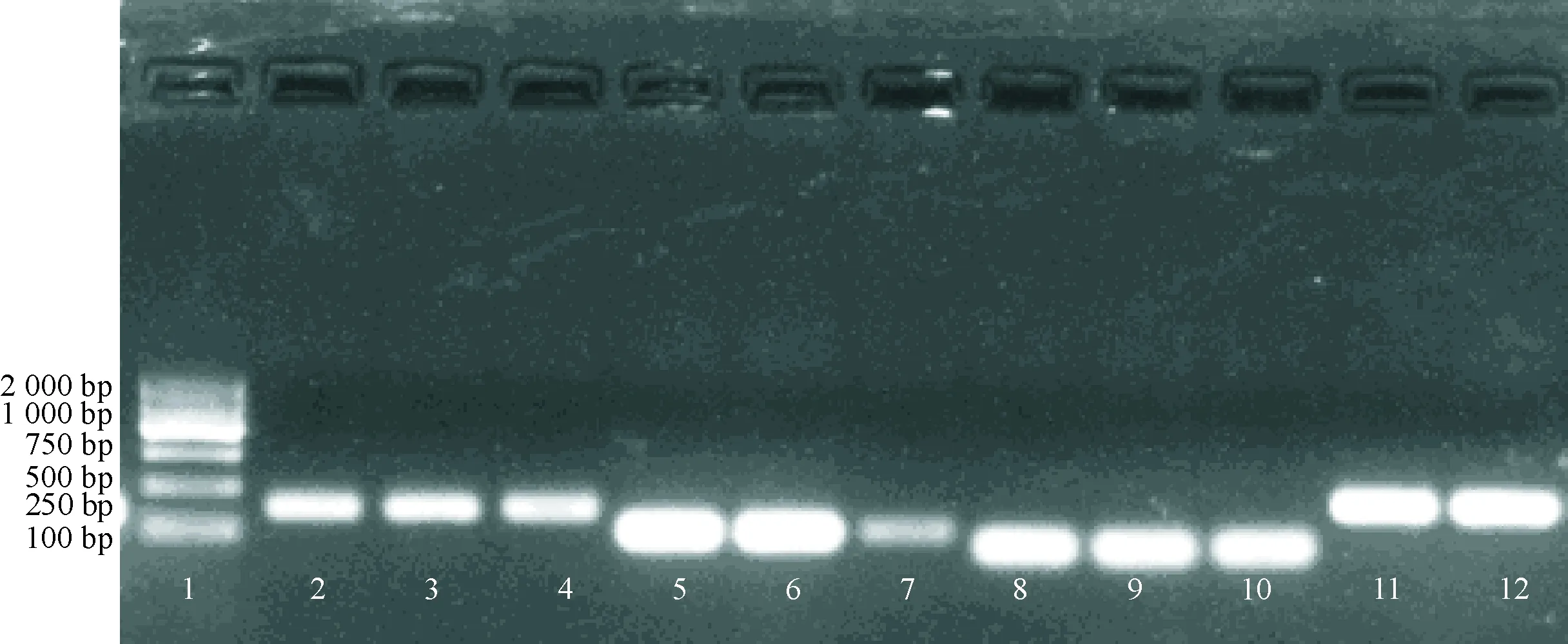
1:DNA Marker;2~4:IRE1;5~7:β-actin;8~10:XBP1;11~12:Bip
脓毒症是指因感染引起宿主炎症和免疫反应失调而导致危及生命的器官功能障碍,脓毒症常伴有免疫紊乱,主要表现为T淋巴细胞亚群的功能紊乱,促炎介质和化学因子释放,细胞因子风暴造成MODS[13-14]。近年机体免疫反应及ERS成为脓毒症研究的热点,但多限于细胞或动物实验[15],人体脓毒症ERS的相关研究较少,且尚未见脓毒症CD4+T淋巴细胞ERS存在及所起作用的研究报道。
本研究证实,脓毒症CD4+T淋巴细胞Bip、IRE1及XBP1 mRNA相对表达水平升高,且死亡组CD4+T淋巴细胞Bip、IRE1及XBP1 mRNA相对表达水平高于生存组,提示脓毒症CD4+T淋巴细胞存在ERS,且ERS是由IRE1途径的活化实现,且ERS IRE1途径的活化程度与病情的严重程度可能相关。轻度适当的ERS可清除未折叠蛋白/错误折叠蛋白,促进内环境稳定;感染严重,刺激过强则导致未折叠蛋白/错误折叠蛋白不能及时清除,细胞稳态不能及时回复,激活相关途径诱导细胞坏死/凋亡,CD4+T淋巴细胞Bip、IRE1及XBP1 mRNA表达水平的明显升高意味着大量CD4+T淋巴细胞发生坏死/凋亡,CD4+T细胞的凋亡还影响了其在信号传导中的作用,产生大量的炎性因子[16],从而参与脓毒症及MODS的发生、发展[17]。故而推测抑制ERS,可能减轻细胞凋亡,增加脓毒症的存活率。
脓毒症病理生理机制较为复杂,即使通过积极治疗仍效果欠佳,与ERS及其介导的细胞坏死/凋亡和不受控制的炎性反应有关。探索ERS在脓毒症中的具体机制,尝试对ERS通路进行干预,可能是将来脓毒症治疗的新途径。

