米黄色脂肪细胞诱导分化方法研究
寇艳波,刘庆亚,张 波,汤仁仙,王玉刚
肥胖已成为全球流行性疾病,其伴随的各种并发症严重威胁着人类的身心健康[1-2]。肥胖发生的最直接原因就是能量物质的摄入大于机体的消耗。能量物质储存于脂肪细胞内,造成脂肪细胞肥大和增生,引发肥胖[3]。哺乳动物脂肪细胞主要分为3类:白色脂肪细胞、棕色脂肪细胞和米黄色脂肪细胞[4]。白色脂肪细胞通过胞内单一的大脂滴储存甘油三酯。棕色脂肪细胞通过解耦联蛋白-1(uncoupling protein 1,Ucp1)将化学能转变为热能[5]。米黄色脂肪细胞可以多个小脂滴的形式储存能源物质,又能够高水平表达UCP1[6-7]。
米黄色脂肪和棕色脂肪能有效抵抗高脂饮食引起的肥胖[8-9]。由于棕色脂肪只存在于婴儿期,而米黄色脂肪伴随整个生命过程,因此,越来越多的研究者们提出促进米黄色脂肪的形成将是防治肥胖的有效手段[10]。本研究旨在建立稳定的脂肪前体细胞向米黄色脂肪细胞分化的方法,并从整体水平检测脂肪前体细胞和米黄色脂肪细胞基因表达的差异,为进一步揭示米黄色脂肪细胞形成的调控机制打下基础。现报道如下。
1 材料和方法
1.1材料小鼠脂肪前体细胞系3T3-L1购自武汉大学细胞保藏中心,细胞诱导分化试剂包括IBMX(3-异丁基-1-甲基黄嘌呤)、地塞米松、吲哚美辛、罗格列酮、三碘代-L-甲状腺原氨酸购自Sigma,小鼠胰岛素购自Peprotech。油红染料购自Sigma,Ucp1、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma, Pparγ)、PR结构域蛋白16 (PR domain containing 16, Prdm16)抗体购自Abcam,内参β-Actin抗体购自Abclonal。
1.2方法
1.2.1细胞培养小鼠脂肪前体细胞系3T3-L1培养选用DMEM(Dulbecco’s Modified Eagle Medium)高糖培养基,培养过程中添加10%胎牛血清以及100 U·mL-1的青霉素和0.1 mg·mL-1的链霉素。
1.2.2脂肪前体细胞系诱导分化培养小鼠脂肪前体细胞3T3-L1至细胞汇合,更换新鲜培养基后继续培养48 h使细胞接触抑制。48 h后用无菌的PBS将细胞充分洗涤,换用新的含有米黄色脂肪细胞分化混合液(2 mg·L-1地塞米松、0.5 mM IBMX、1 μM罗格列酮、1 nM三碘代-L-甲状腺原氨酸、125 μM吲哚美辛、5 mg·L-1胰岛素)的培养基再次培养48 h,诱导分化。最后换用含有5 mg·L-1胰岛素,1 μM罗格列酮,1 nM三碘代-L-甲状腺原氨酸的新鲜培养基继续培养细胞并隔日换液,于第8天左右完成脂肪前体细胞向米黄色脂肪细胞的分化。
1.2.3油红染色用异丙醇配制质量分数为0.5%的油红母液(现用现配),溶液经滤纸过滤后,按照6(油红母液)∶4(水)的比例进行稀释,获得油红染色工作液。分化成熟的脂肪细胞经PBS洗涤2遍后,加入质量分数为4%的多聚甲醛固定10 min。固定后的细胞经PBS漂洗后加入体积分数为60%的异丙醇浸洗2 min。弃掉异丙醇后,加入油红工作液染色15 min。弃掉油红染液后,细胞用体积分数为60%的异丙醇再次洗涤至背景基本无色。显微镜观察脂滴形成情况。
1.2.4荧光定量PCR收集分化前和分化后的3T3-L1细胞,提取RNA,取总RNA 1 μg进行逆转录获得总cDNA,以不同组的cDNA为模板利用Roche Light Cycler 480荧光定量PCR仪检测米黄色脂肪细胞标志性基因的转录情况,内参为β-actin。引物序列如下:β-actin:5′ CGTTGACATCCGTAAAGACC 3′ 和5′ AACAGTCCGCCTAGAAGCA 3′;Ucp1:5′ AGA-GGTCGTGAAGGTCAGAATG 3′和5′ TGACATTTC-TCATTAGATTAGGGGT 3′;Pparγ:5′ TTCAAGGG-TGCCAGTTTCG 3′和5′ CCATCTTTATTCATCAG-GGAGG 3′;Prdm16:5′ GAGATGCTGACGGATACA-GAGGT 3′和5′ GGCGAGGTTTTGGTCATCAC 3′。
1.2.5Westernblot细胞经含有蛋白酶抑制剂的RIPA裂解液裂解后,测定蛋白浓度。每孔上样总蛋白30 μg进行SDS-PAGE,转印至PVDF膜后用质量分数为5%的脱脂奶粉室温封闭2 h,用Ucp1、Pparγ、Prdm16一抗4 ℃孵育过夜,洗涤后二抗孵育1 h再次洗涤后分别检测目的蛋白存在。

2 结果
2.1脂肪前体细胞向米黄色脂肪细胞分化方法的建立生长至汇合的3T3-L1细胞,经48 h的接触抑制后,更换含有米黄色脂肪细胞分化混合液的新鲜培养基诱导分化48 h。诱导分化完成后,经胰岛素、罗格列酮和三碘代-L-甲状腺原氨酸维持分化4 d,显微镜观察脂滴形成情况。3T3-L1分化前为典型的成纤维状,细胞轮廓清楚,多为突起的纺锤形或星形的扁平状结构;分化后细胞体积明显增大,呈圆形或椭圆形,且细胞内有多个清亮的小脂滴存在,见图1A。为进一步评价细胞的分化效率,进行了油红染色,结果显示分化后绝大多数细胞(>90%)均呈油红染色阳性,表明绝大多数细胞已完成分化,见图1B。
2.2米黄色脂肪细胞的确定由于白色脂肪细胞内也含有大量脂滴,因此油红染色并不能完全确定分化后的脂肪细胞即为米黄色脂肪细胞。白色脂肪细胞和米黄色脂肪细胞的形成均受转录因子Pparγ的调控[11],但是白色脂肪细胞和米黄色脂肪细胞在基因表达上呈现出很大的差异,米黄色脂肪细胞以高表达Ucp1和Prdm16为标志。因此,接下来检测分化后细胞中Ucp1、Pparγ和Prdm16的表达。如图2A所示,分化过程中米黄色脂肪细胞标志性基因Ucp1、Pparγ和Prdm16转录均明显上调;与之相对应的是,western blot结果显示分化后的细胞与未分化细胞相比,Ucp1、Pparγ和Prdm16蛋白水平也呈现多倍的增加(图2B)。通过本方法诱导分化的脂肪细胞高表达米黄色脂肪细胞标志蛋白,表明分化后的细胞为米黄色脂肪细胞。
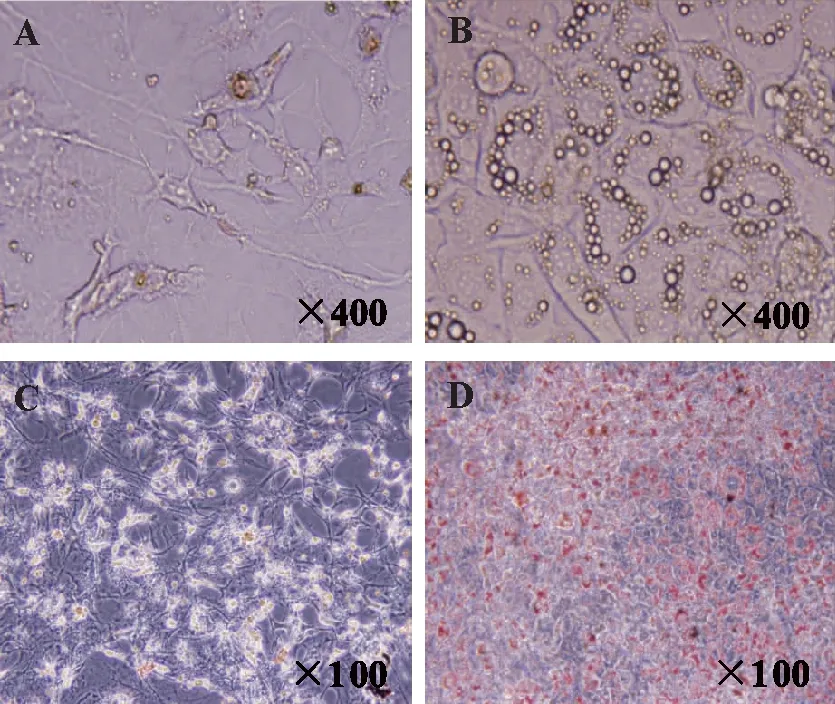
A、B:未染色脂肪前体细胞和分化后脂肪细胞;C、D:油红染色后脂肪前体细胞和分化后脂肪细胞。图1 分化后脂肪细胞形态观察及脂滴形成验证
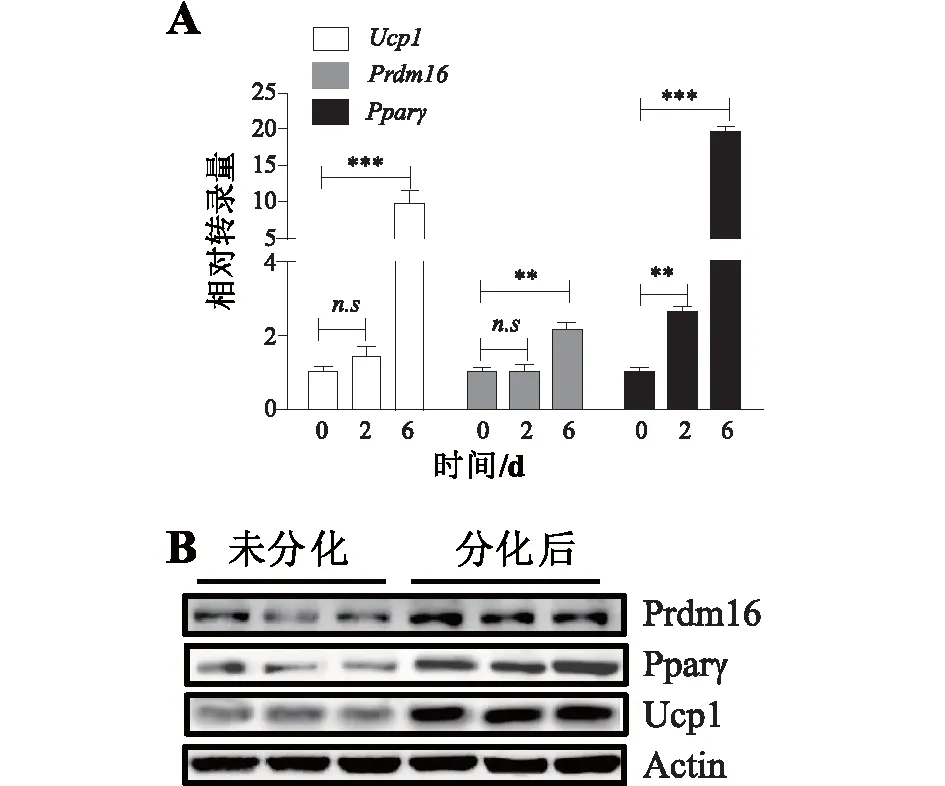
A:荧光定量PCR检测分化前后的脂肪细胞中Ucp1、Pparγ、Prdm16的转录; B:Western blot检测分化前后Ucp1、Pparγ、Prdm16蛋白表达。图2 米黄色脂肪细胞标志蛋白表达的检测
2.3米黄色脂肪细胞与脂肪前体细胞基因表达差异分析为进一步研究米黄色脂肪细胞形成的调控机制,对脂肪前体细胞3T3-L1和分化后的米黄色脂肪细胞进行了转录测序分析。数据分析时分为两组,分别是未分化的3T3-L1和分化成熟的米黄色脂肪细胞,每组3个平行。DEG(different expression genes)统计结果如图3A所示,分化前和分化后的3T3-L1基因表达情况出现明显的差异;其中分化前与分化后相比,1 993个基因发生了明显的上调,1 538个基因明显下调表达,13 771个基因没有明显的上下调变化。进一步分析表明,这些差异表达基因与细胞代谢密切相关;生物信息学分析表明,这些基因编码的蛋白参与了脂类代谢、氨基酸代谢、碳源代谢以及TCA循环等(图3B)。这说明米黄色脂肪细胞与脂肪前体细胞代谢上存在明显差异,也再次表明本实验中采用的诱导方法,可以使脂肪前体细胞分化为米黄色脂肪细胞。
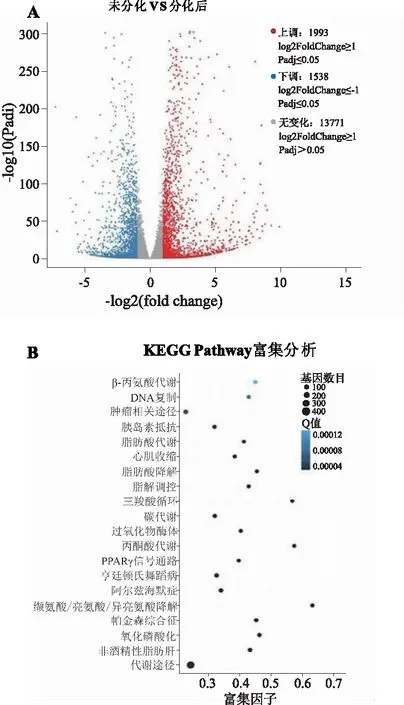
A:差异表达基因的Volcano-plot分布图;B:差异表达基因KEGG pathway分析。图3 分化前后3T3-L1差异基因分析
3 讨论
肥胖伴随的各种并发症,如Ⅱ型糖尿病、心血管疾病,甚至肿瘤,严重影响着人类健康[12-14]。研究肥胖发生发展的分子机制对预防和治疗肥胖及其并发症的发生将具有重要意义。
机体中棕色脂肪细胞和米黄色脂肪细胞均可高表达解耦连蛋白Ucp1,能够将化学能转变成热能耗散掉,增加机体棕色脂肪和米黄色脂肪比例理论上能够增加能量消耗,减少能源物质堆积,防止肥胖发生。由于人体中棕色脂肪只存在于婴幼儿时期,而米黄色脂肪伴随终生,因此本研究通过地塞米松、IBMX、罗格列酮、三碘代-L-甲状腺原氨酸、吲哚美辛和胰岛素诱导分化以及罗格列酮、三碘代-L-甲状腺原氨酸和胰岛素的维持分化,最终可将脂肪前体细胞诱导分化为成熟的米黄色脂肪细胞。油红染色结果表明,分化成熟的米黄色脂肪细胞中含有多个小脂滴,这与已有的研究报道结果一致[15]。荧光定量PCR和Western blot检测结果表明,分化后的细胞中米黄色脂肪细胞标志蛋白Ucp1、Pparγ和Prdm16的表达相比于未分化的脂肪前体细胞明显上调,表明此法可以将脂肪前体细胞诱导分化为米黄色脂肪细胞。
米黄色脂肪细胞主要存在于白色脂肪组织中,与白色脂肪细胞来源相同,它们的分化均受Pparγ调控,成熟的米黄色脂肪细胞和白色脂肪细胞胞内都含有脂滴。本研究中,判断分化成熟的脂肪细胞是否是米黄色脂肪细胞时,不仅观察了脂滴的存在形式和Pparγ的表达,同时也检测了米黄色脂肪细胞功能蛋白Ucp1和关键转录因子Prdm16的表达。在观察到胞内存在多个小脂滴且Ucp1、Pparγ、Prdm16表达均显著上调的情况下,判定分化后的脂肪细胞为米黄色脂肪细胞。
3T3-L1细胞系经诱导分化为米黄色脂肪细胞后,整体基因表达发生非常明显的变化。首先,其基础代谢状态发生改变,KEGG pathway分析表明参与脂肪酸合成和降解代谢的基因出现明显的富集,表明分化后的脂肪酸的合成和降解均比较活跃,这是脂肪细胞基本的代谢特征[16]。此外,氨基酸代谢,如丙氨酸、缬氨酸、亮氨酸和异亮氨酸以及碳源的代谢也呈现明显富集。值得注意的是,Ppar信号途径在米黄色脂肪细胞分化的过程中也出现明显的富集,这与文献报道一致,说明本研究中建立的米黄色脂肪细胞分化方法是成功的。差异表达基因中除包括上述参与各种代谢的基因外,还有许多转录因子也呈现不同程度的上调或下调,如zf-C2H2、Homeobox、ARID、COE、RHD等家族的转录因子。这些转录因子的上下调将从基因表达调控的层面激活米黄色脂肪细胞代谢及行使功能所需的基因,并抑制与米黄色脂肪细胞无关基因的表达。
米黄色脂肪能够高表达Ucp1,将机体积累的能源物质转变为热能,是机体重要的代谢调控者,通过人为干预,控制机体中米黄色脂肪细胞的含量,来调节体内的能源物质水平,特别是脂类的含量,将是改善肥胖所致的代谢紊乱及引起的各种并发症的有效手段。但是由于目前人们对米黄色脂肪细胞形成的过程和机制认识尚浅,因此以米黄色脂肪细胞为靶点的防治肥胖的手段尚未建立。本研究建立了体外诱导脂肪前体细胞向米黄色脂肪细胞分化的方法,并对未分化和分化后的细胞进行了初步的转录测序分析,更深入的分析及机制研究将揭示米黄色脂肪细胞形成的机制,也将为以米黄色脂肪细胞为靶点的防治肥胖药物的开发研究提供理论依据。
——细胞脂类代谢的细胞器

