儿童特应性皮炎2 620例疾病严重程度相关因素分析
吴媛媛 郑洁 肖风丽
安徽医科大学第一附属医院皮肤性病科 安徽医科大学皮肤病研究所,合肥 230032
特应性皮炎(AD)是一种常见的多因素引起的伴严重瘙痒的慢性复发性炎症性皮肤病,不同年龄患者有不同临床表现。AD的发病机制复杂,涉及遗传因素和环境因素的交互影响。了解影响AD疾病严重程度的相关危险因素有助于采取针对性预防措施并优化护理。目前最常用的评估AD严重程度的方法是AD积分指数(scoring atopic dermatitis index,SCORAD)[1]。有研究表明,AD疾病严重程度与金黄色葡萄球菌在皮肤的定植密度、血清胸腺基质淋巴细胞生成素水平、血清活化调节因子水平、白细胞介素18以及经皮失水量等有关[2-3],但这些指标在临床上并不适用。本研究分析AD疾病严重程度与临床常见相关因素之间的关系,为临床预测AD患儿疾病发展情况及防治提供一定的依据。
一、资料
2005年11月至2015年5月,在安徽医科大学第一附属医院皮肤科及全国AD样本收集协作网(包括全国30余家三甲医院皮肤科),收集2 620例0~12岁AD患儿,其中男1 639例,女981例。患儿间无血缘关系,均符合1980年Hanifin-Rajka提出的AD诊断标准。由2名皮肤科副主任及以上医师通过病史、辅助检查确诊。病例收集得到安徽医科大学医学伦理委员会批准(20150130),患儿合法监护人签署知情同意书。
二、方法
1.调查表设计:采用统一自制调查表对每例患者进行详细的问卷调查,并进行皮肤科专科检查。调查表内容包括患者一般信息、发病年龄、病程等,通过询问病史和临床检查获取临床数据。
2.病例分组和分层:根据SCORAD评分将AD患儿划分为轻度组(SCORAD≤15分)、中度组(15分<SCORAD≤40分)和重度组(SCORAD>40分)[1]。将患儿依照伴发症状和其他相关表型进行分层,①一般情况:按性别分为男童组和女童组,以秦岭-淮河为界划分为南方地区组和北方地区组;②特应史:将同时患有AD及过敏性鼻炎和/或哮喘者归类为有个人特应史,反之为无个人特应史;将一、二、三级亲属中至少1位患有AD过敏性鼻炎或者哮喘的AD患儿归类为有家庭特应史,反之为无家庭特应史;③早年发病:首次发病年龄≤2岁定义为早年发病;④出汗时瘙痒:依据患儿自述和询问患儿父母得知;⑤伴发表现:包括干皮症、鱼鳞病、掌纹症、毛发苔藓、眶周黑晕、头皮皮炎、耳廓下裂隙等7项,根据伴发情况分为“有”和“无”两组;⑥血清免疫球蛋白E(IgE)水平:由收集样本单位提供检测结果,20家单位采用AllergyScreen过敏原定量检测系统测定血清总IgE水平,IgE<100 IU/ml为阴性(正常),≥ 100 IU/ml为阳性(升高);6家单位应用酶联免疫吸附法(ELISA)检测血清总IgE。
3.统计学处理:所有数据经核对后用Excel建立数据库,采用SPSS16.0软件进行统计分析。疾病严重程度相关因素的单因素分析采用χ2检验;采用多元有序Logistic回归分析AD疾病严重程度影响因素,将具有统计学意义的因素纳入有序Logistic回归分析,计算OR值和95%置信区间(CI)。P<0.05表示差异有统计学意义。
三、结果
1.一般情况:2 620例AD患儿中,男1 639例,女981例,性别比为1.7∶1。平均年龄3.4岁(0.4~12岁),初发年龄(0.78±1.59)岁。轻度占8.8%,中度占52.6%,重度占38.6%。见表1。
2.影响疾病严重程度的单因素分析:见表1。不同地区、是否早年发病及有无出汗时瘙痒、干皮症、鱼鳞病、掌纹症、毛发苔藓、眶周黑晕、头皮皮炎、耳廓下裂隙的患儿组间AD疾病严重程度分布差异均有统计学意义(均P<0.01);而不同性别、是否有特应史以及是否血清IgE水平增高的患儿组间差异均无统计学意义(均P>0.05)。
3.影响疾病严重程度的多因素有序Logistic回归分析:见表2。以AD疾病严重程度(轻、中、重度)为因变量,将单因素分析具有统计学差异的因素作为自变量,纳入有序多分类Logistic回归模型,经平行性检验,P>0.05,满足多元有序Logistic回归平行性假设条件,该回归模型有统计学意义。多因素分析结果显示,南方地区、早年发病、出汗时瘙痒、干皮症、鱼鳞病、掌纹症、毛发苔藓、眶周黑晕、头皮皮炎、耳廓下裂隙均与AD疾病严重程度呈正相关(均P<0.05)。从地区对疾病严重程度的影响来看,以北方地区组为基准进行比较,南方地区与重度AD呈正相关,OR为2.10。
四、讨论
本文2 620例患儿中,男童所占比例高于女童,但AD疾病严重程度与性别无关,与Wananukul等[4]的研究一致。有研究显示,有特应史的儿童比无特应史的儿童发生AD的风险更大,但是否有特应史与AD疾病严重程度无关[4-5]。本研究结果显示,有无特应史组间疾病严重程度分布差异均无统计学意义。
目前尚无可靠的生物标志物用于AD的常规诊断和与其他类似皮肤状况的鉴别,在实践中最常见的相关实验室检测指标是IgE,约80%的AD患者IgE水平升高[6]。本研究中,仅12.06%的患儿血清IgE水平增高,且与AD疾病严重程度无关。这可能与AD的自然发展过程有关,从婴儿期至成人期,由于受遗传和环境的影响,患儿从最初的未致敏至逐渐产生针对食物或环境变应原的IgE抗体,从而发生过敏性鼻炎或哮喘,呈现过敏性进程[7],故不同年龄段的疾病严重程度与血清IgE水平的关系并不一致,血清IgE水平不能反映儿童AD的病情变化。
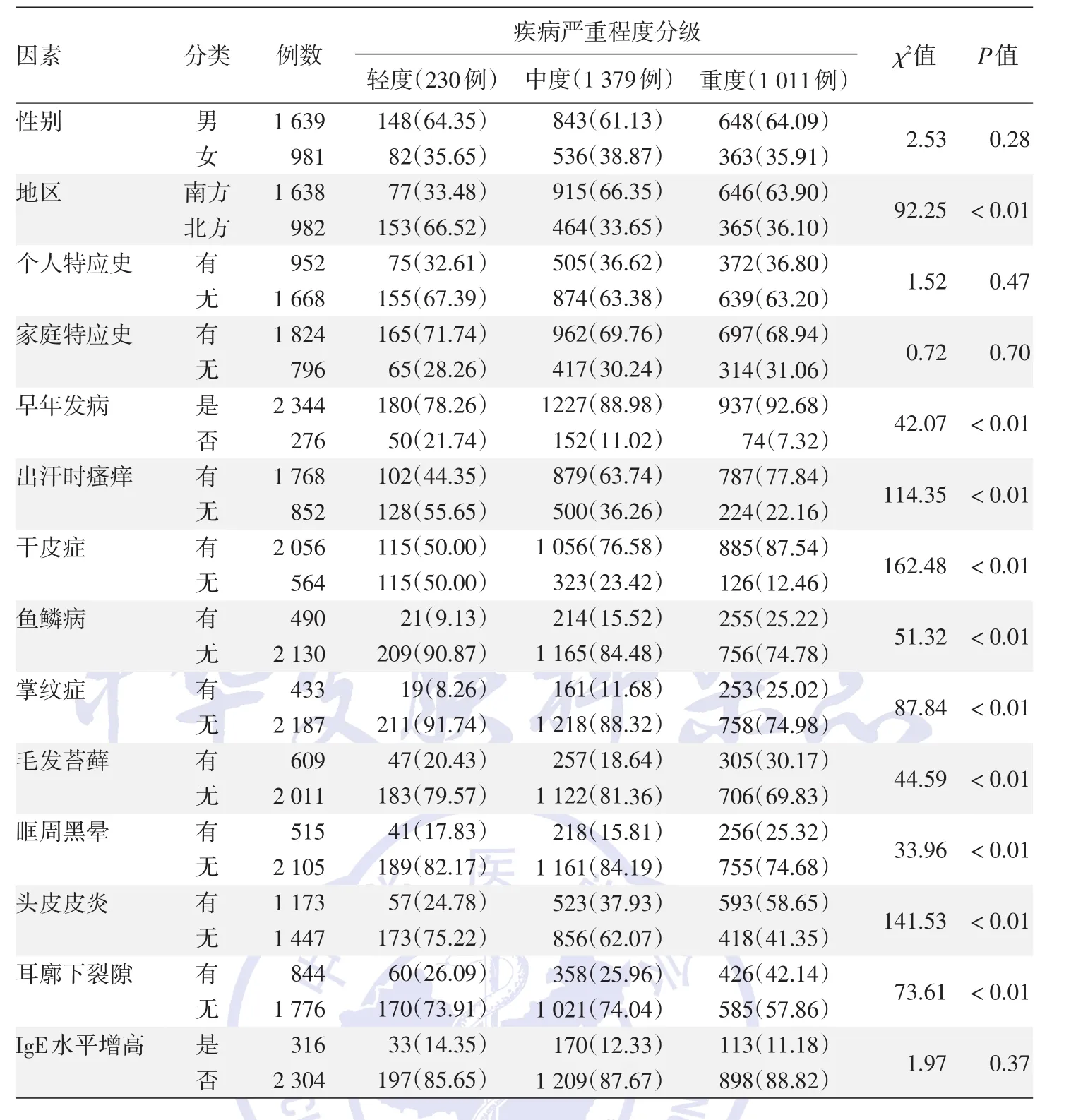
表1 特应性皮炎患儿2 620例疾病严重程度相关因素的单因素分析 例(%)
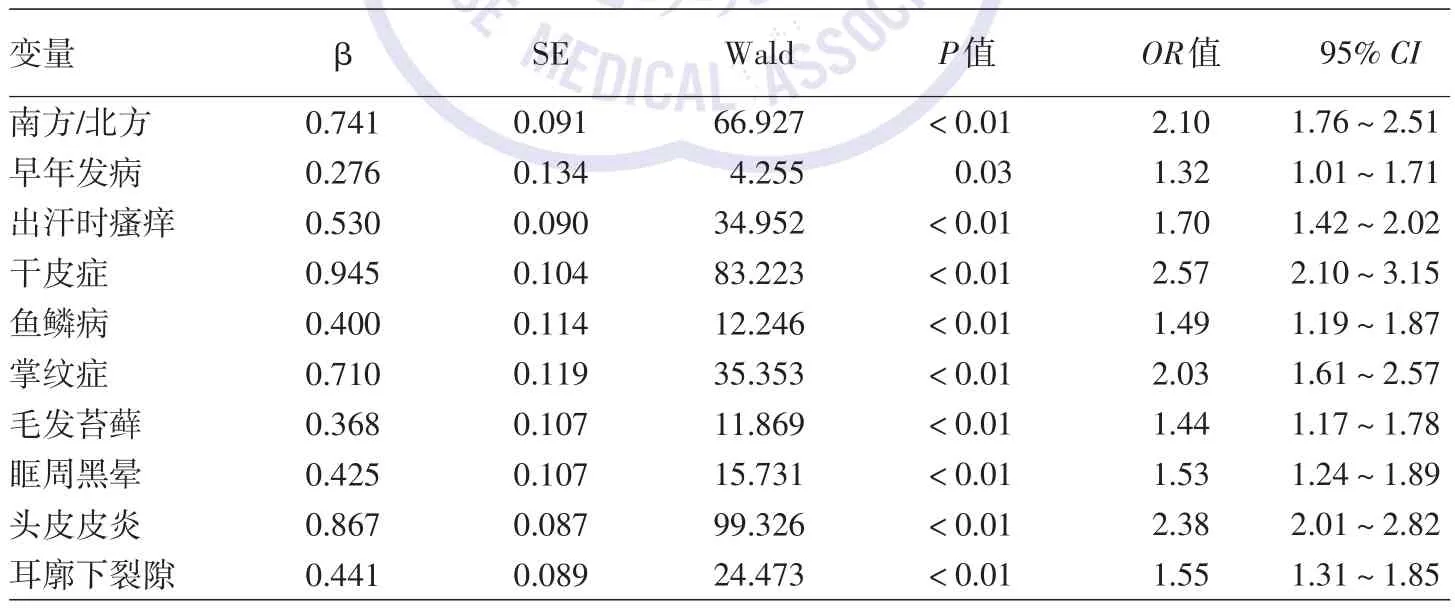
表2 特应性皮炎患儿2 620例疾病严重程度相关因素的多元有序Logistic回归分析
本研究结果表明,与北方地区患儿相比,南方地区患儿AD疾病严重程度更重,与本团队前期关于地域差异的研究一致[8]。Kantor和Silverberg[9]研究表明,AD 患病率的增加不仅与遗传因素有关,也与不同环境因素的相互作用有关,包括地区的气候、温度、空气污染物、水质、地区卫生条件等。然而,有研究显示,在气候较温暖的地区AD的患病率反而下降[9]。高温在AD中如何起到保护作用的机制目前尚不清楚,但是研究显示,环境温度可以直接影响角质形成细胞[10]。气候温暖地区的人们可能会花更多的时间进行户外运动,因此紫外线暴露的时间也更多,这些都可能导致AD病情加重[11]。本研究由于样本的选取受收集单位的影响,具有一定的地域差异,南方地区的患者比例更大,因此研究结果也会具有一定的偏倚,AD疾病严重程度与地域之间的联系有待进一步探究。
已经证明,早发性AD和疾病严重程度相关[12]。本研究亦显示,早年发病的患儿发生严重AD的概率是迟发型AD患儿的1.32倍。瘙痒是AD患儿中最常见的特征之一,且瘙痒作为SCORAD评分的一部分,与AD患儿疾病严重程度的评估密切相关。德国一项关于AD患儿瘙痒程度的研究显示,瘙痒与AD严重程度之间有显著相关性[13]。本研究亦显示,出汗时瘙痒的伴发比例在轻、中、重度AD组中依次升高,与AD疾病严重程度呈正相关。
干皮症、毛发苔藓是AD常见的临床表型。有研究显示,聚丝蛋白(FLG)基因突变c.3321delA是一种亚洲特异性突变,是中国人群中最常见的突变,占AD患者的15%,与AD患者的干燥表型相关,而干皮症作为干燥表型中的一种,常常由FLG突变导致[14]。毛发苔藓是一种皮脂腺缺失、毛干细胞异常以及上皮角化过度的慢性毛囊角化性疾病,毛周角化与AD有关,且35%的病例存在FLG突变[15]。流行病学研究显示,毛发苔藓与AD疾病严重程度密切相关[6]。Flohr等[16]发现,FLG突变与皮肤屏障损伤、皮肤干燥、湿疹表型和疾病严重程度显著相关[17]。本研究显示,干皮症、毛发苔藓在重度AD患儿中伴发比例分别为87.54%和30.17%,均大于在轻度和中度AD患儿中的伴发比例,表明干皮症和毛发苔藓与疾病严重程度相关。鱼鳞病、掌纹症和毛发苔藓被称为鱼鳞病三联征。鱼鳞病和掌纹症均与FLG突变有明确的相关性[14]。本研究中,鱼鳞病在轻、中、重度AD组中伴发比例依次为9.13%、15.52%、25.22%,掌纹症依次为8.26%、11.68%、25.02%,均呈递增的趋势。
眶周黑晕作为AD诊断标准次要症状之一,存在于高达84%的AD患者中,敏感性为78%,特异性为76%[18]。本研究显示,眶周黑晕的发生率为19.66%,重度AD组伴发眶周黑晕的比例为25.32%,较轻度和中度组高。Guo等[19]研究显示,婴儿AD最常见的表现为面部皮炎、干燥和头皮皮炎,且头皮皮炎比例随着年龄的增长而下降。本研究可见,头皮皮炎在轻、中、重AD组中所占比例依次为24.78%、37.93%和58.65%,呈递增的趋势。耳廓下裂隙是AD常见的次要诊断特征,可作为评估AD疾病严重程度的标准之一,本研究显示,耳廓下裂隙与疾病严重程度呈正相关,OR值为1.55。Kwatra等[20]的研究结果显示,耳廓下裂隙与AD严重程度直接相关。
总之,本研究显示,地区、早年发病、出汗时瘙痒、干皮症、鱼鳞病、掌纹症、毛发苔藓、眶周黑晕、头皮皮炎、耳廓下裂隙等均与AD疾病严重程度相关。评估AD的疾病严重程度不但对监测治疗效果有很大作用,也对统一治疗方案评价标准至关重要。

