赤羽病病毒Gc405aa—480aa肽段的高效可溶性表达及抗原性鉴定
王建华,张俊哲,赵 丹,王玉玲,肖 妍
(天津海关,天津 300456)
赤羽病是危害牛、羊等反刍动物繁殖性能的重要虫媒疫病,以流产、早产,产死胎、木乃伊胎,以及胎儿畸形,新生胎儿发生关节弯曲积水性无脑综合症(简称AH综合征)为特征,主要流行于澳大利亚以及东南亚、东亚、中东和非洲等热带和亚热带地区[1-4],给流行地区的牛、羊养殖业造成一定经济损失。自20世纪90年代以来,我国上海和新疆等地也有本病的报道[5-6],因此该病对我国牛、羊养殖业的威胁不容忽视。在分类上,赤羽病病毒(Akabane virus,AKAV)属于布尼病毒科(Buny aviridae)布尼病毒属(Orthobunyavirus)辛布(Simbu)病毒血清群成员,为单股负链RNA 病毒。AKAV基因组由大(L)、中(M)、小(S)3个RNA 片段构成,其中M RNA 编码1个由1 401个氨基酸组成的M蛋白前体。该前体进一步裂解为Gn和Gc囊膜糖蛋白和1个非结构Nsm蛋白[7-8]。研究证实,G1蛋白为AKAV的一种由936个氨基酸残基组成的囊膜蛋白,相对分子质量为120 kD,存在多个抗原表位区。该蛋白不仅参与病毒粒子对宿主细胞的侵入、装配和成熟过程,也可刺激机体产生中和抗体[9-10],在赤羽病诊断试剂和疫苗研制方面具有潜在应用价值。为此,本研究对Gc405aa—480aa肽段编码序列,经密码子优化后进行基因合成,利用大肠杆菌原核表达系统成功实现了Gc405aa—480aa肽段的高效可溶性表达,并对该重组肽段进行了纯化和抗原性鉴定,以期为后续开展Gc蛋白单克隆抗体制备、B细胞表位鉴定和诊断试剂研制奠定基础。
1 材料与方法
1.1 菌株、参考血清和主要试剂
宿主菌E.coli. BL21(DE3)、山羊抗AKAV阳性血清:由天津海关动植物与食品检测中心反刍动物检疫实验室保存;HRP标记的兔抗山羊二抗:购自JACKSON 公司;氨苄青霉素、IPTG和Ni-NTA Agarose:购置于GIAGEN公司;BugBuster®Master Mix和 Immobilon-PSQPVDF膜:购自MERCK公司;QuickblokTM封闭液、洗涤液和DAB显色试剂盒:购自碧云天生物技术公司。
1.2 Gc405aa—480aa肽段抗原表位区预测及原核表达载体构建
使用IEDB 数据库(Immune epitope database)中的Bepipred Linear Epitope Prediction 2.0软件,对AKAV KM-1/Br/06毒株M基因编码的Gc蛋白(GenBank:BAG54921.1)线性抗原表位进行在线分析,对Gc蛋白的1个75氨基酸肽段(405aa—480aa)的编码序列,送由上海捷瑞生物技术公司经密码子优化后进行人工合成,通过BamHI/SalI位点,连接到原核表达载体PET-32a,构建重组表达载体PET-Gc405aa—480aa,再通过测序结果验证表达序列是否正确。
1.3 重组rHis-Gc405aa—480aa肽段的诱导表达
将重组表达载体PET-Gc405aa—480aa转化的E.coli BL21(DE3)感受态细胞进行扩大培养,按1%接种量接种于新鲜LB培养基中。当菌液OD600约为0.5时,加入终浓度为0.1 mmol/L的IPTG,在28 ℃、200 r/min振摇条件下继续培养8 h,离心收集菌体;按5 mL/g比例,将湿菌加入细菌裂解液BugBuster®Master Mix,混匀,作用10 min,4 ℃、12 000 r/min 离心20 min;分别收集菌体裂解液、上清和沉淀,加入等量2×Loading Buffer,沸水水浴5 min;按常规方法进行SDS-PAGE,分析重组肽段的表达情况。
1.4 重组rHis-Gc405aa—480aa肽段的大量表达及纯化
将1 L新鲜LB培养液,按1.3条件诱导培养重组菌后,6 000 r/min 离心5 min,收集菌体;用0.1 mol/L、pH7.5 的PBS液洗涤菌体1次,6 000 r/min 离心5 min,收集菌体;按5 mL/g,将湿菌加入细菌裂解液BugBuster®Master Mix,混匀,冰浴10 min,4 ℃、12 000 r/min 离心20 min,然后收集裂解液上清。将裂解液上清移入装有Ni+-NTA树脂的重力柱,在冰浴条件下结合1 h;依次用20、60和80 mmol/L咪唑浓度的洗涤液各洗涤2次,每次10 min,最后用300 mmol/L咪唑浓度的洗脱液洗脱。将洗脱液装入透析袋中,用透析液(pH8.0、50 mmol/L 的 Tris-HCl)4 ℃透析过夜,收集的透析液即为纯化的重组rHis-Gc405aa—480aa肽段。用IMPLEN超微量分光光度计,测定重组rHis-Gc405aa—480aa肽段浓度,再用SDSPAGE分析纯化后的重组肽段纯度。
1.5 重组rHis-Gc405aa—480aa肽段的抗原性鉴定
将 纯 化 的 重 组 rHis-Gc405aa—480aa肽 段, 经SDS-PAGE胶电泳分离后,转移至PVDF 膜上,用QuickblokTM封闭液封闭过夜;用洗涤液洗涤3次后,加入1:50稀释的山羊抗AKAV阳性血清,37 ℃ 孵育1 h,再用洗涤液洗涤3次,每次5 min;加入1:5 000稀释的HRP标记兔抗山羊二抗IgG,37 ℃ 孵育1 h,用洗涤液洗涤3次,每次5 min;使用DAB试剂盒显色,拍照。
2 结果
2.1 Gc405aa—480aa肽段预测及重组表达载体构建
使用IEDB 数据库对AKAV Gc蛋白(GenBank:BAG54921.1)进行在线预测分析,预测1个由75氨基酸组成肽段(405aa—480aa)的抗原性及亲水性,结果见图1。在图1-A中,纵坐标数值代表对应横坐标位置的氨基酸抗原性数值,以0.5为阈值,数值越高表示该置的氨基酸抗原性越强,黄色区域为该肽段预测存在抗原表位的区域。图1-B为该肽段亲水性预测结果,其中黄色区域为亲水区,绿色区域为疏水区。对Gc405aa—480aa肽段的编码序列,经密码子优化后进行DNA片段合成,构建重组表达载体PET-Gc405aa—480aa,经测序证实该DNA合成片段的碱基序列及编码的氨基酸序列完全正确(图2)。
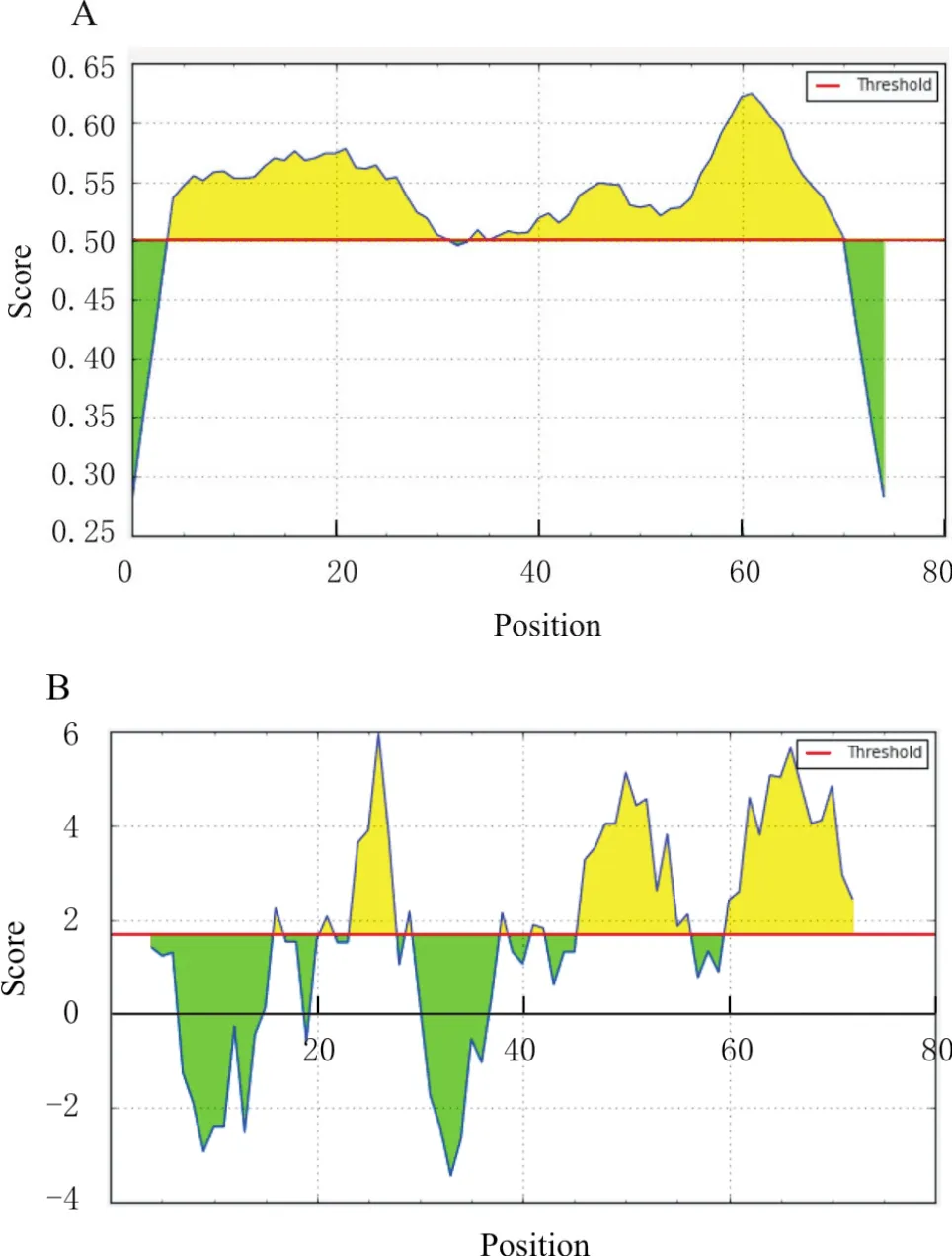
图1 Gc405aa—480aa肽段的抗原性和亲水性预测结果

图2 人工合成的DNA序列及编码的氨基酸序列
2.2 重组Gc405aa-480aa肽段的诱导表达及纯化
SDS-PAGE显 示, 在28℃、0.1 mmol/L的IPTG中诱导8 h后,PET-Gc405aa—480aa重组菌的裂解液在26 kD处出现1条蛋白条带,与预期重组肽段蛋白分子质量一致,而未诱导的重组表达菌裂解液中缺失此蛋白条带,凝胶图像分析表明该重组肽段的表达量占菌体总蛋白的50%(图3)。进一步分析显示,重组Gc405aa—480aa肽段完全存在于诱导表达菌的裂解液上清中,表明该重组肽段完全以可溶性形式表达。对含有重组Gc405aa—480aa肽段的上清液用Ni+-NTA树脂进行亲和层析纯化,依次用60、80 mmoL/L咪唑浓度的洗涤液洗涤,发现取得的纯化效果最好,纯化后的重组Gc405aa—480aa肽段纯度为94%,质量浓度为2.0 mg/mL(图3)。
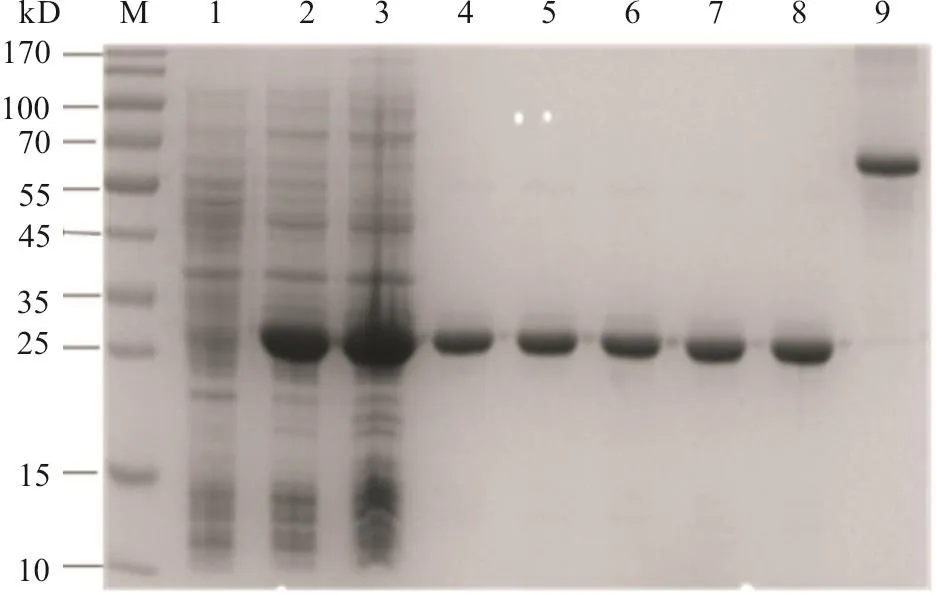
图3 重组Gc405aa—480aa肽段的表达和纯化的SDS-PAGE分析
2.3 重组Gc405aa—480aa肽段的Western blot鉴定
以山羊抗AKAV阳性血清,对纯化的重组Gc405aa—480aa肽段进行Western blotting分析检测,发现在26 kD处出现1条清晰的特异性反应条带(图4),表明该重组肽段可被山羊抗AKAV阳性血清识别,具有良好的反应原性。
3 讨论
赤羽病是危害牛、羊等反刍动物健康和生产性能的重要疫病,而高质量诊断试剂可为赤羽病的诊断、检疫和防控工作提供技术支撑。众所周知,诊断抗原的抗原性和纯度是制约ELISA方法敏感性和特异性的重要因素。研究发现,辛布病毒群的S基因节段序列同源性很高,其编码的N蛋白是群特异性抗原[11]。因此,无论是使用AKAV全病毒抗原,还是使用重组N蛋白抗原建立的ELISA检测方法,均存在与同群其他病毒感染抗体发生交叉反应的不足。然而,辛布病毒群M基因节段的序列变异性较大,其编码Gc蛋白的氨基酸序列同源性仅为33.1%~47.3%,而Gc蛋白在AKAV各分离株之间的同源性却很高[12-14],这提示选用Gc蛋白为检测抗原可能是提高AKAV血清抗体ELISA检测方法特异性的有效途径。
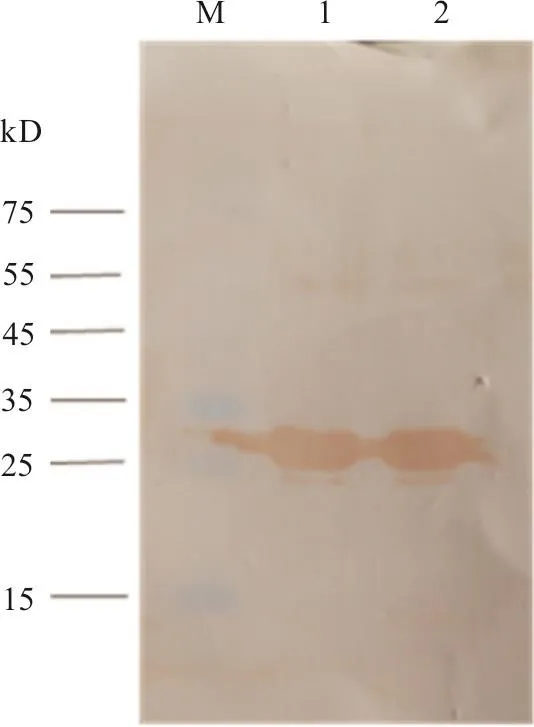
图4 重组Gc405aa—480aa肽段的Western blot分析
利用原核表达系统表达外源蛋白具有表达量高、生产周期短和成本低的优点,但用该表达系统表达大分子质量的GC蛋白比较困难,需要对多个GC蛋白的强抗原区进行截短筛选表达及抗原性鉴定。目前国内仅有徐树兰等[15]对Gc蛋白156aa—476aa区域进行了截短表达及抗原性鉴定,但该重组蛋白是以包涵体形式表达的。本研究对Gc405aa—480aa肽段编码序列经密码子优化后进行基因合成,构建重组原核表达载体PETGc405aa—480aa,实现了重组 rHis-Gc405aa—480aa肽段在大肠杆菌中的高效可溶性表达。在纯化重组rHis-Gc405aa—480aa肽段的方法上,本研究采用细菌裂解液BugBuster®Master Mix替代超声波破碎菌体,因而减少了对目的蛋白的损伤;通过对洗涤液最适咪唑浓度的确定,获得了大量高纯度的重组rHis-Gc405aa—480aa肽段。Western blotting显示,重组rHis-Gc405aa—480aa肽段对AKAV阳性血清呈现良好的反应原性,表明该重组肽段在AKAV单克隆抗体制备、B细胞表位鉴定以及血清抗体ELISA检测试剂盒研发方面具有良好的应用前景。

