H5亚型禽流感病毒实时荧光RT-PCR方法的建立与应用
蒋文明,李 阳,程善菊,刘华雷
(中国动物卫生与流行病学中心,国家禽流感专业实验室,山东青岛 266032)
1996年,我国首次从广东省鹅体内分离到H5N1亚型高致病性禽流感病毒(Highly pathogenic avian influenza virus,HPAIV)[1]。从2003年末开始,H5N1亚型禽流感疫情在东南亚多个国家的家禽中暴发,包括越南、泰国、韩国、日本、柬埔寨和印度尼西亚。2004—2015年,我国多个省份暴发H5N1亚型高致病性禽流感疫情,导致超过2 000万只禽类被扑杀,给养禽业造成巨大经济损失。2005年底,我国针对H5亚型AIV开始实行大规模强制免疫政策,并有效控制了疫情。实践证明,在禽流感防控方面,疫苗免疫发挥了巨大作用[2]。但是不可否认,疫苗免疫也带来了一系列问题,如加快了病毒变异速度,使得疫苗必须进行相应更新换代[3]。我国使用的禽流感疫苗从最初的N28、Re-1到Re-4、Re-5,再到Re-6、Re-8,到最新的Re-11、Re-12一直在不断更新。病毒变异是由于其血凝素(Hemagglutinin,HA)基因中核苷酸变异引起的。而核苷酸的加速变异会导致以HA基因为靶基因检测方法特异性、敏感性的下降,出现假阴性结果。
现行检测方法中,行业标准《禽流感病毒RTPCR检测方法》(NY/T 772—2013)采用的是普通RT-PCR方法。该方法检测耗时长,需电泳后判定结果,容易造成环境核酸污染。国家标准《H5亚型禽流感病毒荧光RT-PCR检测方法》(GB/T 19438.2—2004)因制定时间太久,可能已不能满足临床病毒变异检测需求。本研究比对了近年来分离到的H5亚型HPAIV HA基因核苷酸序列,在其保守区设计1对引物和1条探针,建立了H5亚型HPAIV实时荧光RT-PCR方法,并进一步验证了该方法的特异性和敏感性,同时与临床上常使用的两种试剂盒进行对比,以期为该病的快速检测、诊断提供技术支撑。
1 材料与方法
1.1 病毒
30株 H5亚 型 HPAIV(5株 H5N1、5株H5N2、15株H5N6、5株H5N8),H7N9、H9N2等亚型AIV,以及新城疫病毒、禽传染性支气管炎病毒、传染性法氏囊病毒:均由本实验室分离保存。
1.2 试剂盒
QIAamp Viral RNA Mini Kit:购自 Qiagen 公司;HiScript II One Step qRT-PCR Probe Kit:购自Vazyme公司;TOPO载体克隆试剂盒:购自CloneSmarter公司;禽流感(AIV-H5)核酸扩增(PCR)荧光检测试剂盒:购自深圳匹基生物工程股份有限公司(批号20180302);禽流感病毒H5亚型实时荧光RT-PCR检测试剂盒:购自北京世纪元亨动物防疫技术有限公司(批号AIVH5 20180702P)。
1.3 引物设计
根据近年来GenBank数据库中公布的H5亚型AIV基因序列以及本室分离的H5亚型AIV序列,针对HA基因序列保守区,设计1对引物及1条探针(专利申请中,序列待公开)。探针5'端标记FAM,3'端标记BHQ1。
1.4 实时荧光RT-PCR方法建立
根据QIAamp Viral RNA Mini Kit操作说明,提取H5亚型病毒RNA。在反应体系中依此加入2×qRT-PCR Buffer 10.0 μL,引物、探针各 1.0 μL(10 μmol/L),Enzyme Mix 1.0 μL,最后加入RNA模板 6 μL。RT-PCR反应条件为:50 ℃10 min,95 ℃ 2 min,然后进行40个循环(95 ℃ 10 s,60 ℃ 30 s,收集荧光信号)。将PCR产物进行琼脂糖凝胶电泳分析,经胶回收后连接TOPO载体,然后进行测序。
1.5 实时荧光RT-PCR方法优化
对反应体系中的不同引物和探针浓度组合( 引 物 1.0、0.8、0.6、0.4、0.2 μmol/L, 探 针1.0、0.5、0.4、0.3、0.2、0.1 μmol/L)以及反应体积(50、20 μL)和扩增时反应参数(反转录5、10、15 min,退火延伸20、30 s)等条件进行摸索和优化,以达到最优组合。
1.6 敏感性试验
提取病毒RNA,用微量核酸分析仪测定病毒RNA含量。将RNA作10倍倍比稀释,取6.0 μL稀释后的RNA模板,加入到14.0 μL qRT-PCR预混液中,然后采用建立的荧光定量RT-PCR方法进行检测,确定其灵敏度。
1.7 特异性试验
利用优化的实时荧光RT-PCR方法,分别检测H5N1、H5N2、H5N6、H5N8、H7N9、H9N2, 以及新城疫病毒、禽传染性支气管炎病毒等常见禽类病毒,检验该方法的特异性。
1.8 与临床同类试剂盒比较
以10倍倍比稀释的RNA为模板,对比本研究建立的方法与H5亚型AIV核酸扩增(PCR)荧光检测试剂盒(深圳匹基生物工程股份有限公司)、H5亚型AIV实时荧光RT-PCR检测试剂盒(北京世纪元亨动物防疫技术有限公司)的敏感性。以实验室分离测序确定的H5病毒RNA为模板,对比该方法与两种试剂盒的特异性。
1.9 临床应用
利用建立的实时荧光RT-PCR方法,对临床发病家禽的10份组织病料进行检测,检验该方法的准确性。
2 结果
2.1 实时荧光RT-PCR方法的建立及优化
为验证实时荧光RT-PCR引物探针的设计,选取实验室保存的H5N6亚型AIV进行荧光RTPCR检测,结果在实时荧光RT-PCR方法中,H5引物探针能够有效检出H5N6亚型AIV,检测结果见图1。
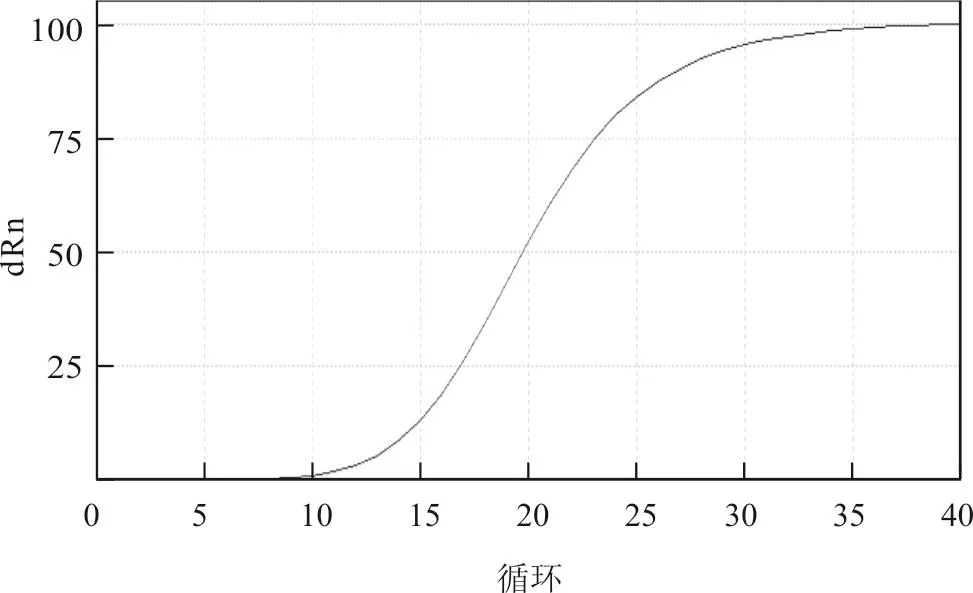
图1 H5亚型AIV实时荧光RT-PCR引物探针验证结果
为进一步说明反应的特异性和准确性,将荧光RT-PCR扩增产物进行2%琼脂糖凝胶电泳和测序验证,结果在约120 bp处看到1条特异性扩增条带(图2);将扩增产物胶回收后连接TOPO载体测序,证实该扩增产物为H5亚型HA基因序列,表明本研究设计的H5亚型引物特异性强,荧光RT-PCR方法特异、准确。

图2 H5亚型AIV实时荧光RT-PCR扩增产物凝胶电泳结果
在实时荧光RT-PCR体系中,通过对反应体系中不同引物和探针浓度组合、反应体积、扩增时反应参数和循环次数等条件的摸索和优化,建立了检测H5亚型AIV的实时荧光RT-PCR方法,经过反复优化和验证,确定实时荧光RTPCR检测方法的最适反应总体积为50 μL(其中模板6 μL),最适引物浓度均为0.4 μmol/L,探针浓度均为0.3 μmol/L。实时荧光RT-PCR最佳反应条件和循环参数为:第1阶段,反转录50 ℃ 10 min;第2阶段,预变性95 ℃ 2 min;第3 阶段,95 ℃ 10 s,60 ℃ 30 s,40 个循环。在第3阶段每次循环的退火延伸时,收集荧光。试验结束后,根据收集的荧光曲线和Ct值判定结果。
2.2 实时荧光RT-PCR方法的特异性
利用建立的实时RT-PCR方法,分别对H5N1、H5N2、H5N6、H5N8、H7N9、H9N2 等亚型AIV,以及新城疫病毒、禽传染性支气管炎病毒、传染性法氏囊病毒进行检测,发现该方法只能扩增H5亚型AIV,对其他亚型AIV及其他禽病病毒扩增均为阴性(图3),表明该方法具有良好的特异性。
2.3 实时荧光RT-PCR方法的敏感性
先测定病毒RNA浓度,然后将提取的RNA依次作10倍比稀释,每个稀释度取6 μL作为模板进行检测。结果显示,该方法可以检测到0.1 fg(10-6稀释)的RNA模板(图4)。

图3 实时荧光RT-PCR方法的特异性试验结果

图4 实时荧光RT-PCR方法的敏感性试验结果
2.4 与其他试剂盒的对比
以实验室分离测序确定的30份H5病毒RNA为模板,对比该方法与两种试剂盒的特异性。结果显示,本研究建立的方法可以将30份H5病毒全部检出,检出率为100%。H5亚型AIV核酸扩增(PCR)荧光检测试剂盒(深圳匹基生物工程股份有限公司)和H5亚型AIV实时荧光RT-PCR检测试剂盒(北京世纪元亨动物防疫技术有限公司)各有1份检测为阴性,检出率均为98%。
将1.6中的RNA依次作10倍倍比稀释,每个稀释度取6 μL为模板,分别用两种商品化H5亚型AIV荧光RT-PCR试剂盒与本研究建立的方法进行比较。结果显示,本研究建立方法的灵敏度均比这两种试剂盒提高了10倍(图5),说明该方法具有良好的敏感性。
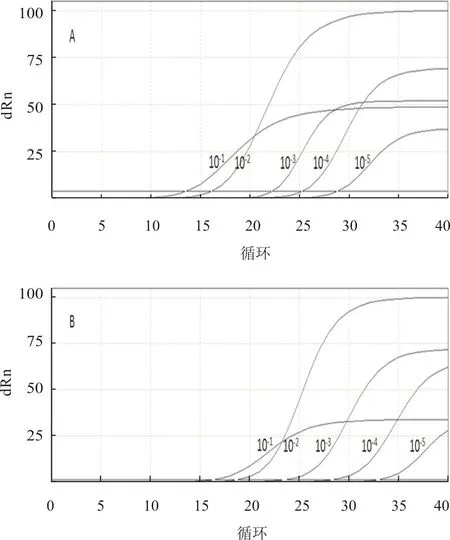
图5 两种商品化H5亚型AIV荧光RT-PCR方法敏感性结果
2.5 临床样品检测
利用建立的实时荧光RT-PCR方法,对临床发病家禽的10份组织病料进行检测,发现有6份阳性。该方法与病毒分离结果相比,符合率为100%(图6),说明该方法具有良好的准确性。
图6 该方法对临床组织样品的检测结果
3 讨论
随着病毒进化,H5亚型AIV一直在不断变异。我国现在的流行毒株与1996年最初分离的病毒A/goose/Guangdong/1/1996(H5N1)HA核苷酸同源性仅 为 90.6%(Re-11)和91.2%(Re-12)。以Re-11和Re-12疫苗株为代表的第2.3.4.4分支和第2.3.2.1分支HA核苷酸同源性仅为88.5%。HA核苷酸的快速变异增加了以核苷酸为靶基因检测方法的难度。
本研究建立和优化了H5亚型AIV实时荧光RT-PCR方法,可以检测出目前常见的H5亚型AIV(包括 H5N1、H5N2、H5N6、H5N8),与其他亚型AIV和其他禽类病原核酸均无交叉反应。该方法的检出率和检测下限均优于商品化H5 AIV核酸扩增(PCR)荧光检测试剂盒(深圳匹基生物工程股份有限公司)和H5 AIV实时荧光RTPCR检测试剂盒(北京世纪元亨动物防疫技术有限公司)。
4 结论
本研究建立的H5亚型AIV实时荧光RT-PCR检测方法具有特异性强、敏感性高等优点,可用于H5亚型高致病性禽流感的流行病学调查、监测和早期诊断。

