蓝舌病I型灭活疫苗免疫绵羊后中和试验和cELISA检出抗体的特点与关系
苗海生,李 乐,廖德芳,寇美玲,孟锦昕,杨振兴,李华春
(云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南昆明 650224)
蓝舌病(Bluetongue,BT)是由呼肠孤病毒科环状病毒属的蓝舌病病毒(Bluetongue virus,BTV)引起的,主要感染绵羊等反刍动物的一种虫媒病毒病。BTV广泛分布于热带、亚热带地区,2006—2009年,BTV-8型疫情在欧洲部分国家大规模流行,造成巨大经济损失,而BTV灭活疫苗的使用成为这些国家有效控制BT疫情的重要手段[1-4]。云南省热带亚热带动物病毒病重点实验室利用纯化的全病毒,通过免疫绵羊和兔子,制备了BTV群特异性抗血清,并通过优化反应条件,建立了BTV cELISA 抗体检测方法。前期研究表明,该方法可检测针对BTV所有抗原表位的抗体。BTV微量血清中和试验(SNT)是检测待检血清中和抗体的方法。该中和抗体针对的是BTV感染动物的主要结合位点,可用于评价抗体阻断BTV感染的效果。
本研究利用BTV-1型灭活疫苗免疫30只绵羊,另设6只作为空白对照,定期采集血清,用BTV cELISA和SNT方法同时检测绵羊血清抗体,比较抗体产生的时间以及抗体的符合性、相关性,分析不同检测方法的特点和相互关系。
1 材料与方法
1.1 试验动物、细胞和毒株
36只成年考摩型细毛绵羊:经检测确定为BTV抗体阴性,购自云南省种羊繁育扩繁中心;BHK-21细胞和BTV-1型毒株:由云南省热带亚热带动物病毒病重点实验室保存。
1.2 主要试剂
蓝舌病cELISA试剂盒:云南省热带亚热带动物病毒病重点实验室制备;MEM维持液原粉:购自Gibco公司;洗液(PBST):0.01 mol/L 的PBS溶液中加入0.5%的Tween-20;稀释液(PBSTM):0.01 mol/L的PBS溶液中加入0.05%的Tween-20和5%的脱脂奶粉;单组分TMB底物:购自BIO BASIC INC公司。
1.3 cELISA血清抗体检测
取出试剂盒提供的96孔ELISA板,按每孔10 μL加入待检血清、阴性对照血清、阳性对照血清、强阳性对照血清;所有孔加入用稀释液作 1 000倍稀释的兔抗BTV血清,50 μL/孔,置于37 ℃培养箱中反应1 h;用PBST洗板1次,加入1 000倍稀释的HRP标记绵羊抗兔IgG,50 μL/每孔,于37 ℃培养箱中反应30 min;用PBST洗板5次,拍干后按50 μL/孔加TMB显色剂,室温避光显色10 min,然后按50 μL/孔,加1.24 mol/L的硫酸终止反应,最后用ELISA读板仪在450 nm处读取结果。将OD450nm按公式PI=(抗原对照平均OD450nm-样品OD450nm)/抗原对照平均OD450nm,换算为抑制率(Present inhabitation,PI)。当PI≥40%时,判为BTV抗体阳性;PI<40%时,判为BTV抗体阴性。
1.4 中和抗体检测
首先将所有血清放入56 ℃的水浴锅内灭活30 min。在微量细胞培养板(96孔板)所有孔,分别加50 μL MEM细胞维持液;在第1排孔中,加入待检血清以及阳性和阴性对照血清各50 μL,每个样品2孔,即第1排孔血清为1/2倍稀释。混匀后,用移液器从第1排孔内吸取50 μL移入第2排孔,则第2排孔内血清为1/4倍稀释,依次照此稀释,则第8排孔内血清为1/256倍稀释。将准备好的 BTV-1型细胞稀释成 100×TCID50(50 μL),然 后 每 孔 加 入 50 μL, 并 设 立 100×TCID50、10×TCID50、1×TCID50的病毒对照和空白对照。将细胞培养板放入37 ℃、5% CO2的培养箱中培养 1 h后,每孔加100 μL BHK-21细胞悬液,继续培养120 h。当对照正常时,用甲基兰染色,进行结果判定。被检血清孔出现大于50%的细胞病变(CPE)时,判为血清BTV抗体阴性;出现小于等于50%的病变时,判为血清BTV抗体阳性。用Karber法计算血清中和抗体效价。
1.5 绵羊免疫及血清样品采集
利用BEI灭活剂,灭活BTV-1型病毒悬液,制备灭活疫苗;利用BHK-21细胞对灭活抗原进行安全性检验,并用ELISA抗原定量方法进行定量;经PEG 6000浓缩后再进行稀释,制备病毒颗粒含量分别为 1、5、10、50、100 μg/mL的疫苗各100 mL;按顺序依次命名为1~5组,另设立免疫PBS乳化液的对照组,每组6只绵羊。首次免疫21 d后进行第2次免疫,各组免疫量同第1次免疫,免疫前和免疫后每周各采集血清1次,直至第5周。将采集的血清样品分别进行BTV cELISA和SNT 检测。
1.6 检测结果统计分析
汇总检测结果,并利用SPSS、EXCEL软件,对检测结果进行统计学分析,比较两种方法检测到抗体在时间上的差异及规律,以及两种检测方法的线性相关性。
2 结果与分析
2.1 cELISA检测结果统计
BTV cELISA检测结果显示,首次免疫后(综合第1~3周)1、2组阳性率均为83.33%,其他2个免疫组抗体阳性率均为100%,对照组抗体阳性率为0,对照组正常(表1)。第2次免疫后(综合第4~5周)各免疫组抗体阳性率均为100%,对照组阳性率为0。各免疫组不同时间(周)的抗体阳性羊数量和抗体阳性率统计见表2。由表2可知,免疫后第1周,抗体阳性率达到80.00%,抗体阳性绵羊数量随时间延长而增加,到第4周(第2次免疫后2周)全部免疫羊转为BTV抗体阳性。值得注意的是,第5组抗体阳性率在首次免疫后明显低于其他组,而它所用的抗原含量却是最高的,这可能与免疫抑制有关。
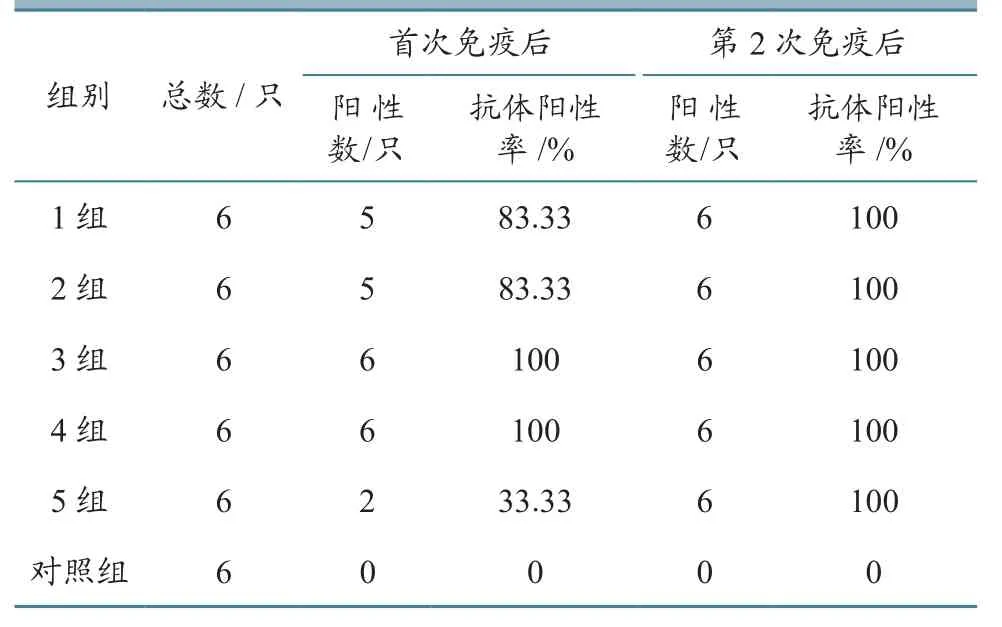
表1 BTV cELISA检测结果统计(按免疫次数)
2.2 SNT检测结果统计
利用SNT方法对所有血清进行中和抗体检测,检测结果见表3,统计结果见表4。由表3、表4可知,SNT抗体阳性率(抗体效价≥16判为阳性)在首次免疫后3周内持续上升,由第1周的6.67%上升至第3周的36.67%,上升幅度高于cELISA抗体。至第3周,46.66%的羊产生了较高的cELISA抗体,而SNT抗体却仍为阴性。第2次免疫后,全部免疫动物的SNT抗体阳性率最高才达到70.00%。由此可见,BTV SNT抗体产生的特点是持续而缓慢。
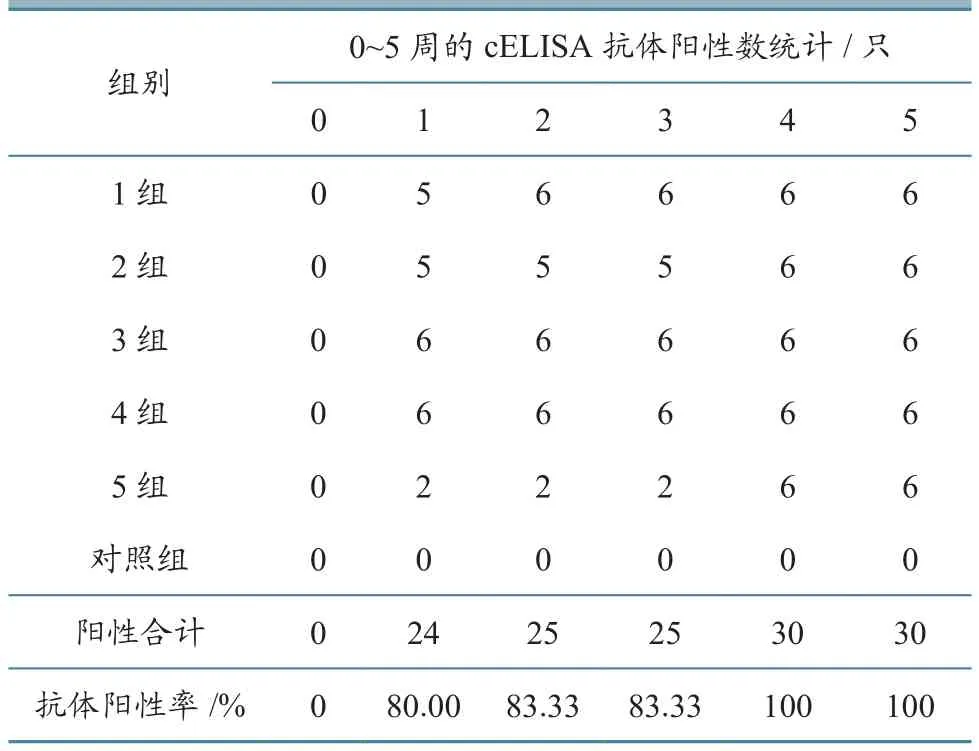
表2 BTV cELISA检测结果统计(按免疫时间)
2.3 cELISA抗体与中和抗体产生时间比较
利用EXCEL对cELISA和SNT检测结果进行分析。由图1可知,免疫后1周,cELISA抗体阳性率为80.00%,抗体产生速度较快,而SNT抗体阳性率仅为6.67%;免疫后5周,cELISA抗体阳性率为100%,SNT抗体阳性率为70.00%;SNT抗体阳性率持续缓慢上升,至第4周(即第2次免疫后1周)抗体水平才出现大幅度上升。
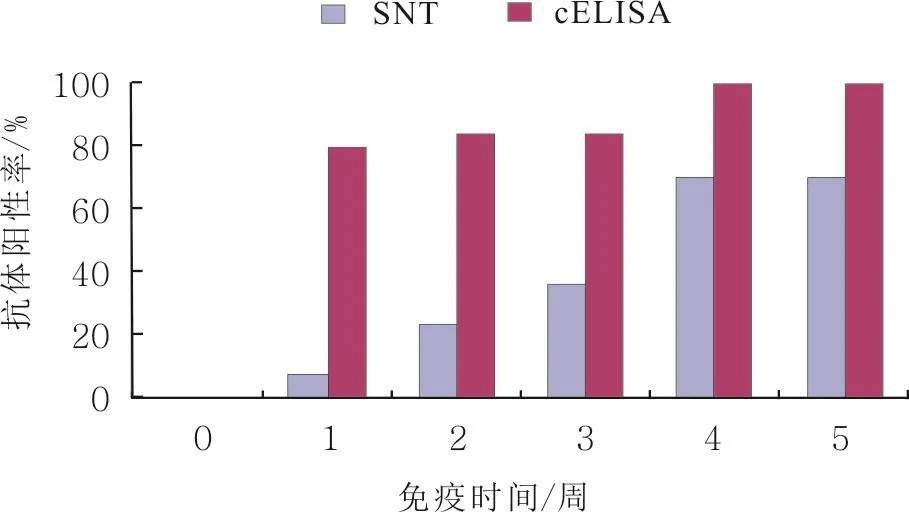
图1 免疫后0~5周的cELISA和SNT抗体阳性率比较
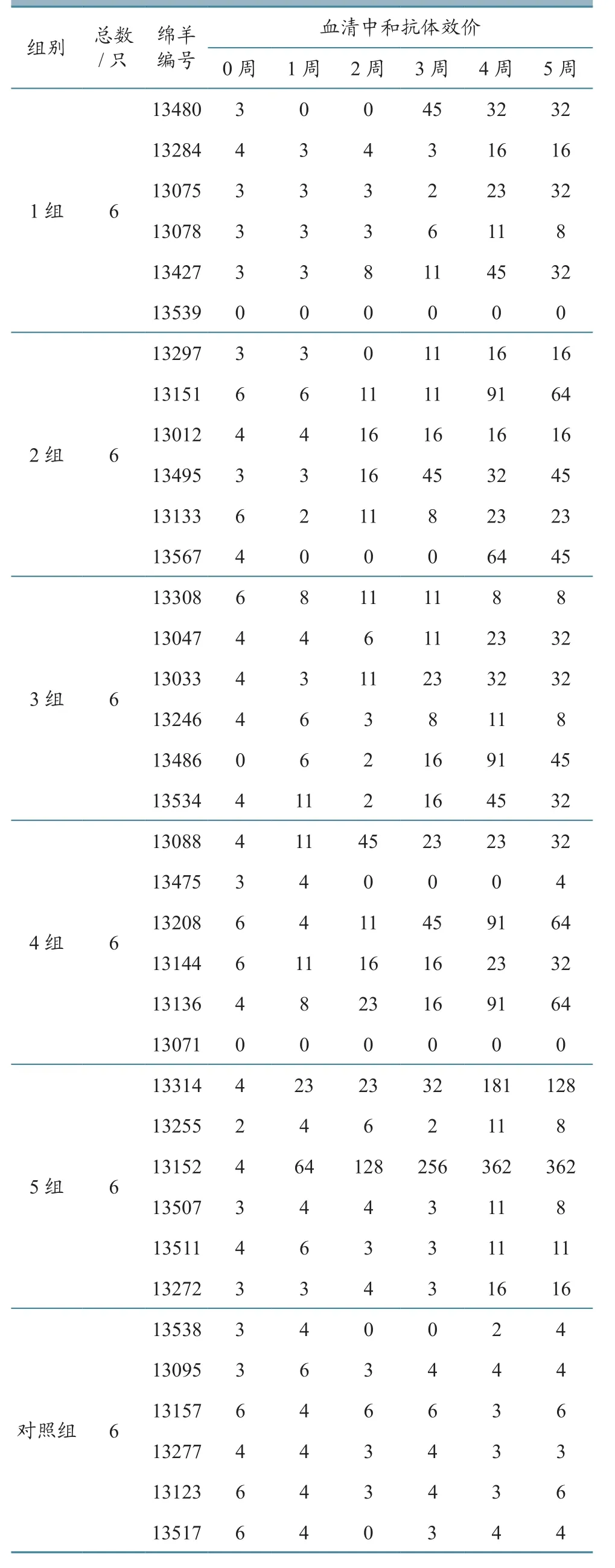
表3 BTV SNT抗体效价检测结果
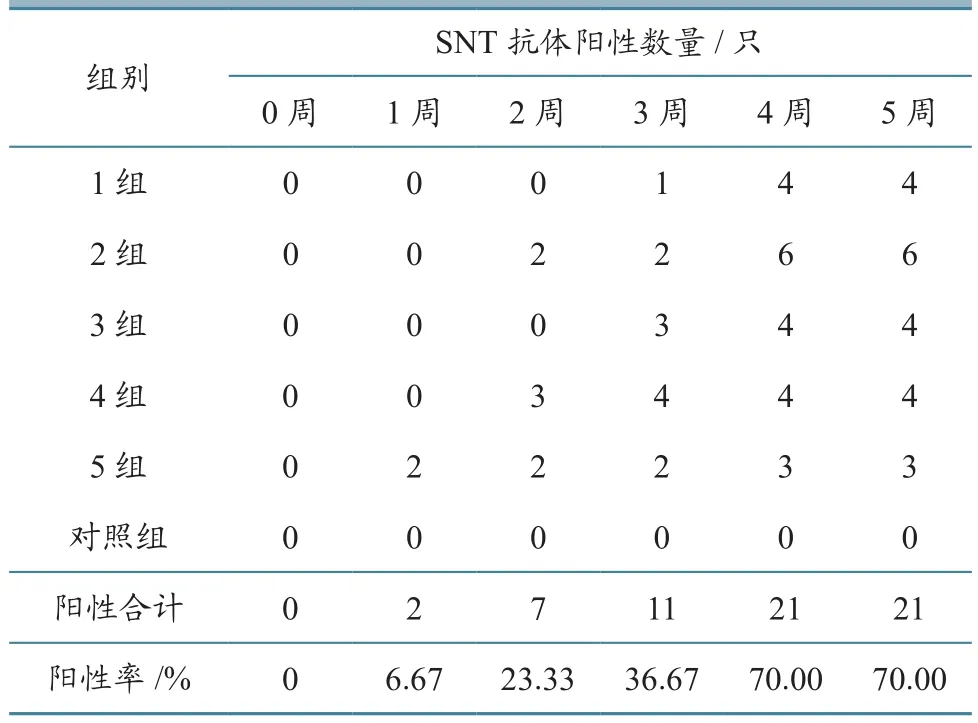
表4 BTV SNT抗体效价检测结果统计
2.4 cELISA抗体和中和抗体符合率随时间变化趋势
由于绵羊产生cELISA抗体快,而产生中和抗体慢,使得很多动物出现cELISA抗体阳性时,中和抗体却仍为阴性,从而产生了cELISA抗体和中和抗体不符合现象。这种现象在免疫初期较多,但是随着中和抗体阳性率的上升逐渐减少(表5),两种检测方法的符合率由23.33%增加到76.67%。
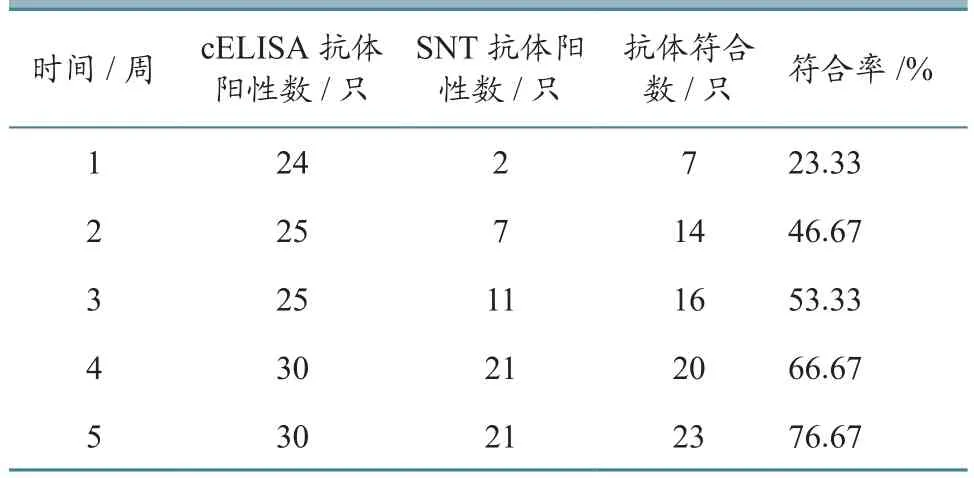
表5 cELISA抗体和SNT抗体检测结果符合率变化统计
2.5 cELISA抗体PI值和中和抗体效价相关性
利用SPSS软件对cELISA PI值和中和抗体效价(log2)检测结果进行线性相关性分析,发现当绵羊同时产生中和抗体和cELISA抗体时,二者有显著的相关关系(r=0.63),相关方程为y=0.38+0.05χ,式中y为抑制率,χ为SNT 效价(log2),见图2。
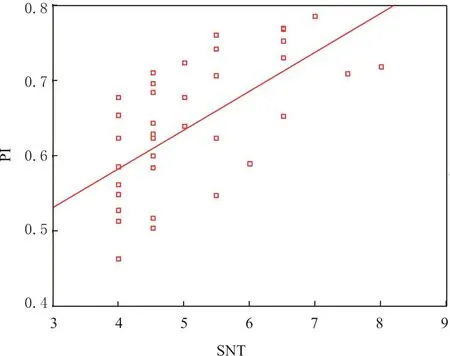
图2 cELISA抗体PI值和SNT抗体效价线性相关关系
3 讨论
本研究使用的BTV cELISA抗体检测方法为云南省热带亚热带动物病毒病重点实验室自行制备的检测方法。该检测方法中与待检血清竞争反应的检测抗体是通过完整病毒颗粒免疫动物获得的多克隆抗体,因此它针对的是BTV所有的抗原表位。中和试验主要针对的是BTV VP7蛋白。VP7蛋白约有349个氨基酸,位于病毒核衣壳表面,呈三聚体结构,其中第134~253位氨基酸所构成的晶体结构位于VP7蛋白三聚体结构外表,是决定VP7蛋白抗原性的主要部位,也是与宿主细胞识别并吸附的主要部位[5-6]。Wang等[7]的免疫电镜法分析结果表明,完整病毒粒子和核心颗粒中至少有6个抗原表位,而且免疫动物能够识别所有这6个抗原表位,其中有2个表位(VP2、VP5)暴露于病毒表面,其余包含在内部。本研究发现,BTV-1型灭活疫苗中与病毒感染相关抗原表位对应抗体的产生时间晚于病毒的其他抗原表位,这也许与VP7蛋白主要抗原表位位于病毒衣壳的中间层,致使该蛋白刺激机体免疫系统产生抗体延迟有关。
BTV非常稳定,在4 ℃条件下可稳定存在6个月以上。这主要是因为BTV衣壳蛋白对温度、pH的抵抗力较强,不容易降解。本研究中,cELISA采用多克隆检测抗体,先期检测到的可能是衣壳外层的VP2和VP5蛋白抗体,故从接种到检测到抗体的时间短,只有待病毒颗粒外层衣壳被降解后,暴露出位于衣壳中间层的VP7蛋白,才会产生针对该蛋白的抗体。两种检测方法的线性相关性表明,一旦该蛋白发挥了免疫原性功能,并且在免疫动物间产生的抗体效价与其他蛋白抗体量线性关系显著,就进一步证实了VP7蛋白在发挥免疫原特性方面与其他蛋白具有同等功能。但部分动物产生了很高的cELISA抗体,却没有产生SNT抗体,其原因仅为推测。要完全证实此推测,并且解决病毒在侵染动物细胞时,是否还有其他蛋白发挥影响以及此影响产生的方式等,还需进一步开展相关研究。

