蓝舌病I型病毒VP5蛋白的表达纯化及免疫原性分析
陈玉梅,党伟华,刘燕凯,周景明,刘红亮,郭亚楠,张改平,王爱萍
(郑州大学生命科学学院,河南郑州 450000)
蓝舌病(Bluetongue,BT)是由蓝舌病病毒(Bluetongue virus,BTV)感染引起的,经昆虫传播的一种疾病[1],被我国列为一类动物疫病。目前尚未发现人类感染BTV的报道[2]。BTV主要感染牛、羊等反刍动物[3],属于呼肠孤病毒科(Reoviridae)环状病毒属 (Orbivirus)蓝舌病病毒亚群(Bluetongue virus subgroup)。现在报道的BTV有27种血清型,且每种血清型之间无交叉保护[4-7]。BTV基因组由大片段(L1~L3)、中片段(M4~M6)、小片段(S7~S10)组成,共编码7种结构蛋白(VP1~VP7)和4种非结构蛋白(NS1、NS2、NS3/NS3a和NS4)[8]。BTV有双层蛋白衣壳结构:VP2和VP5构成外壳,VP3和VP7构成内壳[9]。VP2能够诱导产生中和抗体,而VP5能够增强VP2产生中和抗体的能力,因此VP5可以用于病毒样颗粒装配和基因工程疫苗研究[10]。本研究利用原核表达系统表达了BTV-1型病毒的VP5蛋白,又对其免疫原性进行了研究,以期为进一步研究VP5蛋白奠定基础。
1 材料与方法
1.1 材料
菌种PET-28a:郑州大学分子免疫室保存;IPTG、氨苄青霉素、卡那霉素、Bradford蛋白浓度测定试剂盒:Solarbio公司产品;His单抗、HRP标记的羊抗鼠酶标二抗:Abbkine公司产品;质粒小提试剂盒、DNA纯化回收试剂盒:TIANGEN公司产品。BamHI、XhoI、T4DNA连接酶、蛋白Marker、核酸Marker:由TaKaRa公司提供;BTV-1型灭活病毒:云南省畜牧兽医科学研究院捐赠。
1.2 方法
1.2.1 目的基因合成及引物设计 根据BTV-1 VP5蛋白在NCBI GenBank公布的序列(GenBank accession No.AGW27485.1),按照E.coli密码子的偏爱性,优化BTV-1 VP5蛋白基因序列,同时根据合成的VP5基因序列,设计VP5基因引物:VP5-F:AAGGATCCATGGGTAAAGTGATCCGCTCCCT;VP5-R:AACTCGAGTTAAGCGTTACGCAGGAACAGT。
1.2.2 重组表达载体构建及鉴定 以VP5基因序列为模板进行PCR扩增。程序为:95 ℃ 3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,32 个循环;72 ℃ 10 min。回收目的片段,将VP5和PET-28a分别用BamHI 和XhoI双酶切,连接并转化至E.coli DH5α感受态细胞;挑单克隆培养,将阳性菌液送生物公司测序。
1.2.3 VP5重组蛋白表达及可溶性分析 转化阳性重组质粒至BL21(DE3)感受态细胞,挑单克隆进行培养;将阳性菌液1:100接种于50 mL Kan+抗性的LB培养基,37 ℃震荡培养至OD600nm=0.6时,加入0.2 mmol/L IPTG 25 ℃诱导表达6 h,12 000 r/min离心诱导表达后的菌液10 min;弃上清,用1 mL PBS重悬菌体并进行超声破碎(时间分别为10 min、3 s,间歇3 s,功率为45 w),12 000 r/min离心15 min;分离上清和沉淀,用SDS-PAGE、Western-blot分析蛋白可溶性。
1.2.4 VP5重组蛋白表达条件优化
1.2.4.1 培养基成分优化 表达菌1:100分别接种于10 mL LB和2×YT培养基,37 ℃震荡培养至OD600nm=0.6时,加入0.2 mmol/L IPTG,25 ℃诱导表达10 h;分别在0、2、4、6、8、10 h测菌体OD600nm,分析生长速率,用SDS-PAGE分析目的蛋白表达情况。
1.2.4.2 诱导剂IPTG浓度优化 表达菌1:100接种于6瓶10 mL 2×YT培养基,37 ℃震荡培养至OD600nm=0.6时,分别加入0.2、0.4、0.6、0.8、1.0、1.2 mmol/L IPTG,25 ℃诱导表达10 h;分别在0、2、4、6、8、10 h测菌体OD600nm,分析生长速率,用SDS-PAGE分析目的蛋白表达情况。
1.2.4.3 诱导表达时间 表达菌1:100接种于6瓶10 mL 2×YT培养基,37 ℃震荡培养至OD600nm=0.6时,加入0.2 mmol/L IPTG,25 ℃分别诱导表达2、4、6、8、10 h,用SDS-PAGE分析目的蛋白表达情况。
1.2.4.4 金属离子种类 表达菌1:100接种于5瓶10 mL 2×YT培养基,37 ℃震荡培养至OD600nm=0.6时,分别加入Ca2+、Fe3+、Mg2+、K+,在0.2 mmol/L IPTG 25 ℃条件下诱导表达6 h;分别在0、2、4、6、8、10 h测菌体OD600nm,分析生长速率,用SDSPAGE分析目的蛋白表达情况。
1.2.4.5 诱导温度 表达菌1:100接种于3瓶10 mL 2×YT培养基,37 ℃震荡培养至OD600nm=0.6时,加入0.2 mmol/L IPTG,分别在20、25、30 ℃诱导表达10 h,用SDS-PAGE分析目的蛋白表达情况。
1.2.5 蛋白纯化 取表达后的菌液100 mL,12 000 r/min 离心10 min,弃上清;用10 mL PBS重悬菌体,超声破碎;将超声后的上清液12 000 r/min 离心15 min,0.22 mm滤膜过滤后用镍亲和层析法纯化,通过优化平衡液(50 mmol/L Tris-HCl+300 mmol/L NaCl+咪唑)、洗涤液(50 mmol/L Tris-HCl+300 mmol/L NaCl+咪唑)和洗脱液(50 mmol/L Tris-HCl+300 mmol/L NaCl+咪唑)中咪唑的浓度,使其达到最好的纯化效果,并用SDS-PAGE、Western-blot鉴定纯化效果。
1.2.6 动物试验 将15只6~8周龄的Balb/c小鼠随机分成3组,每组5只。低剂量组,每只免疫20 mg的VP5蛋白;高剂量组,每只免疫40 mg的VP5蛋白;PBS免疫组,作为阴性对照。首免用完全佐剂和蛋白/PBS混合乳化,二免和三免均用不完全佐剂和蛋白/PBS混合乳化。每3周免疫1次,免疫后分别于0、7、14、21、28、35、42、49、56 d尾静脉采血,用Dot-ELISA、间接ELISA评价免疫效果。
1.2.7 免疫效果初步评价
1.2.7.1 Dot-ELISA测定免疫血清与灭活BTV-1反应性 将条状NC膜在磷酸盐缓冲液(PBS)中完全浸湿,室温晾干;取1 mL灭活BTV-1点在膜上,再取1 mL VP5蛋白和1 mL PBS分别作为阳性对照和阴性对照,以1:500稀释的阳性血清作为一抗,1:5 000稀释的HRP标记的羊抗鼠作为二抗,采用AEC显色,分析试验结果。
1.2.7.2 间接ELISA测定免疫血清效价 将纯化的VP5蛋白作为包被原,以80 ng/孔的包被量包被96孔板,每孔50 mL,4 ℃包被过夜;第2天弃去包被液,用PBST洗涤3次,封闭,37 ℃孵育1 h;弃去封闭液,用PBST洗涤3次;测效价时,分别加入起始体积分数为1:100的2倍倍比稀释的免疫血清;抗体消长规律测试时,分别在0、7、14、21、28、35、42、49、56 d 加入 1:1 000 稀释的免疫血清,37 ℃孵育1 h;PBST洗涤3次,加入1:5 000稀释的HRP标记的羊抗鼠,37 ℃孵育1 h;用PBST洗涤3次,然后加入TMB显色液,5 min后终止显色;测OD450nm,评价免疫效果。
2 结果
2.1 原核表达载体构建
目的基因PCR结果显示,有1条1 600 bp大小的条带(图1-A),与预期的VP5大小一致;双酶切(图1-B)鉴定显示,插入的VP5 基因与预期相符,测序显示基因序列正确,说明重组质粒28a-VP5构建成功。
2.2 重组蛋白初步表达及可溶性分析
将重组质粒28a-VP5转化BL21(DE3)感受态细胞,初步诱导表达后进行SDS-PAGE及Western-blot分析。结果显示,与未诱导的对照菌相比,经IPTG诱导后的菌在约62 kDa处有1条明显的蛋白条带(图2-A、图2-B),与预期结果一致,说明目的蛋白成功表达。诱导表达菌体经超声破碎后,进行SDS-PAGE。结果显示,重组蛋白VP5主要以可溶形式表达(图2-C)。

图1 目的基因扩增(A)和重组质粒的双酶切鉴定(B)
2.3 重组蛋白表达条件优化
表达条件优化结果显示,2×YT培养基中E.coli菌体生长速率明显比LB培养基快(图3-A),IPTG浓度对E.coli菌体生长速率影响不大(图3-B);SDS-PAGE结果显示,IPTG对目的蛋白的表达量影响也不显著。因此,选择最低的0.2 mmol/L为最佳IPTG浓度。随诱导时间的延长,目的蛋白表达量明显增加,6 h后目的蛋白表达量最高(图3-C),而Ca2+、Fe3+、Mg2+、K+对E.coli菌体生长速率及目的蛋白表达量的影响均不显著(图3-D);25 ℃时,目的蛋白可溶性表达量最高(图3-E)。基于上述优化结果,重组蛋白的最佳表达条件为:选择2×YT培养基,在IPTG浓度为0.2 mmol/L时25 ℃诱导表达6 h,目的蛋白表达量最高。
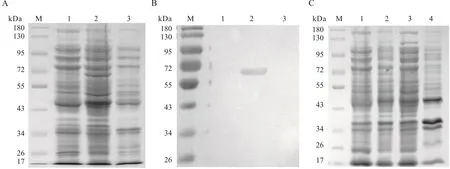
图2 诱导表达的VP5蛋白SDS-PAGE(A)、Western-blot(B)、可溶性分析(C)
2.4 NI柱层析法纯化VP5蛋白
通过优化纯化条件,用20 mmol/L咪唑的平衡液平衡柱子,40 mmol/L咪唑的洗涤液洗脱杂蛋白,250 mmol/L咪唑的洗脱液洗脱目的蛋白。SDS-PAGE及Western Blot结果显示,重组蛋白纯化效果较好(图4),纯度约为75%。经Bradford蛋白浓度测定,试剂盒测纯化后的VP5蛋白质量体积分数为1.42 mg/mL。
2.5 免疫效果初步评价
Dot ELISA结果显示,在高剂量组,5只小鼠血清均能与BTV-1发生特异性反应(图5-A:a—e);低剂量组中,有4只小鼠血清能与BTV-1发生特异性反应(图5-A:f—i),有1只小鼠反应较弱(图5-A:j);而PBS免疫组小鼠血清均不与BTV-1发生反应(图5-A:k)。这说明E.coli重组表达的VP5蛋白免疫血清可以与BTV-1发生特异性反应。用纯化的VP5蛋白包板,ELISA测定血清效价。结果显示,高、低剂量组均能产生针对VP5蛋白的较高效价的特异性抗体,抗体效价在 1:1.024×105~1:2.048×105之间(图5-B),且随着免疫时间的推移,两组抗体滴度均呈现增长趋势,而PBS对照组均无特异性抗体产生(图5-C)。
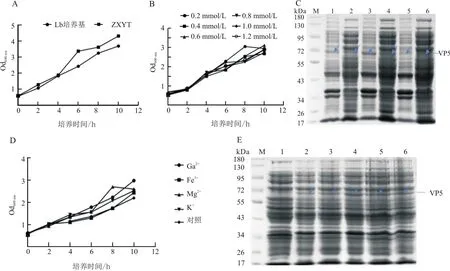
图3 重组蛋白VP5的表达条件优化
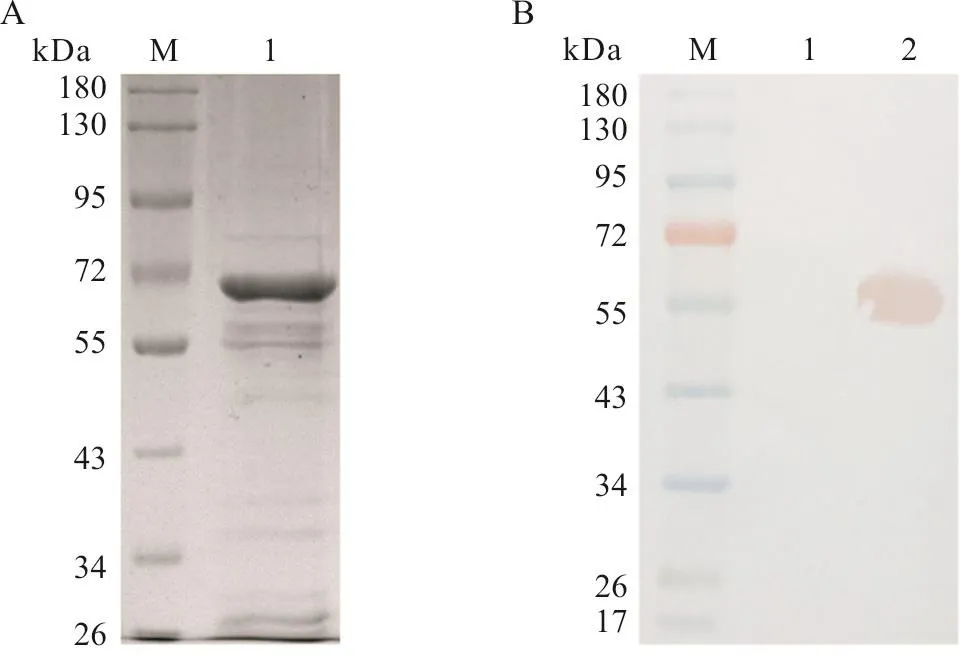
图4 纯化后的VP5蛋白SDS-PAGE(A)及Western Blot鉴定(B)
3 讨论
本研究利用原核表达系统表达BTV-1 VP5蛋白。为了提高表达量,对培养基成分、IPTG浓度、诱导时间、金属离子、诱导温度等诱导表达条件进行优化,获得最佳表达条件为: 2×YT培养基、IPTG浓度为0.2 mmol/L、25 ℃ 诱导6 h。此条件下的蛋白表达量最高,金属离子对表达量影响不大。
BTV外层衣壳由VP2和VP5构成,有研究表明,VP5能增强VP2中和抗体的产生[10]。也有研究表明VP2虽然能诱导机体产生中和抗体,但不能对机体提供完全有效的保护,而VP5的添加能够明显增强VP2的保护作用,这可能是两者协同作用的缘故,也可能是VP5改变了VP2的空间构像[11]。因此,VP5的研究对BTV疫苗的研制具有重要意义。
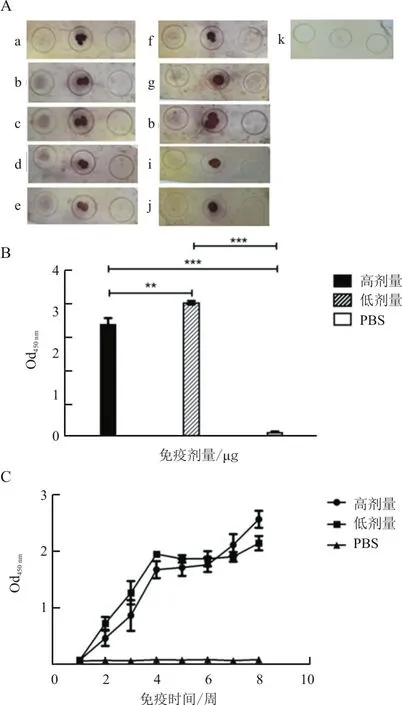
图5 Dot ELISA结果(A)、血清效价(B)和抗体消长规律(C)
有研究用带有MBP标签表达的BTV-12 VP5蛋白,获得了约112.2 kDa的MBP-VP5蛋白,但其抗原性不太好,在5份山羊血清中只有1份为阳性[11]。天然的BTV-1 VP5蛋白大小约为59.2 kDa。而本试验选用His标签融合表达BTV-1 VP5蛋白,获得的重组蛋白His-VP5大小约为62 kDa,与预期一致。通过免疫Balb/c小鼠获得免疫血清,经Dot-ELISA证实,重组BTV-1与重组蛋白His-VP5免疫的阳性血清均能发生特异性反应;ELISA结果显示,高、低剂量组VP5免疫均能产生针对VP5蛋白的高效价特异性抗体,效价范围为1:1.024×105~1:2.048×105,而 PBS 免疫的阴性对照组均无特异性抗体产生,说明本试验获得的重组VP5蛋白具有良好的免疫原性。这可能是由于His-标签分子量小,在pH8.0时不带电,且无免疫原性,对蛋白质的分泌、折叠功能基本无影响。本试验发现其对VP5蛋白自身结构的影响也不大,与之前的研究相一致[12]。
4 结论
本研究经原核表达系统获得了BTV-1 VP5蛋白。该蛋白的免疫血清能够与BTV-1灭活病毒发生特异性反应,表明其具有较好的免疫原性,这为开展BTV-1 VP5蛋白相关研究工作奠定了基础。

