孙氏减孔直肠癌NOSES手术4例报道
苏同荣, 张路遥, 高锋, 孙东辉
近年来,经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)受到外科医生越来越多的关注与应用。中国医师协会结直肠肿瘤专委会NOSES委员会2017年于北京发布了《NOSES结直肠癌专家共识》,为NOSES手术在国内的推广和普及提供了可靠依据[1-2]。直肠癌NOSES手术的腹腔内操作部分和传统腹腔镜手术大致相同,只是直肠癌NOSES手术取标本和消化道重建方式不同,比如,镜下反穿吻合器钉座和剪裁肠系膜部分以及经直肠或阴道取标本。直肠癌NOSES手术大都和传统腹腔镜手术一样采取五孔法,我们做了技术改良,采用在肿瘤上方先切断肠管、裁剪系膜、直肠残端腔内支撑牵引法来帮助暴露视野,如此还可以减少腹部操作孔,将NOSES手术操作的微创性体现的淋漓尽致。我们已采用此方法完成4例直肠癌NOSES手术,现将操作方法报道如下。
1 临床资料
1.1 一般资料
本组4例患者,2018年12月由吉林大学第一医院胃结直肠外科收治,其中男3例,女1例。女性患者56岁,为低位直肠癌,肿瘤距离肛门5 cm;3例男性患者分别为63岁、46岁和71岁,皆为中位直肠癌,肿瘤距离肛门分别为9 cm、8 cm和10 cm。4例患者术前经纤维结肠镜检查以及病理证实均为直肠腺癌,CT检查分期为T2~T3期,无系膜淋巴结及远处转移,评估均适合行NOSES手术。术前签署手术知情同意书。
1.2 手术方法
在传统腹腔镜操作孔基础上,省去左侧助手的两个Trocar,观察孔与右操作孔均正常。
1.2.1 低位直肠癌手术方法 按传统腹腔镜操作游离肠系膜下血管,血管夹夹闭血管,沿外侧壁游离肠管与腹壁粘连部分,提起肿瘤上方10 cm肠管,在系膜侧用超声刀紧贴肠管切开系膜直到完全穿透系膜,然后用镜下切割器于此处把肠管切断,然后从此处开始裁剪系膜,直到肠系膜下动静脉并切断。
以上步骤完成后远侧只剩下直肠残端和被清扫的系膜。然后经肛门伸入支撑杆(可以用勺形钳)直到直肠残端,这样就可以根据术者对暴露术野的需求,将支撑物向各个方向摆动,使得直肠跟随支撑物向各个方向摆动和被牵引达到术野的充分暴露。低位直肠癌要游离直肠到盆底肌平面,然后按两步翻出直肠法把直肠翻出体外[3-4],冲洗标本后经翻转的直肠腔送入绑线钉座进入腹腔,再次冲洗后用弧形闭合器切除肿瘤,直肠腔内再次冲洗,腹腔镜下切开近侧结肠残端,将绑线的钉座放进去,闭合切除,将切下之条状组织经Trocar取出,拉出钉座杆行结-直肠吻合,完成NOSES。
1.2.2 中位直肠癌手术方法 肿瘤以上肠管的切断与游离系膜和低位直肠癌操作方法基本相同,只是游离范围不必如低位直肠癌那么低,游离后,撤出支撑杆,于肿瘤下方超过2 cm用镜下切割器切断直肠,用碘伏水(用生理盐水把1%碘伏消毒液稀释2倍)反复冲洗远侧直肠腔达到干净后切开,将保护套经肛门直肠送到腹腔内,再将吻合器钉座杆绑线后经保护套送进腹腔,切除带有肿瘤的直肠标本,经保护套自直肠取出。腹腔镜下将近侧结肠残端切开,将绑线的吻合器钉座放进肠管,闭合切除的条状组织经Trocar取出,牵拉绑线将钉座杆拉出肠管,用切割闭合器闭合远侧直肠残端,闭合时切除的条状组织经Trocar取出,吻合器经肛门进入直肠残端完成结-直肠吻合(见图1~6)。

图1 紧靠肠管切开系膜

图2 切断肠管
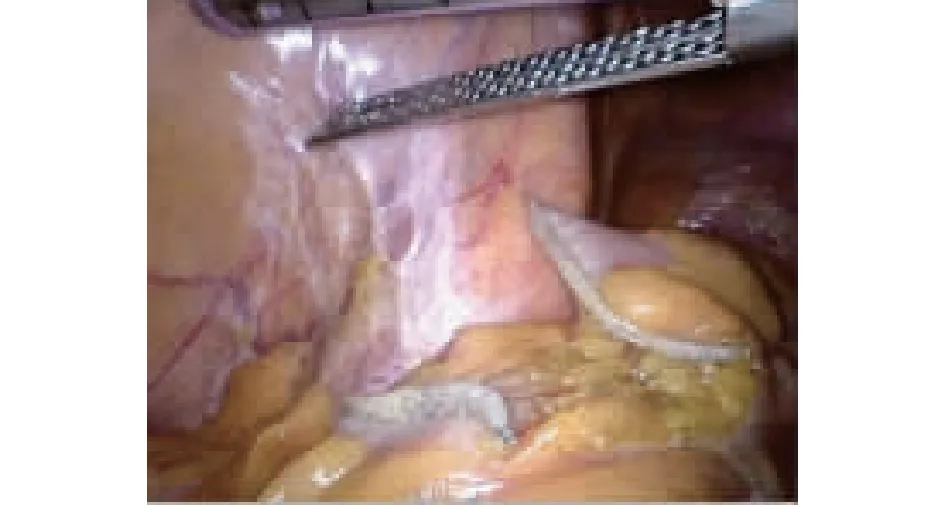
图3 肠管被切断
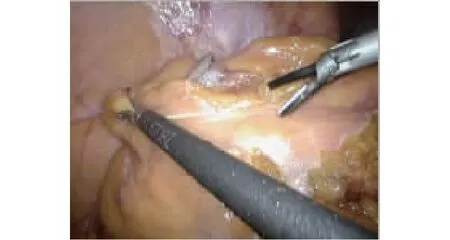
图4 裁剪系膜

图5 切断肠系膜下血管

图6 直肠残端腔内支撑牵引
手术视频扫描二维码观看。

1.3 治疗结果
4例患者均顺利完成手术,平均手术时间(123.0±21.3)min,术中出血量平均(76.2±17.3)ml。术后病理皆为中分化腺癌,T2N0M0 2例,T3N0M0 2例。术后进食排便正常,无围手术期相关并发症发生,均术后5~6天顺利出院。目前随访中。
3 讨论
本手术方法的适应证:第一部分即先切断肠管和裁剪系膜适用于几乎所有直肠癌手术,第二部分即直肠残端腔内支撑牵引法适用于中高位直肠癌、大部分女性低位直肠癌和一些男性偏瘦低位直肠癌,男性肥胖低位直肠癌和肿瘤过大的低位直肠癌不适合。因为这种方法需要有足够的盆腔空间来保证支撑杆自由摆动才能达到显露术野的目的。
根据以往经验,直肠癌NOSES手术的顺利完成多数需要在腹腔内修剪肠系膜[5],按照以往的裁剪系膜方式是从肠系膜下动脉根部开始一直裁剪到肠管后切断肠管[6]。这样操作对于习惯右手持超声刀的医生是很有难度的,因为从肠系膜下动脉根部向肠管方向裁剪系膜时经常需要左手牵拉系膜的钳子和右手持的超声刀或血管夹钳子交叉才能完成裁剪系膜,加大了裁剪系膜难度。而在裁剪系膜前还要按传统腹腔镜方法游离直肠,而传统方法游离直肠时经常存在暴露术野难问题[7-9],也就是在操作过程中由于结直肠没有被分割成两部分,上方的乙状结肠经常会堆积下来遮挡术野,在游离直肠后壁时很困难。尽管左侧有助手用两把钳子负责牵拉挑起等协助,但经常不能达到满意的显露效果,尤其是乙状结肠过长的患者就更困难。我们进行改良,不仅减少戳卡孔,还可以避免以上难题。
我们可以先切断肿瘤以上肠管并修剪系膜,然后再游离残端以下的带有肿瘤的肠管,这样做有多个优点:①把保留的结肠和拟切除直肠分开,就不会有肿瘤上面的肠管堆积下来而影响术者视野。②支撑杆经肛门进入直肠并支撑起直肠残端,随着支撑杆在腹腔内根据需要的摆动,能起到更充分的暴露手术视野的作用,同时还可以减少左侧助手的操作孔。这样做并不影响手术的质量和速度,即减孔不减速。③先切断肠管后再裁剪系膜是从肠管切断处向肠系膜下动静脉根部方向裁剪,这样的做法就会让医生操作起来感觉很方便,因为习惯右手持超声刀的人就不必有双手交叉动作。左手牵拉系膜,右手持刀和血管夹进行裁剪系膜更方便。由于绝大多数外科医生都是右手持刀即主操作手是右手,所以这样操作普遍降低裁剪系膜难度。
可能有人会担心这样做是否符合无瘤原则,我们认为理论上是没问题的。首先,我们先于肿瘤上方将肠管离断并完成裁剪系膜,支撑杆经过肿瘤位置到达直肠残端顶部就到达终点了,支撑杆在直肠腔内顶起直肠残端只要不造成残端穿孔就没有肿瘤细胞脱落进入腹腔和近侧肠管的可能。同时支撑杆头部圆滑,通过肿瘤位置时不会产生严重摩擦,支撑直肠残端时也不容易导致黏膜破损,黏膜屏障不破坏也就没有肿瘤细胞入血的问题,而且由于直肠残端附近系膜已经裁剪与体循环隔绝,就更难有肿瘤细胞进入血液。另外,肿瘤远端肠管一般先闭合冲洗干净后再切开,这也符合无瘤原则。可能还会有人质疑肿瘤以下肠管系膜还没处理,在支撑杆撑起残端肠管时,是否会发生压迫肿瘤而出现肿瘤细胞转移问题?我们认为这个风险并不大,因为下段肠管系膜是要被清扫和切除很大部分,另经肛门向直肠腔内插入1个直径不到1 cm的支撑杆并不会对肠壁产生多大压力,支撑杆的主要作用力点在直肠残端顶部,并不是在肿瘤位置,手术视野的调整主要是依靠支撑杆顶起直肠残端形成张力达到和腹腔内牵拉肠管相同的显露效果,从而左、右、上、下调整肠管位置以暴露手术视野,此过程中支撑杆并不太压迫肠壁和肿瘤,仅仅可能会接触到肿瘤,所以不会对肿瘤形成太大压力。传统腹腔镜操作会在肠管外反复抓持、下压、上挑、左推、右挡肿瘤部位,反而可能会对肿瘤部位形成较大压力。仔细观看传统腹腔镜所做的直肠癌手术,游离盆底直肠时,几乎每个人都会有压迫肿瘤的操作,尤其是在术野暴露不充分时,此类操作就更加频繁。所以,与传统腹腔镜手术相比,通过直肠腔内支撑牵引法来完成的减孔直肠癌NOSES手术可以有效避免此类操作,理论上比传统方式更安全。所以,认为在直肠外刺激肿瘤是安全的而在直肠内刺激肿瘤就不安全的观点我们认为值得商榷,举例说明,患者每天排大便都要增加肠腔内压力,粪便通过肿瘤位置时也要对肿瘤产生压力,大便干燥时甚至引起肛裂,可见排便时粪便对肠壁压力是很大的,但并没有证据证明排便会引起直肠癌的转移,而支撑杆很细,它在松弛宽敞的直肠腔内的几次摆动就会引起肿瘤转移的可能性显然很低。
我们改良的减孔直肠癌NOSES手术和妇科举宫器的作用类似,但我们认为此手术方法比妇科手术优势更大,妇科难以做到用镜下切割闭合器来离断阴道然后再冲洗干净后切开,所以在无瘤原则问题上不如直肠癌NOSES手术彻底。直肠癌NOSES手术是在肿瘤上、下方都离断并闭合标本,形成封闭的状态,并且,远端直肠还是在关闭后冲洗干净再切开的,所以无瘤原则更加严格。另外,直肠残端顶部系膜被裁剪,血运大都被阻断,使得支撑杆支撑残端造成肿瘤细胞入血的可能性大大降低。
综上所述,这种手术方式具有暴露术野好,减孔微创,无瘤安全,易于掌握等优点,具有很好的应用推广前景。

