乳头状肾细胞癌60例临床特点及预后相关因素分析
李世杰, 陈小楠, 吴斌
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)在肾细胞癌类型中占7%~14%[1]。PRCC分为Ⅰ型和Ⅱ型两个亚型,Ⅰ型预后优于Ⅱ型[2-3]。PRCC患者血管造影大多表现为乏血管或无血管,明显不同于最常见的肾透明细胞癌。PRCC病理分期及组织学分级均优于肾透明细胞癌,复发及转移较为少见,肿瘤特异性生存率较高。尽管PRCC预后较好,但已发生远处转移和组织病理级别较高的患者预后较差,且术后大多需要辅助治疗。目前,PRCC仍无标准治疗方案,国内研究不多。为提高对本病的诊治水平,我们分析乳头状肾细胞癌的临床病理特征,探讨其诊疗及预后因素。
1 资料与方法
1.1 临床资料 收集2008年1月至2017年12月中国医科大学附属盛京医院泌尿外科收治的60例PRCC患者临床资料。男41例,女19例。年龄37~80岁。36例(60.0%)为健康体检时发现,8例(13.3%)以肉眼血尿就诊,10例(16.7%)以腰部胀痛不适就诊,6例(10.0%)合并其他疾病于检查时发现。病变位于左肾34例(58.0%),右肾26例(42.0%),所有肿瘤均为单侧病变。60例患者术前均行B超检查,35例为圆形或椭圆形实性肿物,边界清楚,内部呈低回声,CDFI未检出明显血流信号;18例肿物边界不清,内部回声不均匀,部分有液性回声;7例稍高回声,CDFI可检出少许血流信号,肿瘤包膜不完整,内部回声不均匀。50例行腹部或泌尿系增强CT、MRI,平扫象表现为肿物与肾实质密度接近或比肾实质稍低,肿物大多呈圆形,包膜多完整;增强后,肿物无明显增强,或呈弱强化,但为实性,肾皮髓期、实质期和排泄期强化程度明显弱于肾皮质,弱于或相仿于肾髓质(图1)。MRI中呈T2WI混杂低信号改变的实性占位。根据肿瘤大小、位置及肿瘤分期不同选择不同的手术方式。本文行根治性肾切除术44例(73.3%),其中腹腔镜手术22例;行肾部分切除术16例(26.7%),其中腹腔镜手术6例。

图1 PRCC患者CT平扫及增强扫描CT平扫时稍低密度肿块影,突出于肾脏,增强扫描显示肿物不均匀弱强化(箭头)
1.2 统计学方法 采用SPSS 20.0软件进行统计学分析,计数资料以率(%)表示,组间资料比较采用χ2检验或Fisher精确检验,计量资料采用秩和检验。采用Kaplan-Meier法绘制生存曲线,预后影响因素的单因素分析采用Log-rank检验,多因素Cox回归模型对单因素分析中有意义的因素进行分析计算。P<0.05为差异有统计学意义。
2 结果
2.1 组织病理 60例患者病理诊断均为乳头状肾细胞癌,其中Ⅰ型35例,Ⅱ型25例。二者镜下所见形态学结构有明显差异:Ⅰ型PRCC为小而圆细胞核,核仁不明显,胞质淡染,可见乳头或小管状结构,瘤细胞单层排列,更易见到泡沫状巨噬细胞和砂粒体。Ⅱ型PRCC主要由乳头状结构组成,瘤细胞假复层排列,核分级高,胞质嗜酸丰富,泡沫状巨噬细胞和砂粒体罕见。肿瘤最大直径为1.2~12.0 cm,平均5.0 cm。肿瘤TNM分期:pT1~T2期51例(85.0%),pT3~T4期9例(15.0%)。Fuhrman分级:Ⅰ~Ⅱ级49例,Ⅲ~Ⅳ级11例。
2.2 治疗情况及结果 60例患者手术均成功。本组随访时间9~108个月,中位随访时间44个月。60例患者中6例出现淋巴结转移,6例伴有癌栓,5例出现远处转移(其中肺转移3例,骨转移1例,肝转移1例),6例死亡。60例患者1、3、5年生存率分别为98.3%,89.5%、86.7%。
2.3 PRCC预后相关因素分析 如表1所示,Log-rank检验单因素分析结果显示,肿瘤病理分级(P<0.05)、病理分型(P<0.05)、是否有远处转移(P<0.05)与患者生存时间有关,患者性别、年龄、肿瘤直径、有无初发症状、手术方式、TNM分期、有无淋巴结转移及有无合并癌栓等与患者生存时间无关(P>0.05),而Cox多因素回归分析结果显示,肿瘤病理分级是PRCC患者生存时间的独立影响因子(P<0.05),详见图2。
表1 乳头状肾细胞癌预后相关因素分析

影响预后相关因素单因素分析多因素分析HR95%CIP值HR95%CIP值性别(男比女)0.5420.089~3.8600.578年龄(>50岁比≤50岁)0.1680.032~1.1380.069肿瘤直径(>5 cm比≤5 cm)1.1970.148~9.5160.872初发症状(有比无)1.0790.183~6.3790.933手术方式(全切比部分切)1.7530.262~13.2700.533病理分型(Ⅱ型比Ⅰ型)7.3651.170~45.9500.0355.5230.507~60.1650.161Fuhrman分级(Ⅲ/Ⅳ比Ⅰ/Ⅱ)10.8306.309~327.7000.00020.4191.973~211.3340.011肿瘤分期(Ⅲ/Ⅳ比Ⅰ/Ⅱ)0.3140.242~4.0910.397淋巴结转移(有比无)3.0090.141~6.4400.497远处转移(有比无)6.2531.683~63.9900.0211.0450.130~8.4020.967合并癌栓(有比无)2.4900.177~77.9300.398
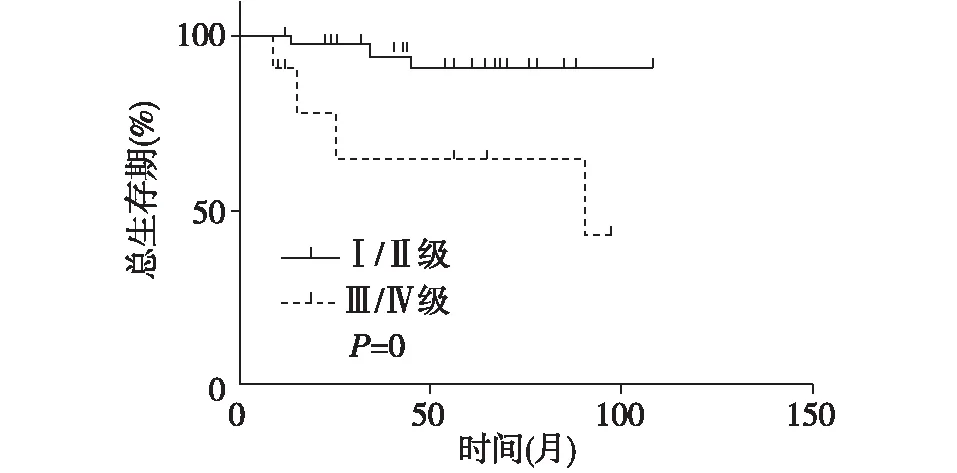
图2 病理分级与PRCC患者总生存期的关系
3 讨论
PRCC临床上较少见,长期以来认为是有着明显不同于其他类型肾细胞癌特点的肾癌亚型[4-5]。PRCC临床预后不同于常见的透明细胞癌。细胞遗传学和分子生物学研究显示其具有独立的遗传学表型[6],预后优于肾透明细胞癌,一些临床及病理特征包括肿瘤分期、分级和病理类型等因素被认为与预后相关[7]。因其发病率、病死率均较低,目前对其临床病理特征及预后相关因素的研究仍待进一步完善。
PRCC与其他类型的肾细胞癌一致,绝大多数是体检时B超或CT检查偶然发现,部分患者可见肾癌典型表现:血尿、腰痛、腹部肿块,但仅为少数,且诊断时大多已为晚期。部分患者出现副瘤综合征,表现为红细胞增多、发热、高血压、贫血、体重减轻等。本研究中患者健康体检时偶然发现肿瘤占60.0%,肉眼血尿占13.3%,腰部酸胀不适占16.7%,10.0%患者因合并其他疾病于检查时发现。国内PRCC患者相比国外患者,年龄趋向年轻化,可能表明该肿瘤的种族差异。
PRCC是一个乏血管肿瘤[8],我们发现,其在增强CT检查中多呈等密度或囊实性,增强扫描皮质期实性部分强化不明显,实质期、分泌期延迟强化。且Ⅱ型PRCC增强后较Ⅰ型CT值高,可能与Ⅱ型肿瘤间质中血管数量相对较丰富有关[9-10],有助于术前鉴别诊断。PRCC影像学特点缺乏特异性,最终只能依据病理学检查确诊。与肾透明细胞癌相比,PRCC生长较缓慢,常有包膜,向周围组织浸润或远处转移者少见,大多数肿瘤TNM分期较低。Delahunt和Eble基于PRCC的细胞病理学特征,将PRCC分为Ⅰ型和Ⅱ型两个亚型,且与Ⅰ型相比,Ⅱ型PRCC患者更年轻,肿瘤体积更大,病理分级中Ⅲ级或Ⅳ级更多[2]。Allory等[11]进行了PRCC形态学分型对预后的系列研究,提示肿瘤分型及临床分期与预后明显相关,Ⅰ型预后明显优于Ⅱ型。本文60例中50例乳头状结构>50.0%,10例乳头状结构>75.0%。Ⅰ型PRCC核分级常为低级别;发现时肿瘤往往位于肾内,且常有完整包膜。Ⅱ型PRCC核分级常为高级别;发现时往往已侵袭肾外组织,亦可累及肾盂,肿瘤常具有部分包膜,可伴出血囊性变及大片坏死[12]。本文11例Ⅲ~Ⅳ级中Ⅱ型PRCC占6例(54.0%),其中多伴有出血及坏死。免疫组化染色结果显示,在PRCC组织CK7、上皮膜抗原、波形蛋白、AMACR等常呈阳性表达。其中CK7和AMACR具有高度特异性及敏感性,CK7表达阳性率达90.0%以上,在非PRCC组织CK7、AMACR表达常为阴性[13]。PRCC在影像学及生物学的特异性可能与其细胞遗传特征性有关,PRCC常起源于肾远曲小管,染色体分析常表现为7、12、16、17、20号染色体三体及Y染色体丢失[14],其中Y染色体丢失可能与男性比女性发病率高有关。研究显示,c-MET、PTEN抑癌基因失活、RET蛋白质过度表达也可能与PRCC发病有关[15]。
PRCC临床分期多为高分化、低分期肿瘤,侵犯肾静脉或下腔静脉、淋巴结转移或远处转移少见[16]。本文60例中,pT1~T2期51例(85.0%),pT3~T4期9例(15.0%),总体分期较早,与文献报道结果基本一致。6例患者(10.0%)出现淋巴结转移,其中肾门淋巴结转移2例,腹主动脉旁淋巴结转移3例,腔静脉旁淋巴结转移1例。5例(8.3%)合并癌栓,其中肾静脉癌栓3例,肾静脉并腔静脉癌栓2例。
腹腔镜下根治性肾切除术已逐渐成为PRCC首选治疗方法,近年来对恶性度较低的局灶性肿瘤特别是肿瘤呈外生性生长者采用保留肾单位手术,既能减轻患者痛苦,又能最大限度保护肾功能,传统开放手术应用逐渐减少。肾癌对放、化疗均不敏感。免疫治疗用于局限性肾癌或局部进展肾癌术后辅助治疗的疗效不肯定,能否用于预防术后肿瘤复发尚无定论,主要以干扰素(INF-a)、白介素2(IL-2)为代表。本文患者14例术后行IFN-a 300万U隔日肌内注射,6例行IL-2 300万U隔日肌内注射辅助治疗,疗程3~6个月,均无复发及转移,提示肾癌术后免疫治疗可能有一定疗效,但也可能与PRCC患者本身恶性程度较低有关。
复发、转移性PRCC一般采用以内科为主的综合治疗,外科手术主要为辅助手段,如患者身体条件允许,或存在孤立的转移瘤,可行手术切除。中、高剂量干扰素可作为治疗转移性PRCC的基本用药。目前靶向治疗药物(索拉菲尼,舒尼替尼等)作为转移性肾癌的一、二线治疗用药,也显著延长了复发转移性PRCC的总生存期,其针对转移性PRCC或晚期非透明细胞癌具有一定的优越性,Choueiri等[17]报道舒尼替尼和索拉非尼治疗转移性PRCC总缓解率为4.8%,无进展生存期为7.6个月。本文1例因肺转移行舒尼替尼靶向治疗,无进展生存期39个月。
PRCC的预后优于肾透明细胞癌。Patard等[18]研究显示,肾透明细胞癌、乳头状肾细胞癌和肾嫌色细胞癌的5年生存率分别为73.2%、79.4%和87.9%。PRCC预后较好可能与其低分期低分级、低度恶性潜能有关。高明珠等[19]分析了国内单中心64例PRCC患者的随访资料,结果显示I型和Ⅱ型PRCC患者的5年生存率分别为88.9%和55.8%。本研究共有6例患者死亡,患者1、3、5年生存率分别为98.3%,89.5%、86.7%,生存率略高于国内外相关研究结果,可能与本研究样本量相对较小且患者肿瘤分期分级较早有关。本研究中,病理分级为Ⅰ~Ⅱ级占81.7%,Ⅲ~Ⅳ级占18.3%,与Herrmann等[20]研究结果相似,显示病理分级是PRCC患者生存时间的独立影响因素,说明病理级别的高低可能与患者预后密切相关。
总之,乳头状肾细胞癌是临床少见且预后较好的肾肿瘤,其临床表现与其他类型肾细胞癌相似,但在影像学表现、病理形态和生物学行为上均与其他类型肾细胞癌存在明显差异。确诊需病理检查及免疫组化。总体预后较好,Ⅰ型PRCC预后优于Ⅱ型PRCC。根治性肾切除术及保留肾单位手术是主要治疗方式。病理分级是影响PRCC患者生存时间的重要因素。

