苦参碱调控肝癌细胞HepG2自噬作用机制研究
郭 浩,周淑妮,冉瑞智
(湖北省恩施土家族苗族自治州中心医院,湖北 恩施 445000)
全球每年有超过60万患者死于肝癌,其中50%发生在中国[1-2]。目前,肝癌的有效治疗方法是手术切除和肝移植,再辅助放射治疗、化学治疗(简称放化疗),但患者5年生存率仅为5%[3]。加之大部分肝癌患者合并肝硬化,限制了化疗药物的使用[4],有必要寻找同时具有抗肿瘤和抗纤维化活性的药物。目前,苦参碱已被广泛应用于肝炎、肝纤维化、癌症等疾病的治疗[5],但对其抗肿瘤作用的确切机制研究还不够深入[6-7]。研究发现,苦参碱可诱导肿瘤细胞发生Ⅱ型程序性死亡,即自噬[8],但机制尚不清楚。有研究证实,磷脂酰肌醇3激酶(PI3K)/蛋白激酶 B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)通路在肿瘤细胞自噬过程中发挥关键作用[9]。本研究中将不同剂量苦参碱作用于肝癌细胞HepG2,确认肝癌细胞HepG2是否发生了自噬,同时初步探讨其分子机制。现报道如下。
1 材料与方法
1.1 材料
试药:苦参碱(西安天园生物制剂公司,批号为16092317,纯度≥99%);DMEM高糖培养基、胎牛血清(武汉普诺赛生命科技有限公司,批号分别为PM150210B,164210-100);胰酶(美国 Gibco公司,批号为 11080907);单丹磺酞戊二胺(MDC,美国 Sigma公司,批号为15596018);Trizol ReagentRNA提取试剂盒(美国Invitrogen公司,批号为15596018);逆转录-聚合酶链反应(RT-PCR)RNA反转录试剂盒(大连TaKaRa公司,批号为RR047A);荧光定量PCR试剂盒(宝生物工程<大连>有限公司,批号为TK08045);细胞蛋白抽提试剂(碧云天生物技术研究所,批号为P0033);鼠抗p-Akt(Ser473)抗体,兔抗 Akt、mTOR、自噬相关蛋白 LC3B 抗体,均购自美国Santa Cruz公司,批号分别为HZ-0670R2,HZ-0670R1,HZ-0670R22,HZ-0673R6;辣根过氧化物酶(HRP)标记抗小鼠IgG、HRP标记抗兔IgG和鼠抗GAPDH抗体均购自武汉艾美捷科技有限公司(批号分别为 115-035-003,C1313)。
仪器:TE2000-U+PXM1200型倒置荧光显微镜(日本Olympus公司);MCO-15AC型CO2细胞培养箱和 NanoDrop2000c型蛋白核酸检测仪(美国Thermo Revco公司);CFX96型 PCR 仪 Mini-PROTEAN Tetra型垂直电泳仪(美国Bio-Rad公司);ChemiDoc TMXRS型凝胶成像仪(美国UVP公司)。
细胞:肝癌细胞HepG2,购自中国科学院典型培养物保藏中心昆明细胞库,批号为CM-1250。
1.2 方法
细胞培养及分组:用含10%胎牛血清的DMEM培养液在37℃及5%CO2条件下培养肝癌细胞HepG2,隔天换液,取处于对数生长期的肝癌细胞HepG2,分为对照组及苦参碱低、中、高剂量组,待细胞贴壁后弃培养液,加入终质量浓度依次为0,0.5,1.0,2.0 g/L的苦参碱,继续培养48 h后收获细胞。
MDC染色观察自噬体:取培养细胞加入MDC(终浓度为50 μmol/L),室温避光染色10 min后,用磷酸盐缓冲液(PBS)清洗3次,再加入无MDC的DMEM培养基,在380 nm波长处观察细胞染色情况。自噬细胞质呈绿色荧光亮点。
RT-PCR法检测 Akt、mTOR和 LC3B mRNA表达:取培养细胞,5 000 r/min离心5 min,以Trizol法提取总RNA,逆转录合成cDNA,以GAPDH引物为内参。Akt上游 5′-AGACATACATCTTTGCTGGAGACA-3′,下 游 5′-CTTGAAGAAGTAGCTGTGACCG-3′;mTOR上游 5′-AGAAGGGTCCCAGCTA-3′,下游 5′-TATTC GGGGTGATCGG-3′;LC3B 上 游 5′-ACTGGATTTGC GGCATGTGA-3′,下游 5′-CCATGTTGAAGTAGGAGC GAGTGA-3′;GAPDH 上游 5′-TCCCATCACCATCTTC CAG-3,下游 5-GGTATCCATCGCCATGCTC-3′;PCR条件95℃预变性1 min;95℃变性15 s,58℃退火20 s,72℃延伸20 s,循环40次,72℃延伸5 min终止反应。读取循环阈值(Ct值),采用2-△△Ct表示目的基因mRNA的 表 达 量。以 Akt/GAPDH,mTOR/GAPDH,LC3B/GAPDH比值分别代表各自的相对表达水平,各组设3个复孔,重复3次。
Western Blot法检测 Akt、p-Akt、mTOR 和 LC3B蛋白水平:取培养细胞,5 000 r/min离心5 min,洗涤2 次,加入 1 μL PMSF,加入蛋白抽提试液,冰浴 2 h;4 ℃下10 000 r/min离心15 min,取上清液,检测蛋白含量;调整蛋白浓度,加入1/5体积的5×Buffer,沸水变性,进行电泳、转膜;加入一抗,4℃下孵育过夜,回收一抗,清洗加入二抗,加入发光试剂,显影、定影、清洗,将目的条带灰度值数字化,目的条带与内参条带灰度值之比为各目的蛋白相对表达水平,各组设3个平行样,重复3次。
1.3 统计学处理
采用SPSS 19.0统计学软件分析。计量资料以均数±标准差()表示,行单因素方差分析;组间两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 对细胞自噬行为的影响
结果见图1。与对照组比较,苦参碱高、中、低剂量组肝癌细胞HepG2荧光强度明显增强,且与剂量呈正相关,说明苦参碱诱导肝癌细胞HepG2发生了自噬。
2.2 对细胞AKT和 p-Akt蛋白表达的影响
结果见表1。与对照组比较,苦参碱高、中、低剂量组肝癌细胞HepG2 Akt mRNA和蛋白表达水平无明显差异(P>0.05),肝癌细胞HepG2p-Akt蛋白表达水平明显降低(P<0.05),且与剂量呈正相关。
2.3 对细胞mTOR mRNA和蛋白表达的影响
结果见表2。与对照组比较,苦参碱高、中、低剂量组肝癌细胞HepG2 mTOR mRNA和蛋白表达水平明显降低(P<0.05),且与剂量呈正相关。
2.4 对肝癌细胞HepG2 LC3B表达的影响
结果见表3。与对照组比较,苦参碱高、中、低剂量组肝癌细胞HepG2 LC3B mRNA和蛋白表达水平明显升高(P<0.05),且与剂量呈正相关。
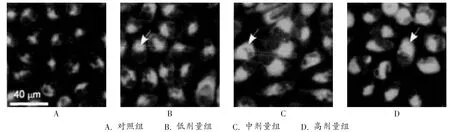
图1 苦参碱诱导肝癌细胞HepG2自噬行为(×320,箭头标记处为自噬体)
表1 各组肝癌细胞HepG2 Akt和 p-Akt蛋白表达水平比较(±s,n=3)
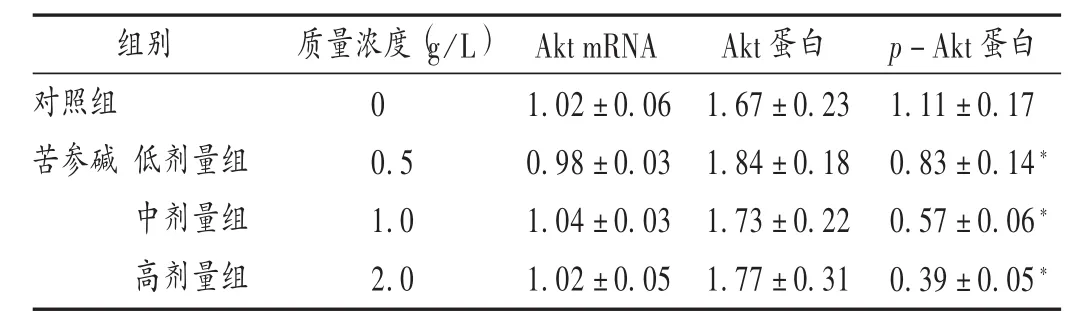
表1 各组肝癌细胞HepG2 Akt和 p-Akt蛋白表达水平比较(±s,n=3)
注:与对照组比较,*P<0.05。表2、表3同。
组别对照组苦参碱 低剂量组中剂量组高剂量组质量浓度(g/L)0 0.5 1.0 2.0 Akt mRNA 1.02±0.06 0.98±0.03 1.04±0.03 1.02±0.05 Akt蛋白1.67±0.23 1.84±0.18 1.73±0.22 1.77±0.31 p-Akt蛋白1.11±0.17 0.83±0.14*0.57±0.06*0.39±0.05*
表2 各组肝癌细胞HepG2 mTOR mRNA和蛋白表达水平比较(±s,n=3)
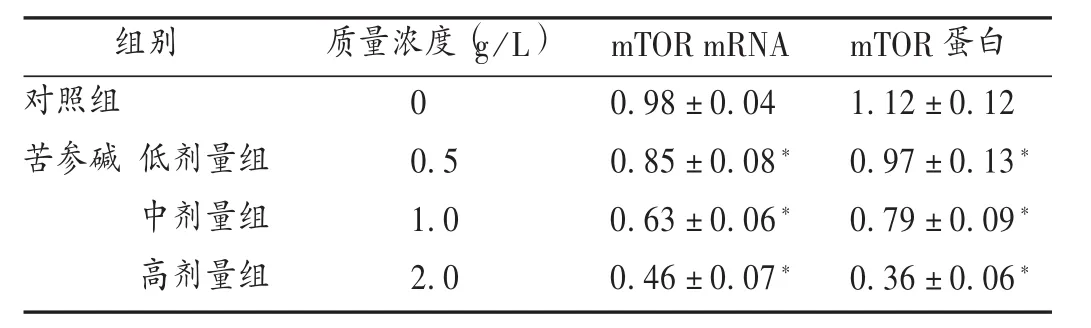
表2 各组肝癌细胞HepG2 mTOR mRNA和蛋白表达水平比较(±s,n=3)
组别对照组苦参碱 低剂量组中剂量组高剂量组质量浓度(g/L)0 0.5 1.0 2.0 mTOR mRNA 0.98±0.04 0.85±0.08*0.63±0.06*0.46±0.07*mTOR蛋白1.12±0.12 0.97±0.13*0.79±0.09*0.36±0.06*
表3 各组肝癌细胞HepG2 LC3B mRNA和蛋白表达水平比较(±s,n=3)
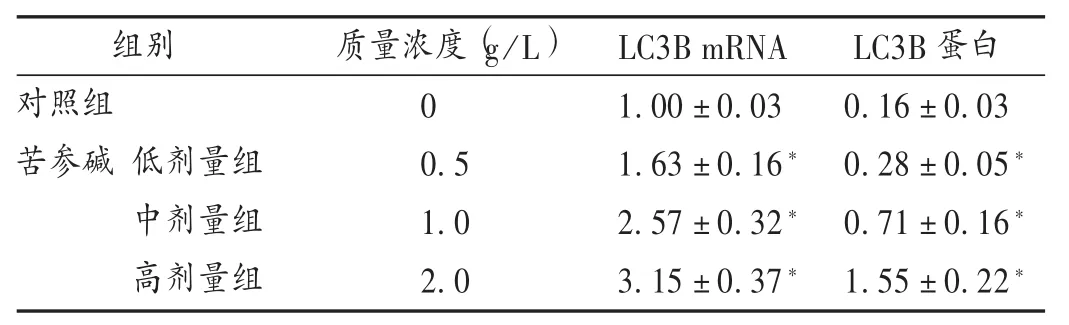
表3 各组肝癌细胞HepG2 LC3B mRNA和蛋白表达水平比较(±s,n=3)
组别对照组苦参碱 低剂量组中剂量组高剂量组质量浓度(g/L)0 0.5 1.0 2.0 LC3B mRNA 1.00±0.03 1.63±0.16*2.57±0.32*3.15±0.37*LC3B蛋白0.16±0.03 0.28±0.05*0.71±0.16*1.55±0.22*
3 讨论
苦参碱是一种从豆科槐属植物中提取的生物碱,主要从苦参、苦豆子中提取,在肝炎、肝纤维化、肿瘤治疗等方面有重要价值[10]。目前,我国已批准了多种含有苦参碱成分的药物,临床药理试验结果显示,对中晚期肝癌患者给予苦参碱注射液能显著提高抗肿瘤效果,延长生存时间和改善生活质量[11]。体外研究显示,苦参碱能抑制肿瘤细胞增殖和转移,促进肿瘤细胞凋亡[12]。同时,研究苦参碱诱导肿瘤细胞凋亡过程时,发现苦参碱还可诱导大鼠神经胶质瘤细胞产生大量的自噬体,出现自噬现象[13]。
自噬现象广泛存在于真核细胞的生物学过程中,是细胞在应激状态下的自我消化过程,作为一种细胞程序性死亡,对体内细胞合成和降解稳态的维持具有重要意义[14]。自噬是一把“双刃剑”,抑制自噬可促进肿瘤细胞持续增殖,同时,当无法提供肿瘤生长所需的足够营养时,自噬体通过降解肿瘤细胞的蛋白或细胞器来提供能量,维持机体或细胞的生存[15]。自噬泡的形成是自噬的关键步骤,通常通过形态学和特殊标志分子检测细胞的自噬情况,形态学检测通常用MDC染色进行,细胞中LC3B含量与自噬泡的数量呈正相关[16]。本研究结果显示,苦参碱处理后肝癌细胞HepG2荧光强度明显增强,且与剂量呈正相关,说明苦参碱诱导肝癌细胞HepG2发生了自噬;同时,LC3B mRNA和蛋白表达水平随苦参碱剂量增加而升高,也验证了肝癌细胞HepG2发生了自噬。
近年有研究发现,很多抗肿瘤药物可诱导肿瘤细胞自噬,甚至直接导致肿瘤细胞自噬性死亡,故认为自噬现象是治疗肿瘤的一种新途径[17]。目前对自噬现象分子机制的研究还处于框架阶段,PI3K/Akt/mTOR通路被认为是细胞自噬的主要调控途径[18]。PI3K可磷酸化磷脂酰肌醇4-磷酸和磷脂酰肌醇4,5-二磷酸,产物可激活Akt,Akt是PI3K/Akt/mTOR通路下游主要的效应分子,当其磷酸化被抑制时促进细胞自噬的发生[19]。mTOR是细胞自噬的负调控因子,抑制自噬的发生,发挥“门卫”作用。研究证明,通过抑制mTOR可促进HeLa细胞、肝癌细胞HepG2等自噬[20]。本研究结果显示,苦参碱处理后肝癌细胞HepG2内Akt mRNA和蛋白表达变化不明显,但Akt的磷酸化被明显抑制,同时,mTOR也受到抑制,与之前的研究结果相一致。
综上所述,苦参碱可促进肝癌细胞HepG2的自噬作用,其机制与抑制PI3K/Akt/mTOR通路相关。

