脂联素对高糖条件下RF/6A细胞的保护作用
李 蓉,杜军辉,姚国敏,王小娣,姚 杨
(1西安医学院第一附属医院眼科,西安 710077;2西安交通大学附属西安市第九医院眼科;3西安医学院第一附属医院中心实验室;*通讯作者,E-mail:rechelrong198222@163.com)
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的严重并发症之一[1],高血糖导致视网膜微血管慢性损伤,最终出现增生性DR(proliferative DR,PDR)严重危害患者视力健康[2],影响其生存质量,并带来巨大的社会负担。抗新生血管药物的出现为PDR带来了治疗前景[3],但并非对所有患者均治疗有效,故研究DR的发病机制,探索新生血管治疗的新策略尤为重要。
研究表明,脂肪细胞分泌的生物活性物质脂联素(adiponectin,APN)与糖尿病等多种代谢性疾病的发生有关,APN在这些疾病中可能发挥有益作用[4-6]。在APN与病理性视网膜新生血管方面的研究提示,APN对缺血缺氧导致的视网膜血管损伤起着保护作用[7,8],但APN在各种代谢性疾病中发挥保护作用的分子机制还不完全清楚。据报道,高糖可以诱导人脐静脉内皮细胞损伤,促进细胞凋亡[9]。本研究旨在观察APN是否能促进高糖条件下的RF/6A细胞增殖,抑制细胞凋亡,从而对RF/6A细胞起到保护作用。
1 材料和方法
1.1 主要试剂与仪器
RF/6A细胞(武汉普诺赛生命科技有限公司),1640培养基、0.25%胰酶(美国Gibco公司),胎牛血清(美国Invitrogen公司),青霉素、链霉素(美国Hyclong公司);APN(金斯瑞生生物科技有限公司),CCK-8细胞增殖及细胞毒性检测试剂盒(碧云天生物技术有限公司),细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)。兔单抗Bax(美国Cell signaling公司),兔单抗Bcl2(美国Cell signaling公司),兔多抗GAPDH(杭州贤至生物有限公司),HRP标记羊抗兔二抗(武汉博士德生物工程有限公司),BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司)。MCO-15AC型CO2恒温培养箱(日本SANYO),Multiskan MK3型全自动酶标仪(美国Thermo scientific),CytoFLEX型流式细胞仪(美国BECKMAN)。
1.2 细胞传代培养
将RF/6A细胞置于含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的1640培养基中,在37 ℃、5% CO2及饱和湿度条件下常规培养。当细胞的密度达到80%时,用0.25%胰酶消化细胞,终止消化后收集细胞,PBS清洗细胞2次,1 200 r/min,离心3 min,加入培养基,制成单细胞悬液,按1 ∶3的比例传代,37 ℃、5% CO2及饱和湿度条件下扩大培养。
1.3 细胞处理及分组
将处于对数生长期的RF/6A细胞消化,用相应培养基制备单细胞悬液,按照每孔5×105个细胞接种于6孔板,按照如下分组进行加药处理:空白对照组(PBS),甘露醇对照组(25 mmol/L甘露醇),高糖组(25 mmol/L D-葡萄糖),高糖+APN组(25 mmol/L D-葡萄糖+10 μg/ml APN),在37 ℃、5%CO2及饱和湿度条件下培养48 h。
1.4 CCK-8法检测RF/6A细胞增殖
消化处于对数生长期的细胞,用培养基制成5×104个细胞/ml的单细胞悬液,将细胞接种于96孔板(每孔100 μl),同时设置空白对照孔,周围孔加入100 μl PBS,在37 ℃、5% CO2及饱和湿度条件过夜培养。按照上述分组加药处理48 h,向每孔加入10 μl CCK-8溶液,37 ℃培养4 h,振荡10 min,用全自动酶标仪测定各孔在450 nm处的吸光值(OD)。计算细胞增殖率(%)=(各组平均OD值-空白孔平均OD值)/(对照组平均OD值-空白孔平均OD值)×100%。
1.5 流式检测RF/6A细胞凋亡
用不含EDTA的0.25%胰酶消化细胞,终止消化后收集细胞;PBS清洗2次,1 500 r/min,5 min;按照Annexin Ⅴ-APC-7-AAD细胞凋亡检测试剂盒说明操作:加入500 μl Binding Buffer,重悬细胞;5 μl AnnexinⅤ-APC混匀后加入5 μl 7-AAD,混匀;室温避光反应15 min(同时设阴性对照,即正常细胞不加Annexin Ⅴ-APC-7-AAD);流式细胞仪检测。
1.6 Western blot检测RF/6A细胞凋亡蛋白Bax、Bcl-2的表达
细胞处理完成之后,收集各组细胞,用预冷PBS洗涤3次,加入含有蛋白酶抑制剂的RIPA裂解液100 μl,混匀,4 ℃、12 000 r/min离心5 min,取上清,BCA法测定蛋白浓度,取40 μg等量蛋白上样。SDS-PAGE凝胶电泳,转膜,用含5%脱脂奶粉的TBST(封闭液)室温浸泡PVDF膜2 h。用封闭液稀释相应的一抗(1 ∶1 000),使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜。TBST洗涤5次,每次5 min,加入辣根过氧化酶标记的二抗(1 ∶50 000),室温孵育2 h,洗膜后ECL显色,冲洗晾干后扫描胶片,BandScan凝胶成像系统分析胶片灰度值。以GAPDH为内参,以目的蛋白/GAPDH条带灰度值作为其相对表达量。
1.7 统计学分析
2 结果
2.1 APN对高糖条件下RF/6A细胞增殖的影响
CCK-8检测结果显示,空白对照组、甘露醇对照组、高糖组、高糖+APN组的RF/6A细胞增殖率分别为100%±0%,99.09%±0.46%,71.42%±2.29%,90.87%±1.68%。各组总体比较差异具有统计学意义(F=254.16,P<0.001)。空白对照组与甘露醇对照组之间的差异无统计学意义(P>0.05)。高糖组和高糖+APN组细胞增殖率比空白对照组和甘露醇对照组降低(均P<0.001)。与高糖组相比,高糖+APN组细胞增殖率明显升高(P<0.001,见图1)。
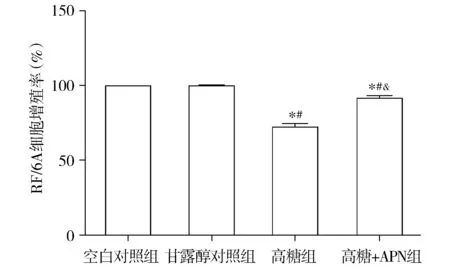
与空白对照组比较,*P<0.001;与甘露醇对照组比较,#P<0.001;与高糖组比较,&P<0.001图1 各组RF/6A细胞增殖率的比较Figure 1 Comparison of the proliferation rate of RF/6A cells among four groups
2.2 APN对高糖条件下RF/6A细胞表达凋亡相关蛋白的影响
Western blot检测结果显示,与空白对照组和甘露醇对照组比较,高糖组细胞的凋亡增强,分别表现为两种凋亡标志蛋白Bax(促进凋亡)表达条带的明显增强和Bcl-2(抑制凋亡)的明显减弱。当采用APN处理细胞后,Bax的表达则明显降低,而Bcl-2的表达明显升高(见图2)。空白对照组、甘露醇对照组、高糖组和高糖+APN组细胞中,Bax的相对表达量分别为0.28±0.02,0.29±0.02,0.64±0.01和0.54±0.03;Bcl-2的相对表达量分别为0.64±0.01,0.66±0.01,0.28±0.01和0.39±0.01。Bax和Bcl-2的相对表达组间总体比较差异均有统计学意义(F=257.13,P<0.001;F=1087.54,P<0.001)。组间比较显示,空白对照组与甘露醇对照组之间的差异无统计学意义(P>0.05)。高糖组和高糖+APN组细胞Bax的表达比空白对照组和甘露醇对照组增多,Bcl-2的表达较这两组减少(均P<0.001)。与高糖组相比,高糖+APN组细胞Bax的表达明显降低,Bcl-2的表达明显升高(均P<0.001,见图3)。
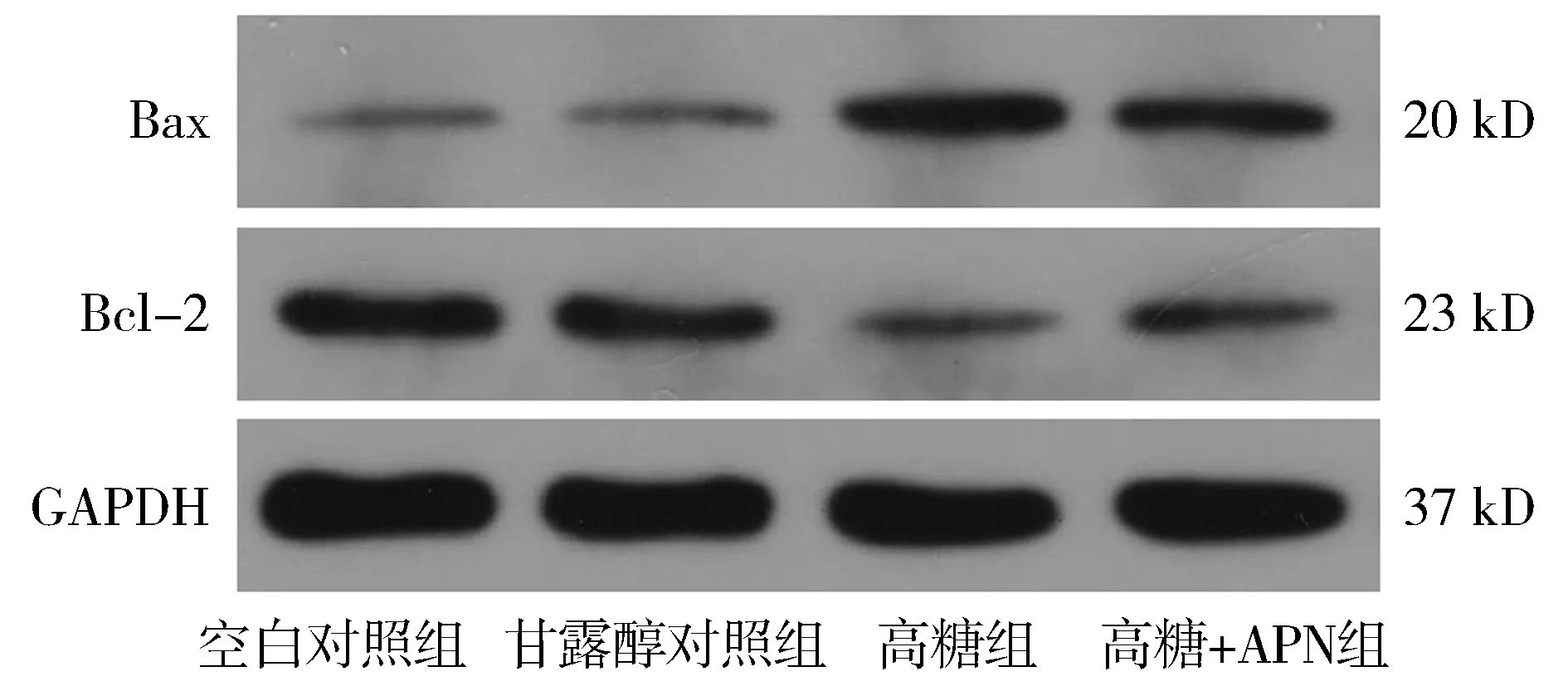
图2 Western blot检测各组RF/6A细胞Bax和 Bcl-2的蛋白表达Figure 2 Expression of Bax and Bcl-2 in different groups by Western blot
2.3 APN对高糖条件下RF/6A细胞凋亡率的影响
流式细胞仪检测结果显示,与空白对照组和甘露醇对照组比较,高糖组细胞的凋亡率增加,高糖+APN组细胞凋亡率则明显下降(见图4)。空白对照组、甘露醇对照组、高糖组和高糖+APN组细胞的凋亡率分别为5.17±0.27,5.55±0.35,18.37±0.44和10.46±0.70。组间总体比较差异有统计学意义(F=518.86,P<0.001)。组间比较提示,空白对照组与甘露醇对照组之间的差异无统计学意义(P>0.05)。高糖组和高糖+APN组细胞凋亡率比空白对照组和甘露醇对照组增多(P<0.001)。与高糖组相比,高糖+APN组细胞凋亡率明显减少(P<0.001,见图5)。
3 讨论
DR是全球工作年龄人群致盲的首要原因,其临床特征主要是毛细血管通透性增加、视网膜水肿以及内皮细胞增生[10]。糖尿病导致DR发生的机制十分复杂,虽经过多年的体内外研究,但目前对DR的发生和发展机制尚未完全明确。既往关于糖尿病并发症的机制研究主要集中在多元醇通路、非酶糖基化学说、氧化应激和蛋白激酶C的活化这五个经典途径,视网膜细胞的凋亡是各种机制的共同通路[11]。细胞凋亡是生物体为维持内环境稳定,细胞在一定的生理或病理条件下,由基因控制的高度有序的细胞程序性死亡,是生物体为了更好地适应生存环境而主动结束其生命的过程,涉及一系列基因的激活、表达以及调控过程[12]。本研究结果提示,高糖刺激可以明显减少RF/6A细胞增殖,导致其细胞活力下降,与文献报道的结果一致[13]。进一步流式和免疫印迹法分析结果提示,凋亡增加是高糖导致细胞增殖活力下降的原因之一,与采用其他方法检测凋亡所取得的结果类似[13]。

与空白对照组比较,*P<0.001;与甘露醇对照组比较,#P<0.001;与高糖组比较,&P<0.001图3 各组RF/6A细胞Bax和Bcl-2的相对蛋白表达量Figure 3 The relative expression of Bax and Bcl-2 by RF/6A cells in different groups
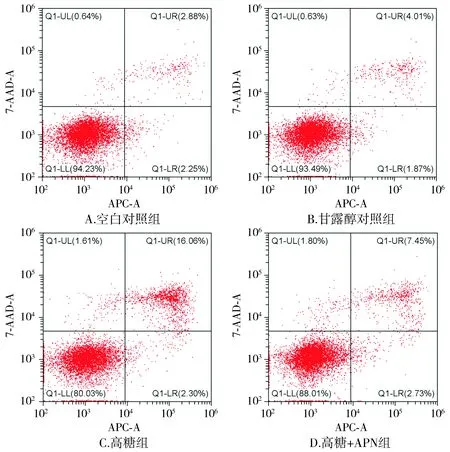
图4 流式细胞仪检测各组RF/6A细胞凋亡率Figure 4 Cellular apoptosis rate in different groups by flow cytometry
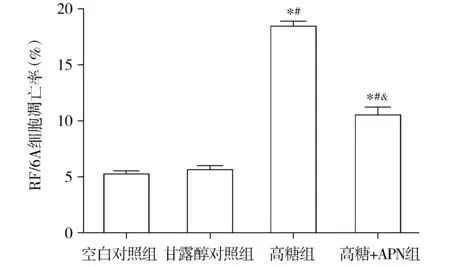
与空白对照组比较,*P<0.001;与甘露醇对照组比较,#P<0.001;与高糖组比较,&P<0.001图5 各组RF/6A细胞凋亡率的比较Figure 5 The apoptosis rate of RF/6A cells in different groups
视网膜细胞凋亡已被视为导致视网膜神经退行性改变、血管功能异常、DR、青光眼等不可逆致盲眼病的中心事件[14]。在DR大鼠模型中发现,在糖尿病发生早期就可见到血管细胞和视网膜神经节细胞凋亡发生,血管周细胞的凋亡导致血视网膜屏障破坏,视网膜神经节细胞的凋亡导致视功能的损伤[14]。糖尿病诱导视网膜细胞凋亡的机制虽然仍不十分明确,但与这些细胞凋亡密切相关的基因主要包括bcl-2家族。Bcl-2是研究最早且与凋亡有关的原癌基因,是人类滤泡型淋巴瘤的细胞遗传标志物,其表达蛋白可以抑制凋亡。Bcl-2蛋白广泛存在于造血细胞、上皮细胞、淋巴细胞、神经细胞及多种瘤细胞。目前认为该家族可细分成两大类:抗凋亡基因,如Bcl-2、Bcl-XL、Bcl-W等和促凋亡基因,如Bax、Bik、Bak等[15]。本研究提示,RF/6A细胞表达Bcl-2和Bax这两种凋亡关键蛋白,高糖作用后促凋亡蛋白Bax表达明显升高,抑制凋亡蛋白Bcl-2表达明显下降,与在周细胞中观察到的结果相似。研究者也将视网膜毛细血管周细胞置于高浓度的葡萄糖溶液中体外培养,观察到毛细血管周细胞的大量凋亡,并且细胞中Bax基因表达增强与Bcl-2基因表达减少,认为二者的表达变化对周细胞的凋亡起到了调控作用[16]。进一步研究提示,上述改变主要与高糖所致的氧化应激损伤引起线粒体功能紊乱,启动细胞内凋亡信号转导途径有关。Bcl-2家族在此过程中起主要的调节作用,在高血糖状态下,Bcl-2的含量降低、Bax含量增加,线粒体膜通透性增高,激活caspase-9及caspase-3等重要作用的蛋白酶,从而促进后续的细胞凋亡信号[17]。
APN是一种主要由脂肪细胞特异性分泌的生物活性物质,编码人脂联素的基因位于染色体3q27,该位点与糖尿病和心血管疾病的易患性相关。近年研究发现,APN是联系脂肪细胞、心肌细胞和血管细胞的重要媒介,且与肿瘤的侵袭和转移有关[18]。APN的功能尚未完全证实,能够通过多种复杂信号通路调节机体糖、脂代谢,与多种代谢性疾病的发生和发展有关。人类APN的血清水平与脂肪量呈反比,是唯一与脂肪组织呈负相关、对人体起保护作用的脂肪因子,具有抗炎、抗动脉粥样硬化、增加胰岛素敏感性和抑制血管生成的作用[19,20]。临床研究发现,较低浓度的血清总APN和高分子量APN水平可能参与非增殖性DR的发生,总APN水平可能与DR的严重程度有关[21]。血清APN水平是DR病变的独立危险因素,参与了DR的发生和发展,可作为预测评估糖尿病患者视网膜病变损伤程度的指标[22]。在视网膜血管病变的动物模型中发现,APN是视网膜病理性微血管形成的负向调控者,对视网膜血管损伤起着保护作用[7,8]。本研究结果表明,APN可以促进高糖条件下的RF/6A细胞的存活及增殖,抑制细胞凋亡,提示APN对高糖所致的RF/6A细胞损伤起一定的保护作用。

