miR-195靶向RAF1调控口腔鳞状细胞癌的生长、凋亡及迁移侵袭
郭 芳,黄 硕,刘 宁,朱 勇,刘昌奎
(西安医学院口腔医学院口腔颌面外科学教研室,西安 710021;*通讯作者,E-mail:guofang@xiyi.edu.cn)
2003年世界口腔健康统计数据显示,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)占口腔恶性肿瘤的90%以上,OSCC的发病率在26种主要恶性癌症中位居第8位[1],以手术为主的综合治疗为目前的一般治疗原则,但术后易导致语言、进食、吞咽等各种口腔功能障碍及颜面部畸形均严重威胁着人类的生活质量和健康[2]。基因治疗对于癌细胞具有潜在的靶向性,miRNA是一种长度为21-25个核苷酸的小型非编码RNA,能够识别特定的目标mRNA的3′端UTR的一个或多个位点,并与之结合,实现对目标基因表达的调控[3]。研究发现miRNA与癌症的发生和发展是密切相关的[3]。
miR-195在多种实体肿瘤组织中被发现处于低表达状态,如结肠癌[4]、胃癌[5]、肝癌[6]等。但是,miR-195在口腔鳞状细胞癌中的表达及其相关作用机制如何呢?本研究采用生物信息学方法预测miR-195的靶基因,构建pcDNATM6.2-GW-pre-miR-195重组表达质粒,通过双荧光素酶报告基因预测miR-195对下游靶基因RAF1表达的影响,以及对口腔鳞状细胞癌生物学功能的调控。
1 材料与方法
1.1 细胞株、主要试剂
口腔鳞状细胞癌SCC-4细胞株、pcDNATM6.2-GW、E.coli DH5α、pmirGLO真核载体均由西安交通大学医学部实验中心提供。限制性内切酶(Hind Ⅲ、EcoR Ⅰ、SacⅠ和XhoⅠ)、T4DNA连接酶、SYBR Premix Ex TaqTMⅡ和逆转录试剂盒(PrimeScriptTMRT reagent Kit)均购自Takara公司(大连),质粒抽提、凝胶回收试剂盒购自Qiagen公司,转染试剂Lipofectamine2000、RNA抽提试剂Trizol购自美国Vitrogen公司,RIPA、SDS-PAGE凝胶配制试剂盒购自碧云天生物技术公司,PVDF膜、蛋白发光液购自Millipore公司,鼠抗人β-actin购自Santa Cruz公司,RAF1购自Abcam公司,双荧光素酶报告基因检测试剂盒购自Promega公司。
1.2 miR-195过表达载体的构建与si-RAF1的设计合成
从miRBase网站数据库中检索has-miR-195的pre-miR-195颈环序列,设计并合成两端带有HindⅢ和EcoRⅠ酶切位点的互补双链DNA,序列由生工生物工程(上海)股份有限公司合成,正义链为5′-AATTCAGCTTCCCTGGCTCTAGCAGCACAGAAATAT TGGCACAGGGAAGCGAGTCTGCCAATATTGGCTGTG CTGCTCCAGGCAGGGTGGTGA-3′,反义链为5′-AGCTTCACCACCCTGCCTGGAGCAGCACAGCCAATA TTGGCAGACTCGCTTCCCTGTGCCAATATTTCTGTGC TGCTAGAGCCAGGGAAGCTG-3′。将其退火为双链DNA序列,采用T4 DNA连接酶将其与pcDNATM6.2大片段相连构建为pre-miR-915过表达载体。si-RAF1两条链分别为:5′-CUCACAGAUCCUUCUAAGATT-3′,5′-UCUUAGAAGGAUCUGUGAGTT-3′,由生工生物工程(上海)股份有限公司合成。
1.3 实时荧光定量PCR(qRT-PCR)检测miR-195、RAF1的表达量
验证miR-195、si-RAF1在细胞株中的表达,将构建成功的重组质粒pcDNATM6.2-GW-pre-miR-195及si-RAF1转染SCC-4细胞,然后qRT-PCR检查成熟miR-195的表达水平及RAF1被沉默后的表达水平。RAF1的上游引物为:5′-GGGAGCTTGGAAGACGATCAG-3′,下游引物为:5′-ACACGGATAGTGTTGCTTGTC-3′;miR-195的逆转录引物序列为5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATA CGACGCCAATA-3′,上游引物为:5′-ATCCAGTGCGTGTCGTG-3′,下游引物为:5′-TGCTTAGCAGCACAGAAA-3′,U6和β-actin分别作为miR-195和RAF1的内参。条件:95℃ 1 min预变性,95 ℃变性10 s,60 ℃退火,延伸40 s,重复40个循环,采用2-ΔΔCt计算miR-195、RAF1的表达量。
1.4 MTT检测SCC-4细胞增殖活性
96孔板每孔约3 000个细胞,采用Lipofectamine2000脂质体转染试剂按说明书进行转染。各组设3个复孔,分别于转染后24,48,72 h加入20 μl MTT,37 ℃孵育4 h弃上清,加入150 μl DMSO,于492 nm波长下检测SCC-4细胞的吸光值。
1.5 克隆形成实验检测SCC-4细胞形成能力
根据不同分组对SCC-4细胞进行转染,24 h时分别按照500个/孔、1 000个/孔、2 000个/孔加入6孔板中。置于5% CO2,37 ℃培养。每隔2 d更换培养基。10-14 d观察克隆形成的大小,弃去培养基,用PBS轻轻冲洗3次、风干。每孔加入0.1%的结晶紫500 μl,37 ℃,染色30 min,再用PBS冲洗干净。用凝胶成像仪拍照。
1.6 流式细胞仪检测SCC-4细胞凋亡
按2×105个/孔将细胞种于12孔板中。24 h观察细胞状态生长良好,融合度达到80%以上,更新培养液1 ml,转染si-RAF1和si-control至SCC-4细胞。待细胞培养48 h,胰酶消化细胞收集于15 ml离心管中,1 000 r/mim离心5 min。吸取弃上清,PBS冲洗细胞3次。弃上清,加400 μl的1×binding buffer,重悬细胞,再加5 μl Annexin Ⅴ-FITC,于4 ℃避光染色15 min。加入10 μl PI染液,避光4 ℃染色5 min,采用流式细胞仪检测。
1.7 流式细胞仪检测SCC-4细胞周期
根据不同分组对SCC-4细胞进行转染,将收集的SCC-4细胞,加入含70%乙醇的PBS(4 ℃预冷2 h以上)重悬细胞,4 ℃过夜固定。1 000 r/min离心5 min,弃上清液。用PBS冲洗细胞2次,离心弃上清PBS,避光加150 μl RNA酶和150 μl PI,轻柔混合,室温避光静置30 min,采用流式细胞仪检测。
1.8 双荧光素酶报告基因检测miR-195对RAF1的靶向作用
采用targetscan(http://www.targetscan.org/)根据碱基互补配对原则选取miR-195的候选靶基因RAF1,分别于TGTTTTCAGAGAAGCTGCTGCTA及其互补链两侧添加SacⅠ和XhoⅠ双酶切位点,命名为野生型RAF1(WT-RAF1),同时在种子区设计突变型RAF1(MT-RAF1),并将其退火为双链DNA,与pmirGLO载体大片段相连构建为RAF1野生型及突变型报告载体。收集对数期的SCC-4细胞,每孔约4×103个细胞铺于96孔板,每组设3个复孔,分别转染miR-195+pmirGLO,miR-195+WT-RAF1,miR-195+MT-RAF1。根据Promega公司双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海肾荧光素酶试剂进行检测。
1.9 迁移实验检测RAF1的迁移能力
将转染的SCC-4细胞5×105/ml置于含1% FBS的DMEM的Transwell上室内,下室加入含10% FBS的600 μl DMEM,孵育24 h,棉签擦去上室细胞,倒置风干Transwell小室,24孔板中加入500 μl结晶紫,小室浸于其中,37 ℃孵育30 min,PBS清洗、拍照。
1.10 Western blot检测RAF1表达
将转染后的SCC-4细胞采用RIPA裂解液按照操作说明提取蛋白,配置10%的SDS-PAGE凝胶,每孔20 μg蛋白量上样、电泳,室温下5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,二抗室温下孵育1.5 h,TBST洗膜,化学发光观察蛋白的表达情况。
1.11 统计学分析
采用SPSS13.0软件进行统计学分析,组间比较采用t检验进行分析,P<0.05时认为差异具有统计学意义。
2 结果
2.1 成功构建miR-195过表达载体及si-RAF1
将构建成功的miR-195过表达载体转染SCC-4细胞,qRT-PCR检测显示,转染miR-195组的细胞中miR-195的表达显著高于miR-control组(见图1);同时,将合成的si-RAF1转染SCC-4细胞,qRT-PCR检测显示转染si-RAF1组细胞中的RAF1的表达显著低于si-control组(P<0.01,见图1),上述结果提示miR-195的过表达载体及si-RAF1均成功合成并且在SCC-4细胞中均具有良好的转染效率。
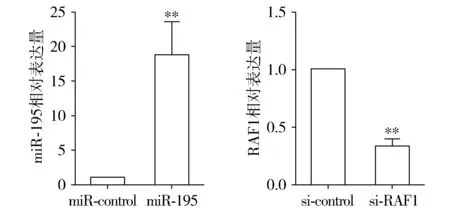
与相应对照组相比,**P<0.01图1 miR-195和si-RAF1在OSCC细胞中转染效率的验证Figure 1 Verification of transfection efficiency of miR-195 and si-RAF1 in oral squamous cell carcinoma
2.2 miR-195、si-RAF1抑制SCC-4细胞的生长
分别将miR-195过表达载体、si-RAF1及相应control转染SCC-4细胞,MTT法、细胞克隆及流式细胞仪检测miR-195及si-RAF1对OSCC细胞生长的影响。与对照组相比,miR-195过表达能够显著抑制SCC-4细胞的增殖活性、克隆形成能力及诱导细胞周期发生阻滞(P<0.05,见图2),同时发现转染si-RAF1的SCC-4细胞,其增殖活性、克隆形成能力也要明显低于si-control组,并且显著诱导细胞周期发生阻滞(P<0.05,见图2),上述结果提示miR-195过表达与RAF1的表达下调对SCC-4细胞均可发挥抑癌效应,抑制OSCC细胞的生长。
2.3 miR-195与si-RAF1能够促进SCC-4细胞凋亡
miR-195与si-RAF1分别转染SCC-4细胞,流式细胞仪检测表明,与对照组相比,miR-195的过表达及RAF1的表达下调均可促进SCC-4细胞早期凋亡和晚期凋亡的发生(P<0.05,见图3),从而提示miR-195与si-RAF1具有促进OSCC凋亡发生的效应。
2.4 miR-195和si-RAF1能够降低SCC-4细胞的迁移能力
将miR-195过表达载体及si-RAF1转染SCC-4细胞后采用Transwell实验法检测各组细胞的迁移能力。如图4所示,与miR-control组相比,miR-195过表达组细胞的迁移率明显降低;同样,与si-control组相比,si-RAF1组细胞的迁移率也明显降低,提示miR-195过表达及RAF1的表达下调均可抑制OSCC细胞的迁移能力。
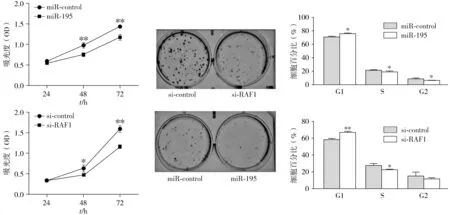
A.细胞增殖活性检测 B.克隆形成能力 C.细胞周期分布变化与对照组相比,*P<0.05,**P<0.01图2 miR-195与si-RAF1异常表达对SCC-4细胞增殖活性、克隆形成能力及细胞周期的调控Figure 2 Effect of abnormal expression of miR-195 and si-RAF1 on proliferation activity, clone formation ability and cell cycle of SCC-4 cells
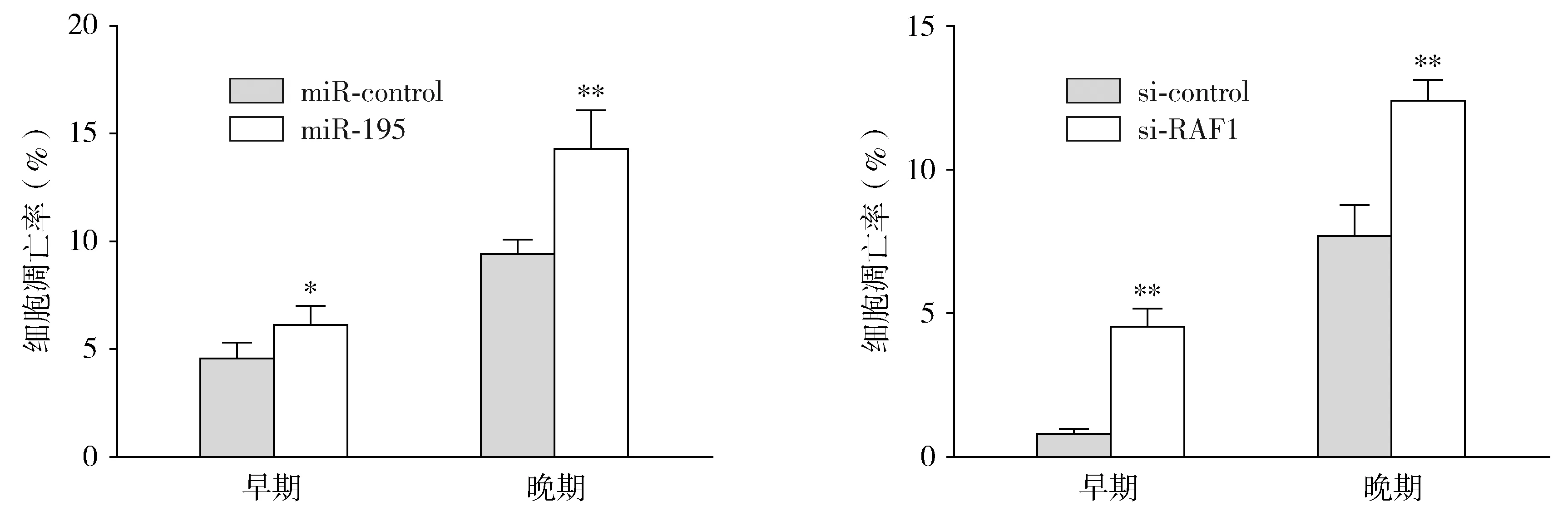
与相应对照组相比,*P<0.05,**P<0.01图3 miR-195与si-RAF1对SCC-4细胞凋亡的调控Figure 3 Regulation of miR-195 and SI-RAF1 to apoptosis of SCC-4 cells by flow cytometry
2.5 miR-195能够靶向下调RAF1的表达
分别对SCC-4细胞共转染miR-195+WT-RAF1、miR-195+MT-RAF1,采用双荧光素酶报告基因检测,结果显示,与对照组相比,miR-195过表达能够显著抑制WT-RAF1报告载体的荧光活性(P<0.05),而miR-195过表达对MT-RAF1的荧光活性无显著抑制效应(见图5A)。此外,qRT-PCR检测显示,miR-195过表达能够显著抑制RAF1的mRNA的表达(P<0.01,见图5B)。Western blot检测显示miR-195过表达能够显著抑制RAF1蛋白的表达(见图5C)。由此提示miR-195在OSCC细胞中与RAF1之间存在良好的靶向关系,能够靶向下调RAF1的表达。
3 讨论
目前有研究显示miR-195的异常表达能够参与人类恶性肿瘤的发生及发展,但是在不同肿瘤中miR-195的表达却存在差异,同时miR-195可能涉及的相关信号通路也不尽相同。在膀胱癌中,miR-195的表达显著降低,其通过抑制膀胱癌细胞G1/S期转换而抑制膀胱癌生长[7],提示其在膀胱癌中扮演着抑癌的角色。同样,Li等[8]学者也在宫颈癌中发现miR-195的表达显著降低,并且可以通过靶向细胞周期蛋白D1的表达调控宫颈癌细胞的侵袭和致瘤性。此外,在结肠癌中也发现了miR-195的表达出现显著下调,过表达的miR-195与结肠癌的淋巴结转移、预后较差相关[9]。本研究结果显示miR-195过表达组的SCC-4细胞增殖活性显著低于空载体组;凋亡率高于空载体组;G1期的细胞百分比显著增高,S/G2期显著降低;细胞迁移率明显降低。结果表明miR-195能够抑制SCC-4细胞的增殖,促进SCC-4细胞的凋亡,诱导细胞周期G1/S的阻滞,降低SCC-4细胞的迁移。
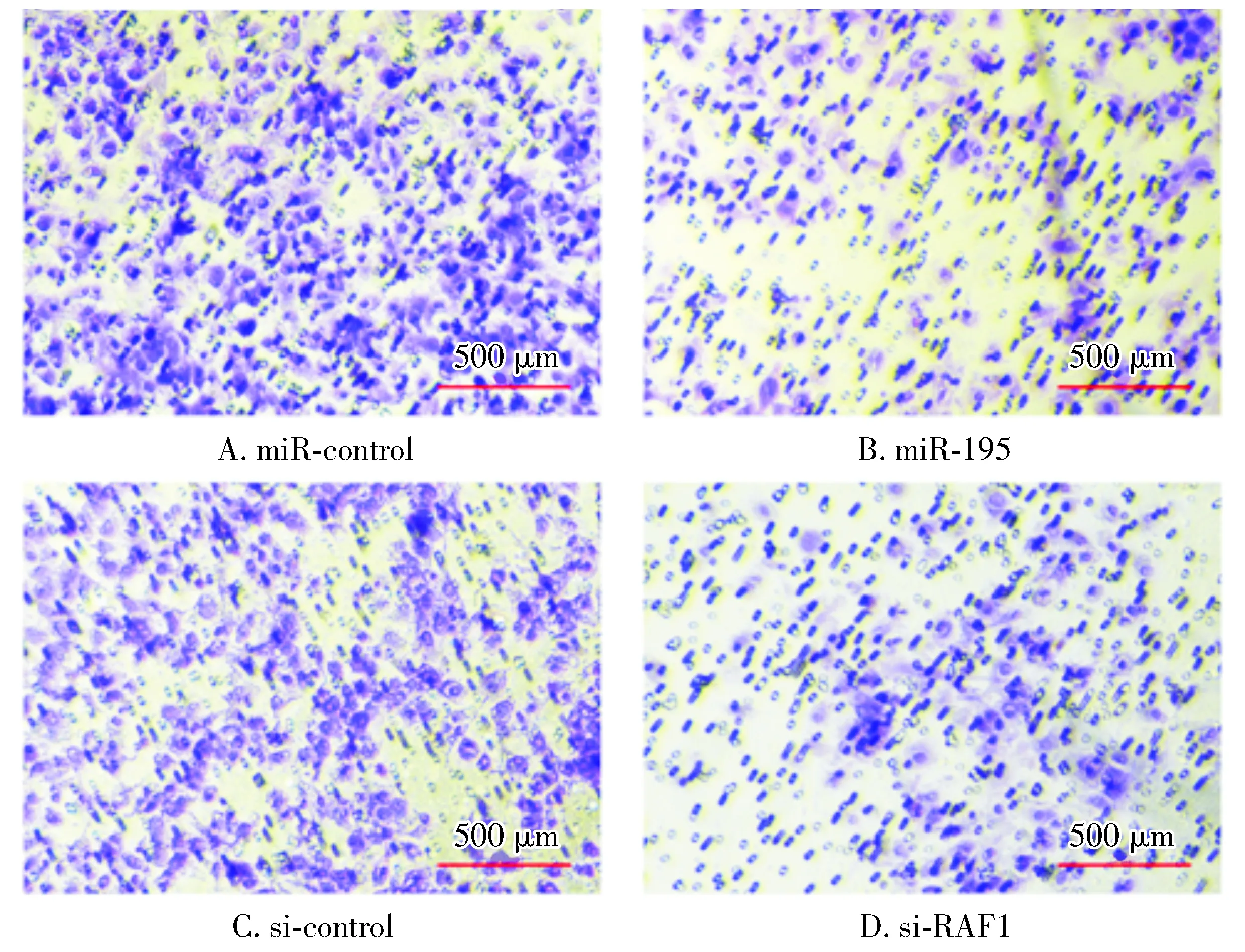
图4 miR-195与si-RAF1对OSCC细胞迁移能力的调控Figure 4 Regulation of miR-195 and si-RAF1 to migration ability of OSCC cells by Transwell

与control比较,*P<0.05 与miR-control比较,**P<0.01 A.双荧光素酶报告基因检测结果 B. qRT-PCR检测结果 C. Western blot检测结果图5 miR-195与RAF1靶向关系的研究Figure 5 Study on the relationship between miR-195 and RAF1
RAF1为一种丝/苏氨酸蛋白激酶,是Ras/Raf/MEK/Erk信号转导通路中重要的成员。RAF1与多种细胞包括肿瘤细胞和上皮细胞的增殖、存活和迁移密切相关[10]。在上皮细胞中,血管内皮生长因子和碱性成纤维生长因子受体活化的信号传导都通过下游的RAF1,其可被看作是几种生长因子诱导肿瘤血管生成的信号枢纽[11];阻断RAF1可能同时抑制肿瘤细胞的生存和血管形成[12],因此RAF1很有希望成为肿瘤靶向治疗的一个新靶点。如在Hood等[11]的试验和Culmsee等[13]的试验都是以RAF1为靶点,阻断了RAF1信号传导,从而抑制肿瘤及肿瘤血管生成。Liu等[14]发现RAF1在胶质母细胞瘤中显著增高,原因与miR-7-5p的表达降低相关,miR-7-5p作为肿瘤抑制基因通过靶向RAF1癌基因来调节胶质母细胞瘤微血管内皮细胞的增殖。本研究结果显示,转染si-RAF1的SCC-4细胞的增殖活性明显低于空载体组;凋亡率高于空载体组;G1期的细胞百分比显著增高,S/G2期显著降低;细胞迁移率明显降低。沉默RAF1能够抑制口腔鳞状细胞癌SCC-4细胞的增殖,促进SCC-4细胞的凋亡,诱导细胞周期G1/S的阻滞,降低口腔鳞状细胞癌SCC-4细胞的迁移,其作用结果与过表达miR-195相一致,那么二者之间是否存在相互的调控关系呢?
生物信息学软件是预测miRNAs靶基因重要方法之一。本研究通过生物信息学的方法预测miR-195可能作用的靶基因,结果显示,miR-195与RAF1之间存在良好的碱基互补关系,提示RAF1可能是miR-195的候选靶基因。为了验证该假说,本研究采用双荧光素酶报告基因检测显示miR-195过表达能明显抑制野生型RAF1报告载体的荧光活性,同时结合Western blot和qRT-PCR实验发现miR-195过表达能够显著抑制RAF1的mRNA和蛋白的表达,从而进一步证实了本研究的假说:miR-195与RAF1之间存在良好的靶向关系。
综上所述,在OSCC中,miR-195的过表达及RAF1的表达下调可以显著抑制SCC-4细胞的增殖活性,促进SCC-4细胞的凋亡,诱导细胞周期G1/S的阻滞,降低SCC-4细胞的迁移能力;同时可以靶向下调RAF1的mRNA和蛋白表达。因此,miR-195可能通过靶向RAF1引起OSCC细胞的生长及迁移能力,并且诱导细胞凋亡的发生,可作为OSCC细胞靶向治疗的一个潜在靶点,这也为课题后期进一步的机制研究奠定了一定的理论基础。

