强直性脊柱炎患者外周血miR-155表达及Th17/Treg平衡的关系
李文清
(青海省中医院检验科,西宁 810000)
强直性脊柱炎(ankylosing spondylitis,AS)是以髋部、腰部、颈部等关节疼痛为临床表现的一种慢性炎症性关节疾病,多认为是由感染、免疫或遗传等因素引发,患者骶髂关节、肌腱及一些肌腱附着点被炎性细胞浸润,引起外周关节炎,对生活质量造成严重影响。研究表明[1],T淋巴细胞免疫反应在机体自身免疫疾病发生过程中起重要作用,可参与调控体内免疫平衡。辅助性T细胞17(T helper cells 17,Th17)在CD4辅助性T细胞(T helper cells,Th)亚群中以分泌促炎细胞因子IL-17被广泛认知,其与具有抑制炎症反应作用的调节性T细胞(regulatory T cells,Treg细胞)在机体中的平衡状态对自身免疫疾病的发生发展密切相关[2]。微小核糖核酸-155(microRNA-155,miR-155)是微小核糖核酸(microRNA,miRNA)家族中可对T细胞增殖、分化起调节作用的一种多功能miRNA,在自身免疫疾病患者外周血中异常表达。目前学术界对强直性脊柱炎患者外周血中miR-155、Th17、Treg表达水平已多有研究[3],但对miR-155表达与Th17/Treg平衡的关系却鲜有报道。本研究拟对AS患者外周血中miR-155表达水平和Th17、Treg细胞分布状态进行测定,探讨AS患者外周血miR-155表达与Th17/Treg平衡的关系。
1 资料与方法
1.1 一般资料
选取2017-04~2018-04在本院诊治的AS患者64例为研究对象,其中男35例,女29例,年龄20-67岁,平均年龄(33.26±5.74)岁,病程1-9年,平均病程(3.58±1.65)年。另取同期在本院体检健康志愿者60例为对照组,其中男32例,女28例,年龄22-68岁,平均年龄(35.84±6.19)岁。两组研究对象在年龄、性别等基本资料方面比较,差异无统计学意义(P>0.05)。研究方案经本院医学伦理委员会审核通过。
1.2 纳入与排除标准
纳入标准:①经1984年美国风湿病协会修订的AS诊断标准[4]确诊为AS患者;②纳入研究前3个月未进行过免疫调节治疗;③患者知晓并同意本次研究,签署知情同意书。排除标准:①妊娠期、哺乳期患者;②合并其他风湿性疾病患者;③合并肝、肾、心脑血管等器官系统疾病患者;④精神不正常患者。
1.3 主要仪器与试剂
5 ml EDTA抗凝管、肝素钠抗凝管(上海生工),PCR试剂盒(大连宝生物工程有限公司),TRIzol试剂(美国Invitrogen公司),逆转录试剂盒(美国Thermo Fisher公司),IL-6、IL-17、IL-23ELISA检测试剂盒(上海晶美生物技术有限公司),流式细胞仪(美国BD公司)。
1.4 研究方法
1.4.1 外周血单个核细胞中miR-155、Foxp3 mRNA水平测定 于清晨采集研究对象空腹静脉血5 ml,置于EDTA抗凝管中,采用人淋巴细胞分离液分离外周血单个核细胞(PBMC),采用荧光定量PCR法对miR-155、叉头翼状螺旋转录因子(forkhead/winged helix transcription factor p3,Foxp3)表达水平进行测定,采用TRIzol法提取总RNA,按照逆转录试剂盒操作步骤合成cDNA,miR-155以U6为内参,进行定量PCR反应,条件:95 ℃预变性3 min,94 ℃ 1 min,60 ℃退火45 s,72 ℃延伸35 s,共进行45个反应循环。Foxp3 mRNA以GAPDH为内参,条件:95 ℃预变性5 min,95 ℃ 30 s,55 ℃退火30 s,72 ℃延伸30 s,共进行40个反应循环。引物序列见表1。
表1定量PCR引物序列
Table1QuantitativePCRprimersequences
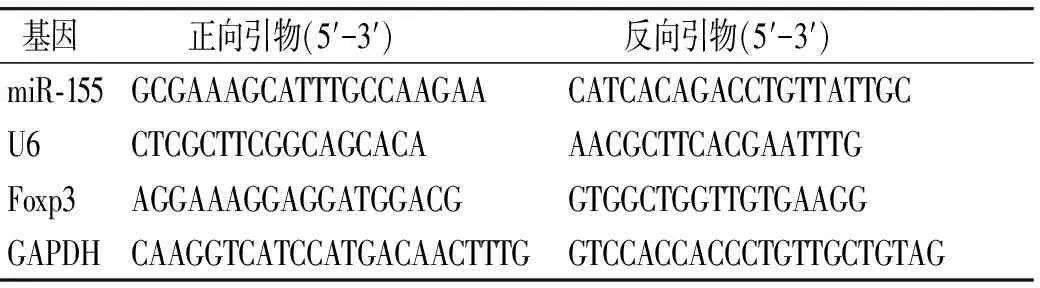
基因 正向引物(5′-3′) 反向引物(5′-3′)miR-155GCGAAAGCATTTGCCAAGAACATCACAGACCTGTTATTGCU6CTCGCTTCGGCAGCACAAACGCTTCACGAATTTGFoxp3AGGAAAGGAGGATGGACGGTGGCTGGTTGTGAAGGGAPDHCAAGGTCATCCATGACAACTTTGGTCCACCACCCTGTTGCTGTAG
1.4.2 Th17、Treg细胞分布状态 于清晨采集研究对象空腹静脉血5 ml,置于肝素钠抗凝管中,分离PBMC并收集提纯后的PBMCs,将细胞浓度调整为1×106/ml接种于6孔板中,加入佛波醇乙酯25 ng/ml 2 μl,离子霉素1 μg/ml 10 μl,放入37 ℃无菌细胞培养箱中,1 h后向加1 μl高尔基阻断剂,培养4-6 h后收集细胞。以CD4-FITC设门,固定,破膜,采用IL-17A PE(5 μl)标记Th17细胞,CD4+IL-17A+的细胞被标记为Th17细胞;采用CD25-PC(5 μl)、CD25 PE(5 μl)标记Treg细胞,CD4+CD25+CD127low的细胞被标记为Treg细胞。采用流式细胞仪检测Th17、Treg细胞百分率,检测结果以阳性细胞百分数及阳性细胞的荧光强度表示。
1.4.3 Th17、Treg细胞相关细胞因子血清水平检测 采用酶联免疫吸附法测定研究对象血清白细胞介素2(interleukin 2,IL-2)、白细胞介素6(interleukin 6,IL-6)、白细胞介素10(interleukin 10,IL-10)、白细胞介素17(interleukin 17,IL-17)、白细胞介素23(interleukin 23,IL-23)、转化生长因子-β(transforming growth factor-Β,TGF-β)水平。
1.5 统计学分析
2 结果
2.1 外周血单个核细胞中miR-155、Foxp3水平测定结果
AS患者外周血单个核细胞中miR-155相对表达量显著高于对照组(P<0.05),Foxp3相对表达量显著低于对照组(P<0.05,见表2)。
表2对照组与AS组外周血单个核细胞中miR-155、Foxp3水平测定结果
Table2LevelsofmicroRNA-155andFoxp3inperipheralbloodmononuclearcellsincontrolgroupandASgroup
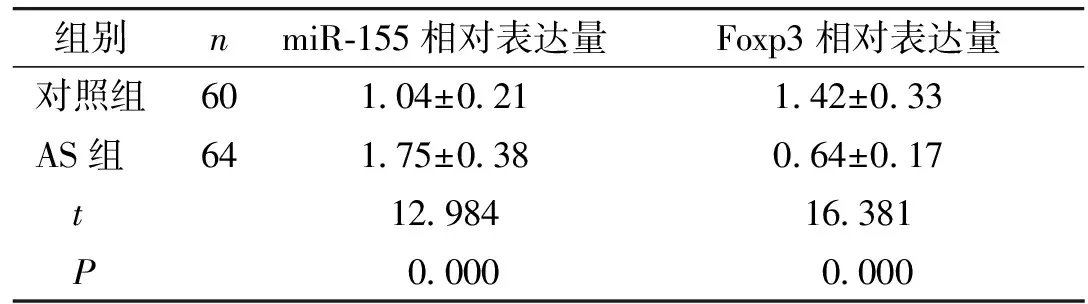
组别nmiR-155相对表达量Foxp3相对表达量对照组601.04±0.211.42±0.33AS组641.75±0.380.64±0.17 t12.98416.381 P0.0000.000
2.2 Th17、Treg细胞比率测定结果
AS组Th17细胞比率显著高于对照组(P<0.05),Treg细胞比率显著低于对照组(P<0.05,见图1,表3)。
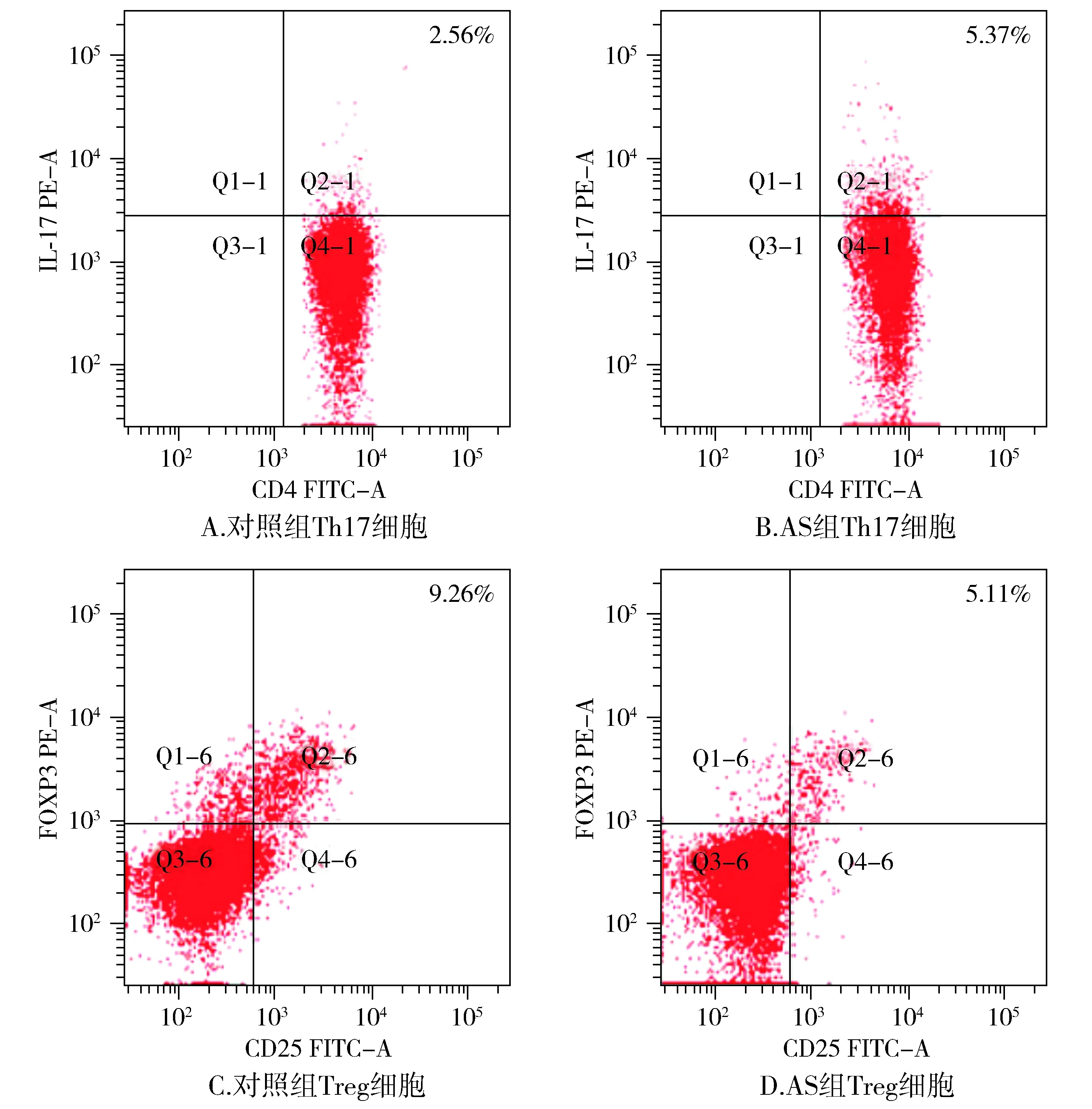
图1 Th17和Treg细胞流式分析图Figure 1 Flow cytometry of Th17 and Treg cell
表3对照组与AS组Th17、Treg细胞比率测定结果
Table3RatioofTh17andTregcelldistributionbetweencontrolgroupandASgroup

组别nTh17细胞(%)Treg细胞(%) 对照组602.56±0.419.26±2.03 AS组645.37±0.825.11±0.94 t24.36214.447 P0.0000.000
2.3 Th17、Treg细胞相关细胞因子血清水平检测结果
AS组IL-2、IL-6、IL-17、IL-23水平显著高于对照组(P<0.05),IL-10和TGF-β与对照组相比,差异无统计学意义(P>0.05,见表4)。
2.4 相关性分析
Pearson相关系数法分析显示,AS患者外周血miR-155表达水平与Th17、IL-17正相关(r=0.779,P<0.01;r=0.854,P<0.01),与Treg、Foxp3负相关(r=-0.801,P<0.01;r=-0.871,P<0.01,见表5、图2)。
表4Th17、Treg细胞相关细胞因子血清水平检测结果(pg/ml)
Table4SerumlevelsofTh17andTregcell-relatedcytokines(pg/ml)
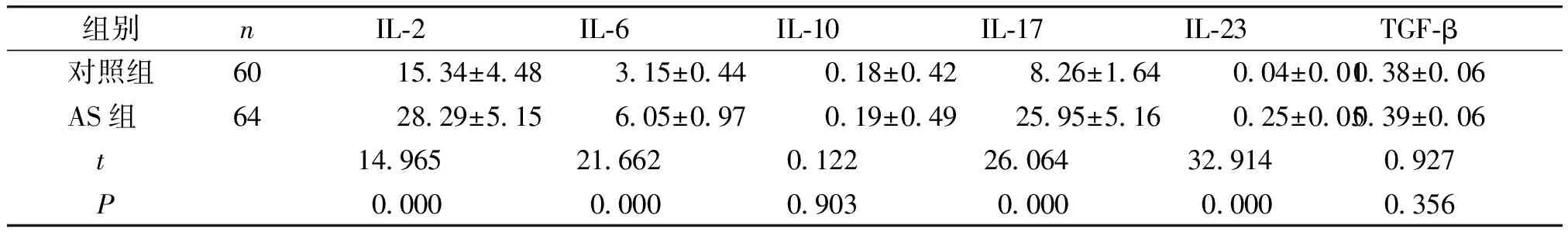
组别nIL-2IL-6IL-10IL-17IL-23TGF-β对照组6015.34±4.483.15±0.440.18±0.428.26±1.640.04±0.010.38±0.06AS组6428.29±5.156.05±0.970.19±0.4925.95±5.160.25±0.050.39±0.06 t14.965 21.662 0.122 26.064 32.9140.927 P0.0000.0000.9030.0000.0000.356
表5外周血miR-155水平与Th17、Treg细胞比率及IL-17、Foxp3表达的相关性分析
Table5CorrelationanalysisofperipheralbloodmiRNA-155levelwithTh17,TregcellratioandIL-17,Foxp3expression
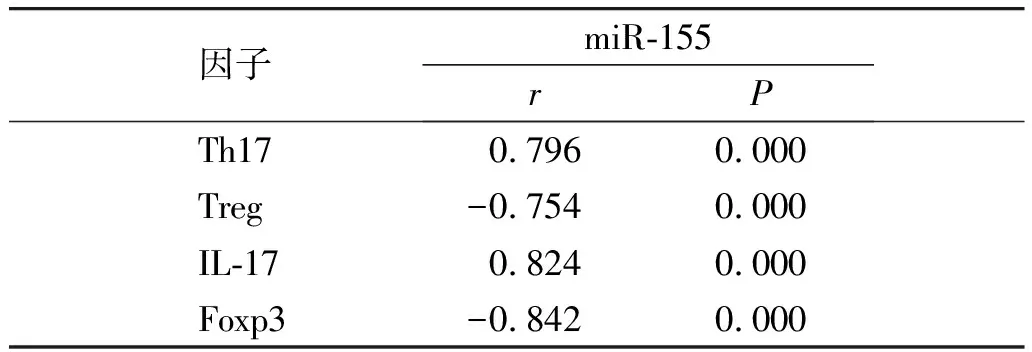
因子miR-155rP Th170.7960.000 Treg-0.7540.000 IL-170.8240.000 Foxp3-0.8420.000
3 讨论
AS属自身免疫性疾病,发病早期无显著临床症状,不易被发现,患者致残率高,且病因较为复杂,与遗传、环境、炎性细胞浸润、细胞因子网络平衡及微生物和宿主的相互作用等多方面因素相关。研究表明[5],位于人类21号染色体上的miR-155可参与机体炎症免疫反应过程,调控T淋巴细胞增殖分化,促进炎性因子表达,导致免疫反应失调。陈倩云等[6]研究表明miR-155可抑制基质金属蛋白酶分泌,刺激Th17细胞活化,促进自身抗体形成,参与自身免疫性疾病发生发展。Zhou等[7]通过研究发现,miR-155在类风湿性关节炎患者外周单核细胞中高表达,表达水平是对照组的2倍左右。本研究结果显示,AS患者外周血单个核细胞中miR-155相对表达量显著高于对照组,提示miR-155在AS疾病患者外周血中高表达。
已有相关研究表明[8],CD4+T淋巴细胞功能异常、活性改变是影响AS疾病发展的重要因素。CD4+T细胞作为机体免疫应答的重要组成部分,可分为Th1、Th2、Th17、Treg等多个相互联系和牵制的亚群,这些亚群可分泌细胞因子,形成细胞因子网络调节抗原特异性T淋巴细胞反应,调控免疫细胞表达。Th17细胞主要分泌炎症细胞因子IL-17,IL-17是一种重要的炎症介质,它可以激活免疫T细胞产生化学增活素、细胞黏附分子等,促进血管上皮细胞分泌炎症因子,刺激单核细胞和成纤维细胞活化,聚集树突状细胞、中性粒细胞引起炎性浸润,从而介导炎症反应发生[9]。此外,Th17细胞还可以分泌IL-6、IL-22等细胞因子,在对外来细菌和真菌的免疫应答中活化中性白细胞,进一步介导炎症反应。IL-17可以与IL-6、IL-1协同促进Th17细胞分泌炎性细胞因子,加快Th17细胞的分化。动物学试验研究显示[10],人为敲除或阻断经IL-17受体拮抗剂治疗小鼠身上的IL-17后,小鼠软骨组织受伤程度和关节炎症严重程度得到极大改善。本研究结果显示,AS组Th17细胞比率和IL-17显著高于对照组,提示Th17细胞百分率和细胞因子IL-17在AS患者中高表达,二者相辅相成相互促进,共同参与AS疾病发生发展。
Treg细胞是CD4+T细胞亚群之一,具有免疫抑制作用,可通过分泌TGF-β、IL-10或细胞间接触介导特异性免疫抑制的调控性T细胞,进而抑制效应T细胞增殖,控制免疫应答强度,维持机体外周免疫耐受性,减轻组织受伤程度[11]。细胞因子TGF-β、IL-2和Foxp3是影响Treg细胞分化的主要因素,Foxp3+Treg细胞可直接或间接抑制机体免疫应答[12],因此常以Foxp3作为Treg细胞的重要标志。本研究结果显示,AS组Treg细胞比率和Foxp3表达水平显著低于对照组,提示Treg细胞百分率和Foxp3在AS疾病患者体内低表达。
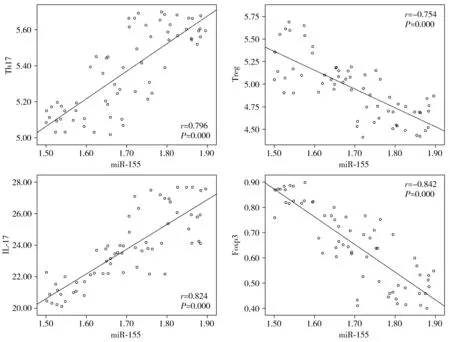
图2 miR-155水平与Th17、Treg、IL-17及Foxp3的相关性分析Figure 2 Correlation analysis of microRNA-155 levels with Th17, Treg, IL-17 and Foxp3
相关研究表明[13],Th17细胞与Treg细胞之间存在相互作用,正常机体中,Th17/Treg细胞处于平衡状态,共同参与免疫调节,维持机体有效免疫应答。在自身免疫疾病患者体内,处于失衡状态,对免疫反应起负调控作用。一方面,Treg细胞通过下调IL-23和IL-17水平抑制Th17细胞分化,IL-23是由巨噬细胞或树突状细胞分泌的一种促炎症细胞因子,可维持Th17细胞稳态扩增产生IL-17,已经过动物试验研究证明与自身免疫疾病紧密相关[14]。任明亮等[15]通过对AS患者体内Th17和IL-23分布状态与水平研究表明,IL-23在AS疾病患者体内高表达,且其受体易感性显著增强。邬秀娣等[16]研究表明,IL-23在AS患者CD4+T细胞上高表达,可促进患者外周血单个核细胞分泌IL-17。另一方面,TGF-β在低浓度和高浓度状态下可分别诱导Th17和Treg细胞产生,其与IL-6或IL-21结合时,对Treg细胞分化起抑制作用。本研究结果显示,AS患者外周血单个核细胞中Th17细胞显著增多,Treg细胞显著减少,Th17/Treg存在严重失衡现象,这与张立丽等[17]研究结果一致,提示Th17/Treg细胞失衡可能促进AS疾病的发展。Th17、Treg细胞相关细胞因子IL-2、IL-6、IL-17、IL-23均属促炎因子,可分别通过不同机制诱导Th17细胞分化,导致机体组织损伤。本研究结果显示,AS组IL-2、IL-6、IL-17、IL-23水平显著高于对照组,推测IL-2、IL-6、IL-17、IL-23在AS患者血清中高表达。IL-10属抑炎症因子,可通过减缓抗原特异性T细胞繁殖来控制机体免疫反应,影响免疫适应性。IL-10可由Th2、Treg等细胞分泌,来源较为复杂,在本研究中,AS组和患者组中IL-10水平无显著差异,推测其不能作为AS疾病评估指标。TGF-β是在控制炎症因子活化过程中起作用的一种多效能细胞因子,可正向调节Treg细胞分化,维持机体免疫平衡,但当与IL-6共同存在时,可刺激Th17分化,负调节机体免疫反应[18]。本研究结果表明TGF-β在AS患者和对照组中无统计学差异,说明TGF-β对AS的参与机制尚需进一步研究。相关性分析结果显示,AS患者外周血miR-155表达水平与Th17、IL-17正相关,与Treg、Foxp3负相关,提示miR-155可能通过影响Th17、Treg细胞水平,打乱Th17/Treg细胞平衡状态,参与AS疾病发生发展。
综上所述,AS患者外周血中miR-155和Th17细胞高表达,Treg细胞低表达,Th17/Treg细胞出现失衡现象,AS患者外周血miR-155表达水平与Th17细胞百分率正相关,与Treg细胞百分率负相关。推测AS患者外周血中miR-155表达水平可能影响Th17/Treg细胞平衡状态。

