Primer Extension-DHPLC检测线粒体DNA 12SrRNA常见耳聋相关突变方法的建立△
李琦 刘亚青 孙晨 黄正华 田涛 戴朴
遗传性聋中,约70%为非综合征型聋( nonsyndromic hearing loss, NSHL ) ,其余约30%为综合征型聋。NSHL 中,以常染色体隐性遗传方式遗传者占80% ,常染色体显性遗传方式遗传者占15% ,X连锁遗传者占3%~5% ,线粒体遗传约占2%[1,2]。线粒体遗传性耳聋尽管所占比例不高,但是由于其与药物性聋的密切关系而备受瞩目。
线粒体遗传具有母系遗传特性,从而导致特定人群携带致病突变及发病。近十余年来关于线粒体突变致耳聋的研究有了突飞猛进的发展,并且已经明确了几个与耳聋有关的线粒体突变,线粒体相关NSHL经常发生在线粒体DNA 12SrRNA和tRNA上,以12SrRNA致病突变发生率最高,而tRNA致病突变发生率则极低;12SrRNA似乎和药物性聋关系更为密切,其突变导致的听力损失常表现为药物性聋或双侧对称、逐渐加重的NSHL[3]。第一个导致常染色体隐性遗传NSHL的线粒体DNA A1555G突变1993年由Prezant等[4]描述,随后961insC、T1095C、C1494T位于编码12SrRNA基因上的突变也被相继报道,其中A1555G是引起母系遗传性聋的最常见的突变[5~9]。变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC)在完全变性的条件下, 通过分离单链DNA检测已知突变,是一种新的基因突变检测策略,与引物延伸(primer extension, PE)结合,可同时对多个突变位点的变异进行检测,尤其适用于一些少见已知突变的筛查。因此,本研究设计了应用Primer Extension-DHPLC(PE-DHPLC)法同时检测线粒体DNA 12SrRNA 961insC、T1095C、C1494T、A1555G 4个突变位点,以建立针对线粒体DNA 12SrRNA基因常见耳聋相关突变检测方法。
1 资料与方法
1.1多重引物延伸的原理及设计 ①设计原理:首先扩增包含上述4个突变位点的靶基因序列,根据包含突变点的靶基因序列设计扩增引物,4种突变的检测依靠多重引物延伸反应,延伸引物的3′末端均紧邻突变点。样本正常时,延伸引物的3′末端延伸碱基不同,正常与突变的单链产物及反应中剩余的引物在全变性条件下可以被DHPLC分辨,根据波形的不同来鉴别正常与突变。②引物及延伸产物碱基:设计上述4个位点的延伸引物,PCR引物由北京奥科生物技术公司合成,延伸引物(表1)。

表1 4个基因突变类型的引物及延伸产物碱基
注:斜体字母是为使PE反应进行而人工加上的碱基,W(wild) 野生型,M(mutation)突变型
1.2样本和主要试剂 4例外周血DNA样本,分别包含线粒体DNA 12SrRNA的961insC、T1095C、C1494T、A1555G 4种不同基因突变,被用来证明PE-DHPLC方法的可行性,4例正常对照(无耳聋及全身系统疾病者)外周血样本;正常和突变DNA序列均经测序验证。主要试剂:Taq酶、Thermo Sequenase DNA Polymerase、dNTPs、ddNTPs(Amersham Biosciences), TEAA(trithylamonium acetate)( Transgenomic),乙腈(Fisher Scientific),Exonuclease I(USB),虾碱性磷酸酶(Alkaline Phosphatase (Shrimp))(Roche Diagnostics)。
1.3实验方法
1.3.1PCR反应 PCR 上、下游引物为上游5′-AAGCATCAAGCACGCAGCAAT- 3′753-773, 下游5′-TGGTAGTAAGGTGGAGTGGGTTTG- 3′1708-1685,扩增片段长度为975 bp,包含了961insC、T1095C、C1494T、A1555G突变位点。采用PCR方法对目标片段进行扩增,反应体系50 μl体系;反应体系中加入100 ng的基因组DNA,10×Buffer(含MgCl215 mmol/L)缓冲液5 μl,10×dNTP(15 mmol/L)5 μl,正反向引物2 pmol/μl各2.5 μl,加Taq酶(北京泰格美科技有限公司)1 μl,加双蒸水至50 μl;PCR反应在德国Whatman Biometra公司Tgradient热循环仪上完成。PCR反应条件为94 ℃预变性5 min,94 ℃变性30 s, 58 ℃复性30 s,72 ℃延伸30 s,30个循环,反应终止后再72 ℃延伸5 min。PCR产物4 ℃保存。取4 μl PCR产物进行1%琼脂糖凝胶电泳(含溴化乙啶0.5 μg/ml)检测产物。
1.3.2PCR产物纯化 PCR产物中加入新鲜配制的Exonuclease I和Alkaline Phosphatase (Shrimp)混合液(Shrimp Alkaline Phosphatase和 Exonuclease I按照10∶1的比例混合)2 μl 37 ℃孵育25 min,清除多余的引物和脱氧核苷酸,随后PCR仪94 ℃ 5 min使酶失活。
1.3.3多重PE反应 多重PE反应在20 μl反应体系中进行(表2,图1),阴性对照是野生型纯化的PCR 产物3 μl,空白对照仅加入3 μl ddH2O。反应条件为96 ℃变性1 min,随后96 ℃5 s、65 ℃15 s进行50个循环。PCR扩增体系的成分组见表2。

表2 多重PE反应体系各成分组成
1.3.4DHPLC分析 在美国Transgenomic 公司的WAVE DNA Fragment Analysis System 上进行。5 μl的PE产物以0.9 ml/min的流动相流量注入样本,引物延伸反应在70 ℃变性条件下进行,以每分钟0.9 ml的流速将结合在检测柱上的延伸产物洗脱下来(表3)。吸光值经系统处理后,信号被输送到监视屏上形成DHPLC色谱曲线,即DHPLC峰型图。选定不同时间重复上述实验2次,将待测样品与标准对照同机反应。
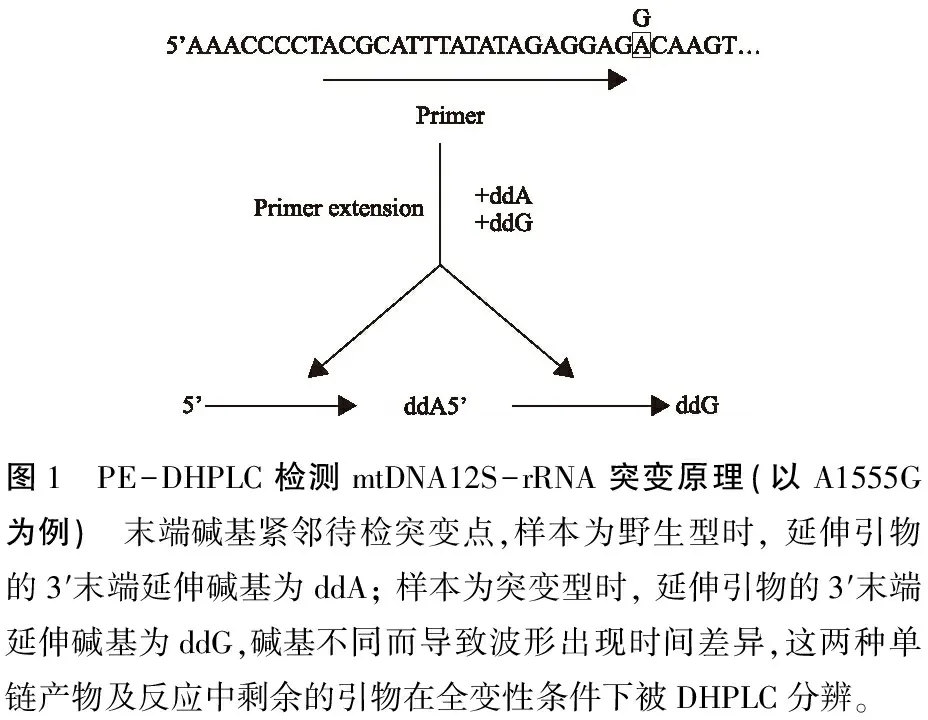
图1 PE-DHPLC检测mtDNA12S-rRNA突变原理(以A1555G为例) 末端碱基紧邻待检突变点,样本为野生型时, 延伸引物的3′末端延伸碱基为ddA; 样本为突变型时, 延伸引物的3′末端延伸碱基为ddG,碱基不同而导致波形出现时间差异,这两种单链产物及反应中剩余的引物在全变性条件下被DHPLC分辨。
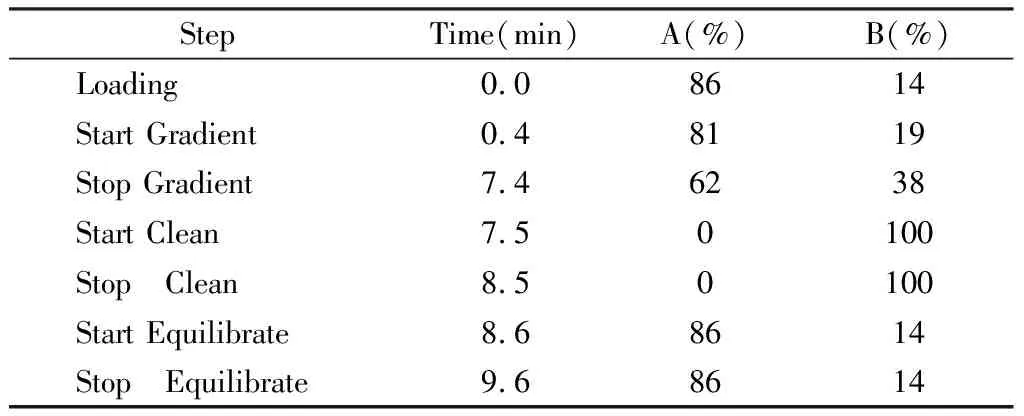
表3 引物延伸参数
注:反应在70 ℃变性条件下进行Buffer A-0.1M TEAA, Buffer B-0.1M TEAA/25% acetonitrile
2 结果
2.1PCR结果 4例包含线粒体DNA 12SrRNA 4种突变的外周血DNA样本进行PCR扩增,均扩增出包括线粒体DNA 12SrRNA 961insC、T1095C、C1494T、A1555G 4种突变的特征性条带,片段长度975 bp,与预期结果相符(图2)。
2.2PE-DHPLC结果 图3是4种突变的DHPLC图,阴性对照只有引物峰,而突变者则有引物峰和突变峰两个峰。初步建立了应用Primer-Extension DHPLC方法检测线粒体DNA 961insC、T1095C、C1494T、A1555G这4种常见突变的方法。在引物设计策略上加入ddNTPs,对所有4个突变设计使用单碱基延伸,结果显示完全可以同时鉴别出这4种突变。
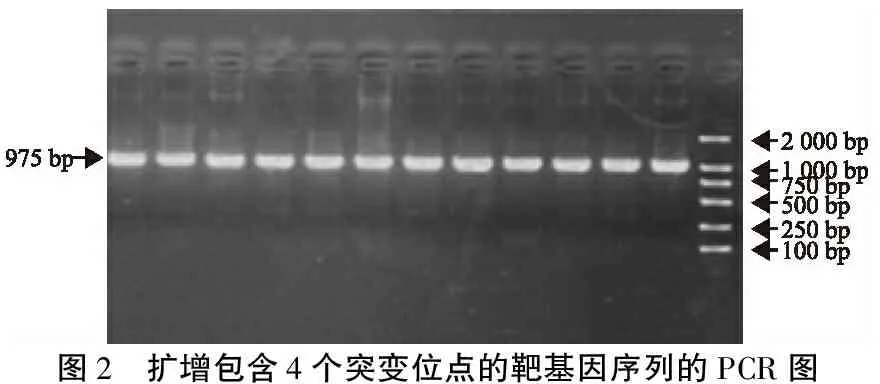
图2 扩增包含4个突变位点的靶基因序列的PCR图
3 讨论
线粒体DNA 12SrRNA和NSHL关系密切,12SrRNA上的4种突变中除了A1555G外,其他3种C1494T、961insC、T1095C在中国人群中较为少见,但均与NSHL有关[5~8]。已经证明12SrRNA上的C1494T和A1555G和药物性聋密切相关,A1555G在很多国家都有报道,发生率约为1%~3%[9~11],而C1494T只在中国人群中有发现,在NSHL中携带率约为0.5%[8,12~14]。研究还发现在线粒体DNA 12SrRNA的961位点的C插入或缺失与氨基糖苷类药物诱发的耳聋有关,961位点的C插入可以加重A1555G突变有关生化缺陷,从而使耳聋程度加重[15],近期的研究也显示T1095C突变增加了氨基糖苷类药物诱发耳毒性的风险[6]。鉴于这4种突变对于耳聋临床病因学的作用,尤其是对药物性聋的意义,采用PE-DHPLC法检测这4种突变可以为快速高效的临床基因诊断提供帮助。

图3 4种突变的DHPLC图 上图阴性对照仅有引物峰,下图是包含4种不同突变的峰图
迄今为止,用于筛查疾病相关基因突变的方法有很多种,包括:单链构象多态性(SSCP)、构象敏感性凝胶电泳(CSGE)、变性梯度凝胶电泳(DGGE)、双相基因扫描(TDGS)、直接DNA测序、基因芯片分析技术等。DHPLC是一种新型的高通量的DNA序列突变及多态性分析技术,用离子对反向高压液相色谱分离检测异源双链有更高的准确性和敏感性。PE-DHPLC扩增包含有突变位点的DNA片段后,紧邻突变位点上方或下方的引物退火,在dNTPs或ddNTPs存在时,引物可以延伸1个或数个碱基,根据延伸产物波形的不同能辨别不同的基因型。该技术最早由Kuppuswamy等[16]于1991年报道,PE-DHPLC原理是利用不同的DNA链与色谱柱之间的吸附力差异来分离不同的DNA分子,在两个DNA分子没有长度差异时,如果碱基组成不同,他们与色谱柱的吸附力就有差异,吸附力有差异的DNA分子洗脱时间不同。利用这一原理,可将两个长度一样的DNA分子先于置高温变性,后置于低温复性,若两个DNA分子序列相同,复性后只产生一条双链DNA分子,经色谱分析只产生一个单独的峰;若两个DNA分子序列不同,复性后会产生同源双链(homoduplex)及异源双链(heteroduplex)等不同的DNA分子,这些DNA分子与色谱柱的吸附力不同,洗脱时间不同,根据DNA片段大小和片断单链的组成顺序从柱上洗脱下来,以峰的形式被记录下来,第一个峰为掺入的引物峰,然后是引物延伸产物峰,根据峰的个数和对称性,可确定基因型。DHPLC 基因突变筛查,就是利用离子对反向液相色谱技术,通过独特的DNA分离基质,对特定的PCR 反应产物进行分离。在待测样品部分变性和乙晴冲洗梯度呈线性增加的情况下,带有突变序列的异源双链,与同源双链(野生型或阴性对照)相比,它们的柱保留时间相对较短,因此,带有突变序列的样品呈现出异源和同源双链混合物的峰型特点,而不含突变序列的样品则只有同源双链的峰型。出现与野生型或阴性对照不同的DHPLC冲洗结果,说明检测样品含有突变序列。
因为遗传性聋有大量的疾病相关位点需要进行基因突变筛查,DHPLC技术是同时检测多个突变的一种理想方法。PE-DHPLC 法最多可以同时检测8种突变,4种突变的检测是完全变性DHPLC最佳检测数量[17]。本实验设置了阴性对照,阴性对照标本只出现4个引物峰,突变者则除引物峰外, 还在特定位置出现了4个突变峰。结果表明, PE-DHPLC 用于检测线粒体DNA 12SrRNA 961insC、T1095C、C1494T、A1555G 4种突变具有明显的技术优势。此外,tRNA上的7472insC、A7445G、T7510C和T7511C突变也可以使用本研究建立的方法检测。本研究检测的这4个突变位于线粒体DNA 12SrRNA上而且相距不远,初步结果显示PE-DHPLC法波峰图清晰易分辨,加入的4种ddNTPs可以使PE反应终止,使4种突变的基因型获得良好的确认,而且结果也容易解释。该方法的优点是加样和分析的自动化,引物延伸后不需要进行纯化过程,是比较简便的突变检测方法,而且多个突变可以复合在一起,降低了实验成本(每个突变检测成本约4~5元人民币)。
PE-DHPLC技术通过温度调节的异源双链分析,自动检测多个基因突变,在突变检测方面有其独特的优势,具有准确性和敏感性高、完全自动化、检测成本低、一次检测多个突变等特点[18]。在PCR 反应引物的修饰、反应试剂的搭配、检测标记以及PCR 反应后处理等方面也没有特殊的要求。PE-DHPLC 技术为确定带有突变序列的样品提供了一种简便而直观的途径,整个实验流程非常简便,首先从合适的来源分离DNA,然后通过PCR反应,扩增目的基因的特定区域(即扩增子),扩增子一般包括一个外显子以及相应的外显子/内含子连接区,也有的扩增子包括启动子区域,或5’/3’非编码区域,在PCR反应之后,可直接利用PE-DHPLC 技术对扩增子进行分析,无需再对PCR产物进行预处理,利用自动化的DHPLC分离方法,目的扩增子可被彻底地扫描。
从临床治疗的角度来看,对已知聋病基因突变的检测对于耳聋的病因学诊断和预防至关重要,PE-DHPLC检测方法敏感性和准确性具有较大的优势,自动化程度高、快速、准确、结果直观,利用DHPLC 技术对已知基因突变进行筛查,可以在不到5个小时内同时检测线粒体DNA 12SrRNA的4种突变,极大地提高检测的效率。本方法的缺陷是PE-DHPLC检测需要专用的设备,由于这4种突变携带频率都很低,发现的变异需进一步测序鉴定,但是DHPLC可以敏感而准确地发现DNA变异,这种新的方法为聋病基因突变的检测提供了一种有效的工具。

