木霉诱导下山新杨PodaPIN9基因的组织表达调控
李枢航 苗 蕊 常 媛 李俊男 燕晓杰 刘照莹 张荣沭
(东北林业大学园林学院,哈尔滨 150040)
山新杨(Populusdavidiana×P.albavar.pyramidalis)是以山杨(P.davidiana)为母本、新疆杨(P.albavar.pyramidalis)为父本杂交得到的优良树种[1]。其树干通直,树姿秀丽美观,因其耐高寒的特点,常用于北方寒冷地区[2]。木霉(Trichodermaspp.)对植物具有多重生防功能,能够抑制病原菌的生长、繁殖和侵染,并诱导植物产生对非生物胁迫的抗性[3~4]。另外,木霉能产生与生长素成分接近的吲哚化合物,进而调节植物激素的浓度,促进植物的生长发育,是一种良好的生物肥料[5~6]。
PIN是一类编码生长素极性运输载体元件的基因家族,影响着高等植物生长素的外向运输和众多生长发育过程[7~9]。近年来已在多个物种中得到克隆、鉴定及生物信息学分析。PIN基因家族的成员编码氨基酸的长度各不相同,编码的PIN蛋白中存在一定高度保守的跨膜环状结构,其多肽链中部的中央亲水环长度存在差异[10~11]。PIN基因时空表达的特异性与生长素的极性运输高度相关[12],而且多个高度保守的PIN基因的存在,表明生长素在植物体内的运输存在多条路径[13],也从另一个侧面证实PIN家族调控着植物不同的生长发育过程[14]。迄今为止,有关PIN家族基因克隆和功能分析的研究多集中于草本植物,而对木本植物有关的研究相对较少。
为了揭示木霉菌对杨树生长素极性运输PIN基因表达的影响,本研究选择山新杨作为试材,以未被处理的山新杨组培苗为对照,分析不同组织中山新杨PodaPIN基因木霉菌诱导下的表达量和生长素含量的变化,研究结果为揭示PodaPIN基因响应木霉菌诱导的表达规律提供依据,并为研究木霉菌的生防机制提供理论基础。
1 材料与方法
1.1 材料
供试植物:山新杨组培苗由本实验室保存。采用WPM+NAA 0.1 mg·L-1+6-BA 0.5 mg·L-1培养基对山新杨组培苗进行继代培养;用WPM+IBA 0.4 mg·L-1培养基对其进行生根培养。将120株长势一致的山新杨组培苗(株高为8~10 cm,茎基直径约为1.5 mm,叶片数为10~12片,幼根长1.5~2 cm,生长条件为温度26℃,湿度85%,16 h/8 h(光/暗),光照强度9 000 lx)分为2组,每组30株幼苗。
供试棘孢木霉Ta536(T.asperellumACCC30536,Ta536),购于中国菌种保藏中心。无菌条件下,将活化后的木霉接种到PDA培养基中,26℃培养5 d获得大量分生孢子。在显微镜下用血球计数板计数,在无菌条件下,用1/10 WPM液体培养基配制成1 103 cfu·mL-1的分生孢子悬液,备用。
1.2 方法
1.2.1 山新杨与真菌互作实验设计
将WPM液体生根培养基中长势一致的山新杨组培苗分为2组,每组30株。以未处理的山新杨幼苗为对照组(CK);将根部接种棘孢木霉Ta536分生孢子的山新杨幼苗设为T组;整个实验均在无菌条件下操作。48 h后,分别收集山新杨的茎尖、第5和第6功能叶和根,每10株山新杨的组织材料为一个生物学重复,将其迅速置于液氮中,存入-80冰箱备用。
1.2.2PodaPIN9基因克隆
在本实验室构建的山新杨与木霉菌互作的转录组最长基因文库中基于基因功能注释进行搜索,获得Potri.013G087000.v3.0(PodaPIN9)基因的cDNA全长序列。采用CTAB裂解法提取上述样本RNA。并用DNaseI(Promega)消化去除DNA。根据PodaPIN9序列设计引物(表1),RT-PCR扩增条件为:94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸70 s,共35个循环;72℃延伸7 min。将扩增片段进行纯化并按照说明书将其连接到pMD18-T载体上,送交上海生工公司进行测序。最后,将基因序列提交到GenBank。
1.2.3PodaPIN9基因生物信息学分析
利用NCBI的BLASTx程序(https://blast.ncbi.nlm.nih.gov/)进行比对获得PodaPIN9同源蛋白序列;利用ExPASy网站中ProtParam(http://web.expasy.org/protparam/) 分析PIN蛋白的氨基酸组分及理化性质。利用NCBI上的ORF Finder程序(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析PodaPIN9的开放读框长度;利用NCBI的Conserve Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守区;运用Psort Ⅱ prediction(http://psort.hgc.jp/form2.html)进行亚细胞定位;利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测PodaPIN9蛋白跨膜结构域;利用Prot Scale(http://web.expasy.org/protscale/)进行PodaPIN9蛋白疏水性分析。利用ClustalX1.81软件对PodaPIN9同源序列进行多序列比对分析,并用Mega6.0软件构建进化树。

表1 PCR引物序列
1.2.4 RT-qPCR验证和数据分析
参照罗氏公司第一链cDAN反转录合成酶(Transcriptor First Strand cDNA Synthesis Kit(Roche Co.) protocol)试剂盒,以提取的RNA为模板,反转录合成cDNA。稀释10倍后作RT-qPCR模板。
采用罗氏LightCycler 96 real-time PCR detection system和罗氏FastStart Essential DNA Green Master Mix(Roche)试剂盒进行荧光定量PCR反应。所有基因的引物见表1。以Podaactin1(KP973950),PodaEF1-α(KP973951)和Podaubiquitin(KP973952)3个基因为内参基因。反应体系为20 μL:Master Mix,2×conc.(Roche)10 μL,上下游引物各2 μL(5 μmol·L-1),各采样时间点的模板2 μL,加去离子水补足20 μL。RT-qPCR反应条件为:95℃预变性600 s;95℃变性5 s,59℃退火15 s,72℃延伸10 s,设45个循环。溶解曲线条件为:95℃ 10 s,65℃ 60 s,97℃ 1 s。为确保实时定量RT-qPCR结果的重现性,对每个样品进行3个技术重复。
1.2.5 山新杨IAA提取及含量分析
IAA和IBA标准品购于Sigma-Aldrich公司(Sigma-Aldrich Co. Shanghai,China),色谱级甲醇,甲酸和乙腈来自Merck公司。参照Zhang[15]的内标法提取样品中的IAA,将获得的提取物定容至1 mL,用0.45 μm PTFE滤器filter过滤,取10 μl注入系统进行检测。
色谱分析采用1100 HPLC系统(Agilent,San Jose,CA,USA),由G1379A在线脱气装置,7725i手动进样器和G1312A二元泵组成。Agilent ODS C18反向色谱柱(150 mm×4.6 mm;I.D.,5 μm)串联Phenomenex C18预柱用于分离提取物,柱温25℃。流动相程序参照文献Zhang[15]执行。
质谱条件:API3000三重四极杆质谱仪在负离子模式下进行操作。参照文献Zhang和Yao[16]优化IAA和内标物质谱参数。采用Analyst software 1.4对检测结果进行数据分析。
1.3 数据分析
采用2-ΔΔCt方法[17]对PodaPIN9在不同组织和不同诱导条件下的差异表达进行相对定量分析,公式中的Ct代表热循环仪检测到反应体系中荧光信号的强度值;2-△△Ct是表示每个时间点采集的样品目的基因的表达相对于对照组样品的变化倍数。采用Excel 2007软件(Microsoft company,USA)和SPSS 22.0软件(SPSS Inc.,IBM company,USA)进行Pearson相关分析,分析不同组织中PodaPIN9基因表达量与内源IAA水平的相关性。实验数据采用平均值±SD来表示。对处理组(T)与对照组(CK)间的差异显著性进行ANOVA分析,在P=0.05下比较差异性。
2 结果与分析
2.1 PodaPIN9基因序列分析
获得的PodaPIN9蛋白编码区基因的cDNA长度为1 044 bp,GenBank登录号为MH497373。该基因的起始密码子在第1 bp处,终止密码子位于第1 044 bp(图1A)。共编码347个氨基酸,具有完整的Mem_trans(pfam03547)保守域,位于PodaPIN9的第28~996位期间(图1B)。预测该蛋白为亲脂性蛋白,属于膜蛋白。预测的PodaPIN9在细胞膜、内质网中分别占56.5%,21.7%,在液泡中占8.7%,在细胞核、线粒体、高尔基体中各占4.3%,其中分布在细胞膜和细胞质中的最多,推测其在物质运输、生物合成等过程中发挥离子通道载体以及信号传导和转录调控的作用。

图1 PodaPIN9编码序列和预测的保守域 A.PodaPIN9编码序列;B.PodaPIN9预测的保守域Fig.1 PodaPIN9 Protein coding sequence and prediction of conservative areas A.Coding sequence of PodaPIN9;B.Prediction of conservative areas of PodaPIN9
2.2 PodaPIN9与6种不同物种PIN基因理化性质分析
为分析PodaPIN9与植物PINs的同源性,在NCBI中进行BLAST比对,得到一致性在80%以上,序列覆盖率达到99%,阈值为0.0的9条不同物种PINs基因。其中,PodaPIN9与XP_006376058.1(P.trichocarpa)、XP_011014382.1(P.euphratica)、XP_002325466.1(P.trichocarpa)的相似度最高,达87%~100%;与XP_012088767.1(Jatrophacurcas)和XP_011009309.1(P.euphratica)的氨基酸序列一致性为85%;与XP_021620129.1(Manihotesculenta)的氨基酸序列一致性为84%;而与XP_021681402.1(Heveabrasiliensis)和XP_002512623.1(Ricinuscommunis)的一致性为83%;与XP_021622803.1(M.esculenta)一致性为82%。
这些PIN基因的编码氨基酸长度在345~359个氨基酸之间,其中编码氨基酸长度在345~350个氨基酸的有6个;氨基酸长度在351~359个氨基酸之间的有4个。其中编码氨基酸最长的基因是HbPIN(XP_021681402.1),长度为359个氨基酸,预测蛋白的分子量是39.34 kD,理论等电点(pI)为6.20;编码氨基酸最短的基因是PePIN1(XP_011014382.1),长度为345个氨基酸,预测蛋白分子量是37.68 kD,理论等电点(pI)为8.11。10种PIN蛋白的等电点变化范围是6.20(HbPIN)~8.84(PtrPIN2),除HbPIN编码酸性蛋白外,其余均为碱性蛋白,表示PIN基因编码碱性蛋白(表2)。

表2 PINs基因特性
2.3 PodaPIN9蛋白结构与特性分析
将PodaPIN9与另外6个物种的9条PIN蛋白序列进行对比分析(图2A),结果显示PINs蛋白具有多个跨膜结构区域,在不同植物间也具有高度保守性。推测这种保守性与PIN蛋白的跨膜运输功能相关。PodaPIN9中部的亲水区域较短,与橡胶树(XP_021681402.1)、木薯(XP_021622803.1)、蓖麻(XP_002512623.1)、麻风树(XP_012088767.1)PIN蛋白对比出现一定差异,但与毛果杨PtrPIN1(XP_006376058.1)、PtrPIN2(XP_002325466.1),胡杨PePIN1(XP_011014382.1)、PePIN2(XP_011009309.1)PIN蛋白对比显示高度一致性,推断PodaPIN9亲水区(C区)结构比较保守。C区存在3个磷酸化位点,均为丝氨酸,分别位于162 aa,166 aa和173 aa处。这些位点影响PodaPIN9蛋白的功能调控。在C端疏水区附近存在IM(NPXXY)保守结构,位于198~202 aa处。该结构调控PIN蛋白的内吞作用,对膜蛋白与受体蛋白的互作起到至关重要的作用。
对PodaPIN9的跨膜结构域进行分析,共存在9个跨膜结构区域(图2B)。其中在N端有5次跨膜,分别位于10~28,40~62,72~89,96~118和133~152 aa;在C端有4次跨膜,分别位于191~213,228~250,257~279和320~342 aa。蛋白质跨膜区与蛋白疏水性密切相关,跨膜区的数量直接影响蛋白质的性质。
蛋白质的疏水作用维持着蛋白质的高级结构,蛋白质的功能与蛋白的亲水性和疏水性密切相关。PodaPIN9由分布在N端和C端的两个疏水区和中间一个亲水区构成,疏水结构主要位于0~156和190~346 aa,每个疏水区均有几次跨膜折叠。在150~190 aa存在明显的亲水结构(图2C)。
在Genbank数据库中利用BLASTx进行序列搜索,获得19条与PodaPIN9一致性最高的PIN基因序列,采用MEGA软件NJ法(Neighbor-Joining)构建PodaPIN9和与其他植物共20条PIN基因遗传进化树(图2D)发现,整个进化树可划分为5大组。第I组包括月季XP_024189580.1(Rc)、栓皮槠XP_023900720.1(Qs)、胡桃XP_018824175.1(Jr)、桃树XP_007205413.1(Pp)、日本樱花PQQ14830.1(Py)、甜樱桃XP_021818394.1(Pa)、猕猴桃PSR92937.1(Ac)、葡萄XP_002279191.1(Vv)、可可树XP_017976286.1(Tc)9条PIN基因。PodaPIN9与毛果杨XP_006376058.1(Ptr)、毛果杨XP_002325466.1(Ptr)、胡杨XP_011009309.1(Pe)、胡杨XP_011014382.1(Pe)共同处于第二组,即在通过BLASTx比对得到的19条与PodaPIN9相似PIN基因中,毛果杨、胡杨的PIN基因与PodaPIN9亲缘关系很近。其中以毛果杨XP_006376058.1(Ptr)与PodaPIN9亲缘关系最近,毛果杨XP_002325466.1(Ptr)与胡杨XP_011009309.1(Pe)的亲缘关系最近,胡杨XP_011014382.1(Pe)独自处于一个小的进化分支。第Ⅰ组与第Ⅱ组处于一个大的进化分支内,亲缘关系相对较近。麻风树XP_012088767.1(Jc)、木薯XP_021620129.1(Me)、蓖麻XP_002512623.1(Rc)、野草莓XP_004302153.1(Fv)PIN基因处于第Ⅲ组,组内物种PIN基因亲缘关系较近,但与第二组的杨树PIN基因亲缘关系相对较远。橡胶树XP_021681402.1(Hb)、木薯XP_021622803.1(Me)分别处于第Ⅳ组和第Ⅴ组,与第二组的杨树PIN基因亲缘关系较远。
2.4 PodaPIN9在不同处理山新杨中的差异表达
qRT-PCR技术分析结果表明,PodaPIN9在山新杨茎尖、第5、6功能叶和根中均有表达(图3)。在茎尖中的表达量最高,是根中503.61±24.74倍;在叶中的表达量低于茎尖,是根中表达量的346.15±30.03倍,3个组织相比根中的表达量极低。
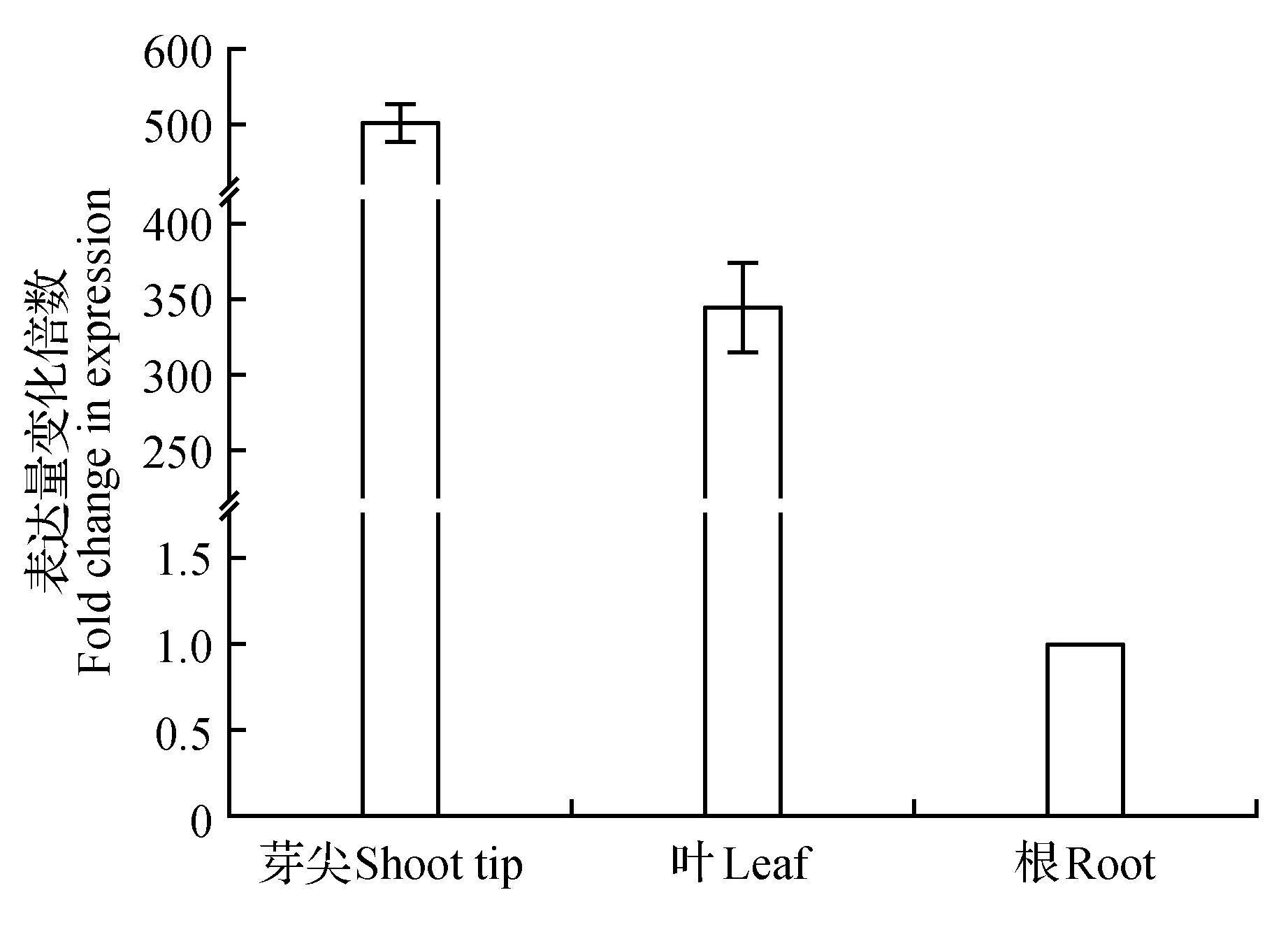
图3 PodaPIN9在山新杨不同组织中的差异表达Fig.3 Differential expression of PodaPIN9 in P.davidiana×P.alba var. pyramidlis
在茎尖组织中,T组PodaPIN9表达量下调,为对照的0.23倍;在叶组织中,PodaPIN9的表达量仍然表现为下调,T组表达量下调为对照的0.63倍;在根组织中,T组PodaPIN9基因表达量迅速上调,为对照的23.51倍(图4)。说明PodaPIN9基因在根组织中被强烈诱导表达。
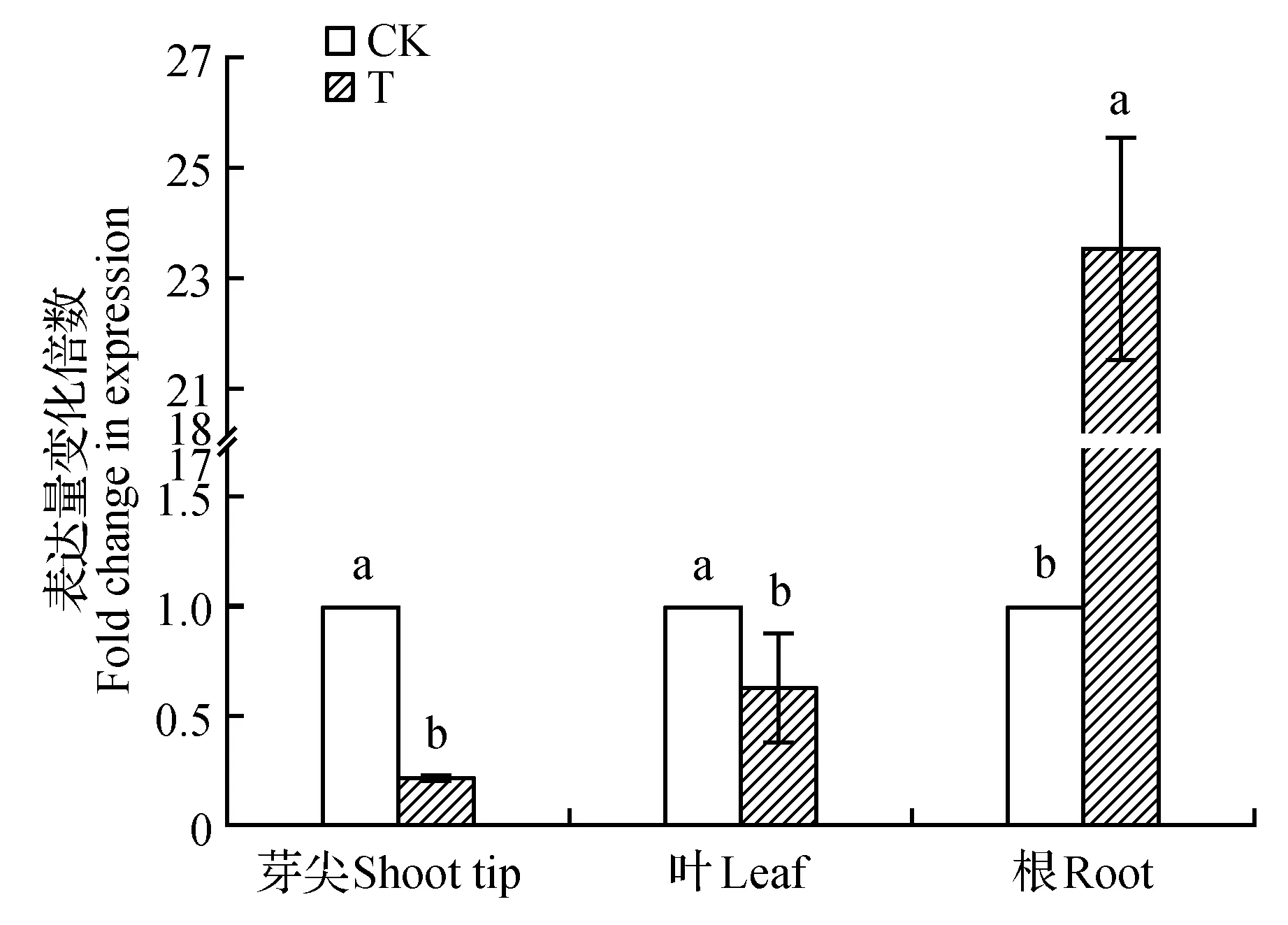
图4 PodaPIN9在不同处理的山新杨不同组织中的差异表达Fig.4 Differential expression of PodaPIN9 in different treatments of P.davidiana×P.alba var. pyramidlis
2.5 山新杨不同组织中IAA含量分析
山新杨IAA含量检测结果显示:茎尖的IAA含量最高,是根中的的2.04倍;叶中的IAA含量是根中的的1.34倍。
在茎尖组织中,T组IAA含量高于CK,是对照的1.01倍。在叶组织中,T组中IAA含量降低,是CK的0.78倍。在根组织中,T组IAA含量升高至CK的1.24倍(图5)。
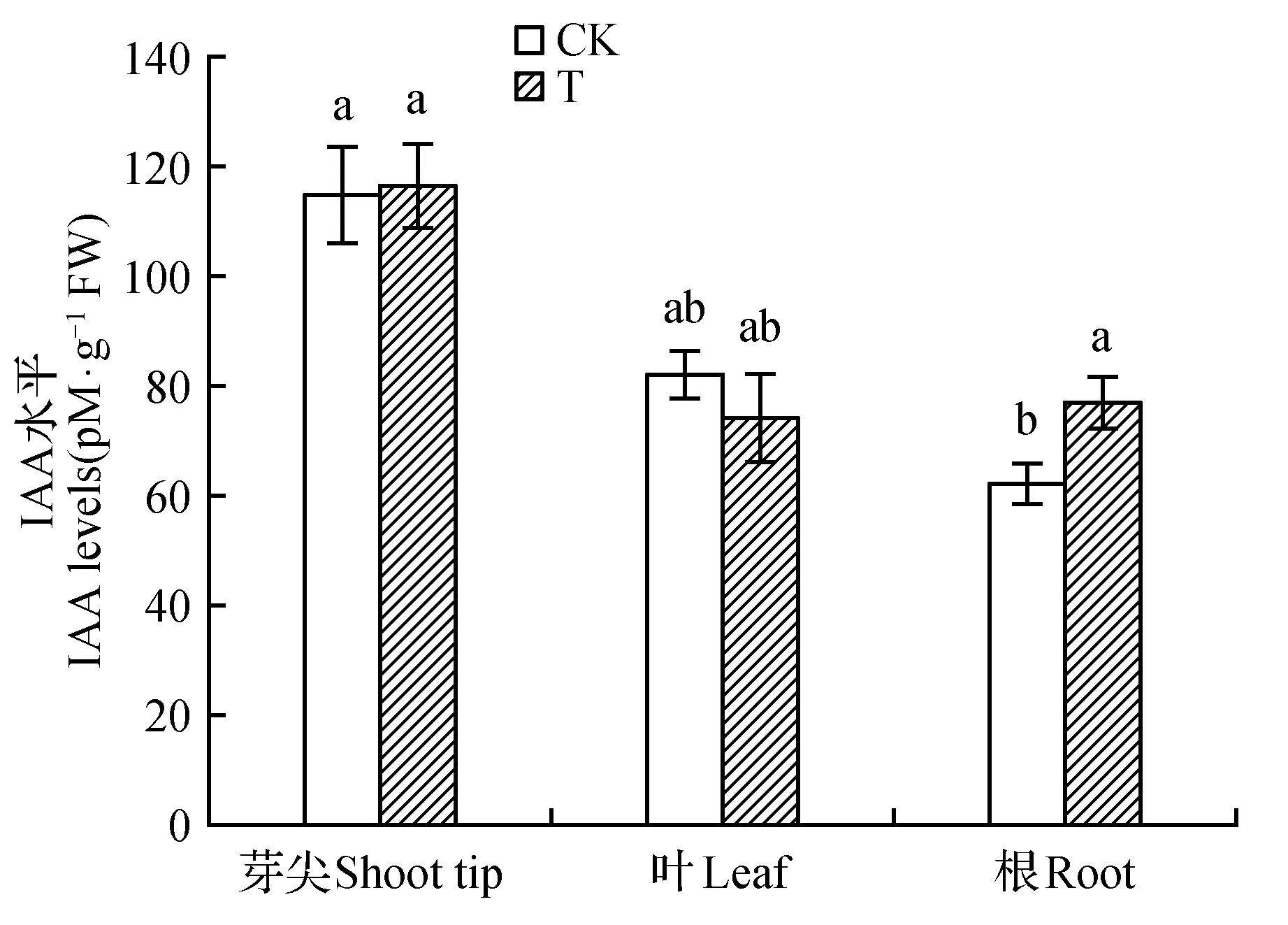
图5 不同处理山新杨各器官中IAA水平Fig.5 IAA level under different treatment in different organs of P.davidiana×P.alba var. pyramidlis
2.6 PodaPIN9差异表达与IAA水平相关性分析
为验证PodaPIN9表达量与IAA水平的相关性,将PodaPIN9表达量与IAA水平进行Pearson相关分析(表3)。结果表明,在茎尖中,T组PodaPIN9表达量与IAA水平相关性最大,呈现负相关,相关系数为-0.989;在叶中,CK组PodaPIN9表达量与IAA水平呈负相关,相关性较大(R为-0.918),而T组中PodaPIN9表达量与IAA水平为正相关,相关系数极小,仅为0.146。在根组织中,PodaPIN9表达量与IAA水平的相关性均比较强,尤其是T组,相关系数为0.937,呈正相关。
表3PodaPIN9表达量与IAA水平Pearson相关分析
Table3PearsoncorrelationanalysisofPodaPIN9expressionandIAAlevel
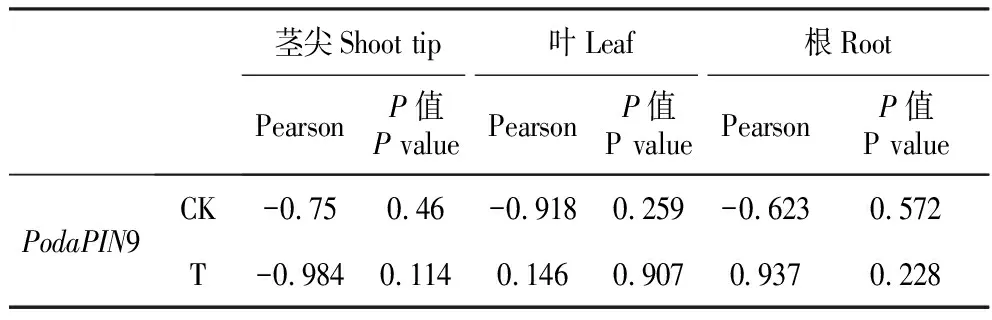
茎尖Shoot tip叶Leaf根RootPearsonP值P valuePearsonP值P valuePearsonP值P valuePodaPIN9CK-0.750.46-0.9180.259-0.6230.572T-0.9840.1140.1460.9070.9370.228
3 讨论
PIN是一类编码生长素极性运输载体元件的基因家族,影响着高等植物生长素的外向运输和众多生长发育过程[18]。近年来已在多个物种中得到克隆、鉴定及生物信息学分析。迄今为止,有关PIN家族基因克隆和功能分析的研究多集中于草本植物,以拟南芥(Arabidopsisthaliana)[19]、番茄(LycopersiconesculentumMill)[20]、水稻(OryzasativaL.)[21]等植物为代表,多集中于PIN1~PIN4与PIN7的研究,现已比较透彻。本研究选择具有极高园林价值与生态价值的山新杨作为研究对象,选取在木霉作用下各组织差异表达明显的PodaPIN9。把Potri.013G087000.v3.0蛋白序列在NCBI上进行比对,得到结果与毛果杨PIN5基因100%一致,与胡杨PIN5基因97%一致,在Phypozome12上毛果杨Potri.013G087000被描述为PIN9。根据这个描述把Potri.013G087000.v3.0命名为PodaPIN9。对其蛋白结构、特征进行了预测分析,与其他物种PIN9基因构建系统进化树。PodaPIN9蛋白是一种跨膜蛋白,两侧为疏水区,中间为亲水区,靠近羧基端疏水区存在1个IM保守结构。本研究推断PodaPIN9亲水区(C区)较短且结构比较保守。其中每个疏水区均有5~6次跨膜折叠,为其跨膜运输功能提供结构基础。亚细胞定位预测PodaPIN9主要分布在细胞膜(56.5%)、内质网(21.7%)和液泡(8.7%)中,推测其在物质运输、生物合成等过程中发挥离子通道载体以及信号传导和转录调控的作用。PodaPIN9与毛果杨中XP_006376058.1亲缘关系最近,与毛果杨和胡杨中PIN基因亲缘关系很近。Potri.013G087000(PIN9)在茎中高度表达,qRT-PCR技术验证结果表明PodaPIN9在茎尖中表达量明显高于在根和功能叶中。这与Carraro N等[22]认为PIN9在杨树根部表达量最高不一致。并且与番茄中SlPIN9在根中表达量最高也不一致[20]。并且发现PodaPIN9跨膜结构与番茄中SlPIN10跨膜结构十分相近,SlPIN10也是特异性的在根中表达[20]。这也与PodaPIN9在木霉菌作用下的表达量变化相符。推测该类基因表达易受外界条件变化影响。目前,对拟南芥AtPIN基因家族中AtPIN1,AtPIN2,AtPIN3~AtPIN8这8条基因功能的研究较多,对PIN9基因功能的研究相对较少。PodaPIN9与拟南芥中短PINs成员中的AtPIN5和AtPIN8结构相似,亲水环小于50aa。但AtPIN5和AtPIN8主要分布在内质网上[23]。推测PodaPIN9同属于短PINs成员,但预测的组织分布与AtPIN5存在差异,有待于进一步进行实验验证。
第5和6功能叶中IAA水平与PodaPIN9的表达量相关性不大,推测与叶的生理功能有关,叶组织不是IAA生物合成的主要部位。而茎尖和根部都是IAA合成的主要部位,受到木霉菌作用的茎尖和根组织中IAA水平均有提高,但与PodaPIN9的表达量的相关性并不一致,推测PodaPIN9对环境刺激较为敏感,由于根部受到木霉菌作用,使其与在茎尖部位的表达量出现极显著差异。并推测木霉处理增加了根中IAA含量,影响了根中IAA向外极性运输,使PodaPIN9的表达量改变,从而与其它因子协调,来调控杨树苗的生长发育。

