白桦BpBEE2基因的遗传转化及抗逆性分析
颜 斌 武丹阳 李慧玉
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
BrassinolideEnhancedExpression(BEE)基因编码植物所特有的bHLH转录因子,是调控油菜素内酯(BR)信号转导的重要元件[1]。目前对该类基因的研究较少。在拟南芥中发现3个BEE基因是BR信号途径中是早期应答受体,该基因间存在功能冗余,3个基因同时突变的拟南芥表现出植株矮小和开花延迟等现象,同时发现该类基因除了参与BR途径外,还参与其他激素途径[1]。在杨树中,BEE3基因通过增加木质部细胞的增殖提高杨树的生物量[2],除此之外,还发现在拟南芥中,BEE和BIM能正调控光响应途径[3]。
bHLH转录因子是一类在生物界广泛存在的转录因子家族,在植物中广泛参与生长发育过程的调控,以及外界环境胁迫的应答反应[4~6]。水稻中,OsbHLH148参与应答茉莉酸、脱落酸以及干旱、高盐、低温和机械损伤等非生物胁迫,并且通过参与茉莉酸信号途径对水稻的干旱耐受性起调节作用[7]。在拟南芥中,bHLH家族基因BP1、AtMYC2及AtAIB参与了脱水胁迫反应[8]。陆地棉中分离的GhbHLH1被ABA、干旱和盐胁迫所诱导表达。拟南芥中发现的bHLH92转录因子,受盐、干旱、渗透、冷等多种胁迫的强烈诱导[9~10]。在水稻幼苗中,OsbHLH1基因能特异地被冷胁迫诱导表达,研究表明,OsbHLH1基因在冷信号传导过程中起到转录调控的作用[11]。
白桦(BetulaplatyphyllaSuk.)为桦木科(Betulaceae)桦属(Betula)植物,是天然林更新先锋树种,具有重要的生态、观赏和实用经济价值,被列为国家科技计划研究的重要树种之一[12~13]。本研究以白桦为研究对象,克隆BpBEE2全长cDNA序列,构建过表达及抑制表达载体,通过农杆菌介导法获得了转BpBEE2基因的过表达和抑制表达白桦株系,为揭示BpBEE2基因在植物生长发育及抗逆性中起到的提供理论依据。
1 材料和方法
1.1 材料与试剂
采自东北林业大学林木白桦强化育种基地内的白桦全同胞种子,选择发育状态良好的成熟种子作为遗传转化的受体。
pBIOZOL Plant Total RNA Extraction Reagent购置于北京博迈斯生物科技有限公司,高保真KOD酶购置于东洋纺(上海)生物科技有限公司,ReverTra Ace® qPCR RT Master Mix with gDNA Remover反转录试剂盒购自东洋纺(上海)生物科技有限公司,限制性内切酶XalⅠ、BamHⅠ、SacⅠ和KpnⅠ均购自于宝生物工程(大连)有限公司,pENTRTM SD/D-TOPO Cloning Kit(Lot no.650448)with One Shot Chemically CompetentE.coli(K2420)和Gateway LR ClonaseTMⅡ Enzyme Mix(Lot no.635076)购置于Invitrogen公司。感受态细胞DH5α购自北京全式金生物技术有限公司,根癌农杆菌(Agrobacteriumtumefaciens)EHA105菌株、pGWB2和pROKⅡ载体为本实验室保存。
1.2 白桦BpBEE2基因的克隆
利用pBIOZOL Plant Total RNA Extraction Reagent试剂盒提取白桦的总RNA,反转录成cDNA后作为模板,利用表1中的引物进行PCR扩增,反应程序:94℃预变性2 min后,进行PCR循环:94℃变性45 s,58℃退火45 s,72℃延伸1 min,35个循环后继续在72℃延伸7 min,PCR扩增结束后,在1.2%琼脂糖凝胶中进行电泳分析。使用胶回收试剂盒回收纯化目的片段,并送往上海英俊生物公司进行测序。
表1构建BpBEE2基因植物过表达载体的引物序列
Table1Primersequencesofbuildingplantoverexpressionvector
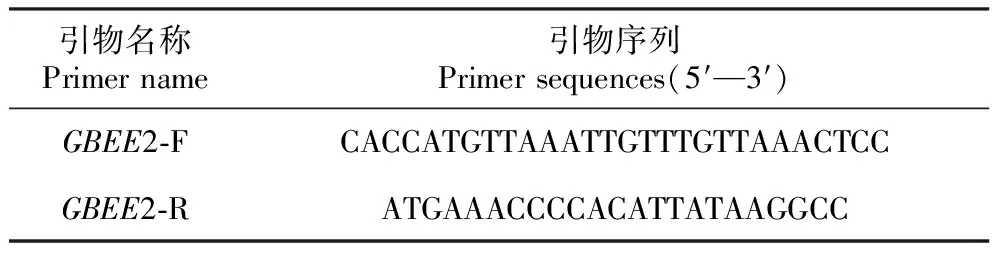
引物名称Primer name引物序列Primer sequences(5′—3′)GBEE2-FCACCATGTTAAATTGTTTGTTAAACTCC GBEE2-RATGAAACCCCACATTATAAGGCC
1.3 植物表达载体构建
1.3.1BpBEE2植物过表达载体构建
利用GATEWAY技术构建植物过表达载体[14],具体方法参见pENTRTM/D-TOPO Cloning Kit和LR ClonaseTMⅡ Enzyme Mix试剂盒说明书。通过PCR及测序鉴定为阳性的克隆(pGWB2-BpBEE2),提取质粒通过电击法导入EHA105农杆菌感受态细胞中,在LB培养基(50 mg·L-1卡那霉素+50 mg·L-1利福平)上筛选,鉴定含有重组质粒的农杆菌,作为遗传转化用的工程菌。
1.3.2BpBEE2植物抑制表达载体构建
植物抑制表达载体图谱如图1所示,根据此图谱进行载体构建。选择BpBEE2基因3′端的一段201 bp的特异序列,将这段序列的正义链(BEE2-1)与反义链(BEE2-2),通过来自细菌中的一段207 bp的intron连接,形成一个含有loop的发夹结构[15]。通过表2引物扩增目的片段,用限制性内切酶BamHⅠ和XbaⅠ对BEE2-1片段进行酶切;限制性内切酶SacⅠ和KpnⅠ对BEE2-2片段进行酶切;限制性内切酶BamHⅠ和KpnⅠ对intron片段进行酶切;限制性内切酶XbaⅠ和SacⅠ对pROKⅡ进行酶切。将3个片段通过T4DNA连接酶连接到pROKⅡ载体上并转入大肠杆菌感受态中,通过抗性LB培养基(50 mg·L-1卡那霉素)及PCR筛选获得阳性单菌落,送往上海英俊生物公司进行测序,送测正确的质粒通过电击转化法将重组质粒导入EHA105农杆菌感受态细中,PCR验证。
1.4 白桦遗传转化及分子检测
采用农杆菌介导法,以白桦种子为受体进行合子胚遗传转化,具体方法参见张瑞萍[16]。在选择培养基中加入卡那霉素进行选择,获得抗性株系进行二次筛选。利用CTAB法提取转基因及对照白桦总DNA,分别以其为模板进行PCR扩增,以检测目的基因是否成功导入到植物体内。
表2构建BpBEE2基因植物抑制表达载体的引物序列
Table2Primersequencesofbuildingplantinhibitingexpressionvector
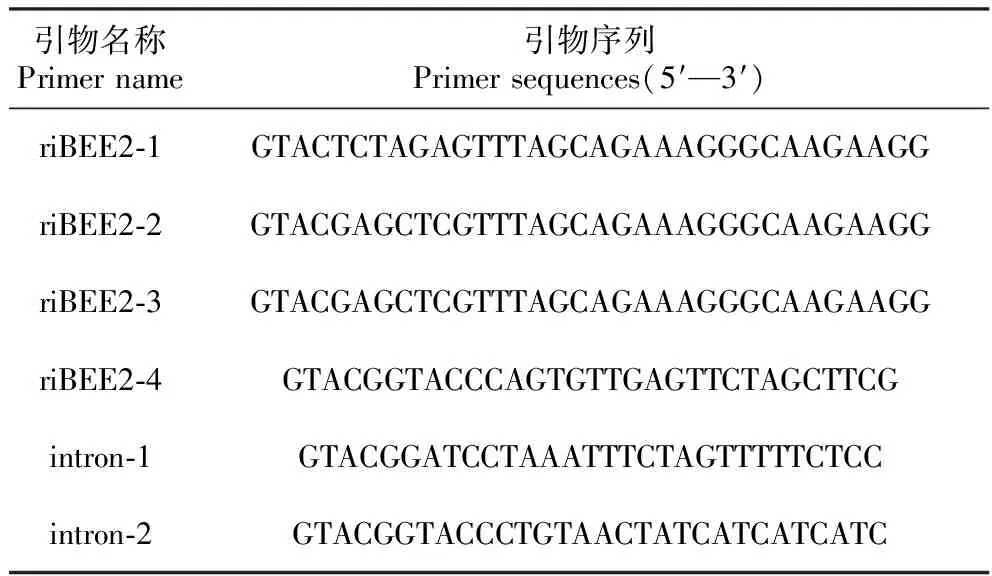
引物名称Primer name引物序列Primer sequences(5′—3′)riBEE2-1GTACTCTAGAGTTTAGCAGAAAGGGCAAGAAGGriBEE2-2GTACGAGCTCGTTTAGCAGAAAGGGCAAGAAGGriBEE2-3GTACGAGCTCGTTTAGCAGAAAGGGCAAGAAGGriBEE2-4GTACGGTACCCAGTGTTGAGTTCTAGCTTCGintron-1GTACGGATCCTAAATTTCTAGTTTTTCTCCintron-2GTACGGTACCCTGTAACTATCATCATCATC

图1 植物表达载体pROKⅡ-RNAiBpBEE2的构建图谱Fig.1 Plant expression vector constructs pROKⅡ-RNAiBpBEE2 map
1.5 转基因植株的生长量测定及抗逆分析
对获得的1个超表达株系(OE-BpBEE2)、2个抑制表达转基因株系(RNAi-BpBEE2-1和RNAi-BpBEE2-2)及非转基因对照株系进行大量扩繁,生根后移栽到土中,培养1个月后,选取每个株系中长势一致的株系30株进行苗高测定。同时对各株系长势一致的继代苗分别培养在加入0.3% NaCl、0.6% NaCl、5% PEG6000和10% PEG6000的WPM培养基中,每种处理各株系分别选取30株培养,培养30 d,称量每株植株的鲜重,计算平均值和标准误差,使用Prism 6.0进行多重分析。
2 结果与分析
2.1 BpBEE2基因的克隆
利用pBIOZOL Plant Total RNA Extraction Reagent试剂盒成功提取白桦叶片的总RNA(图2A),并反转录为cDNA。根据白桦转录组获得的BpBEE2序列[17]设计特异引物,以cDNA为模板,进行RT-PCR扩增,扩增产物克隆至pMD18-T载体中。PCR电泳检测结果显示在1 080 bp处获得特异条带(图2B)。产物送往上海生工生物工程有限公司,测序获得的序列与已知BpBEE2基因序列一致。
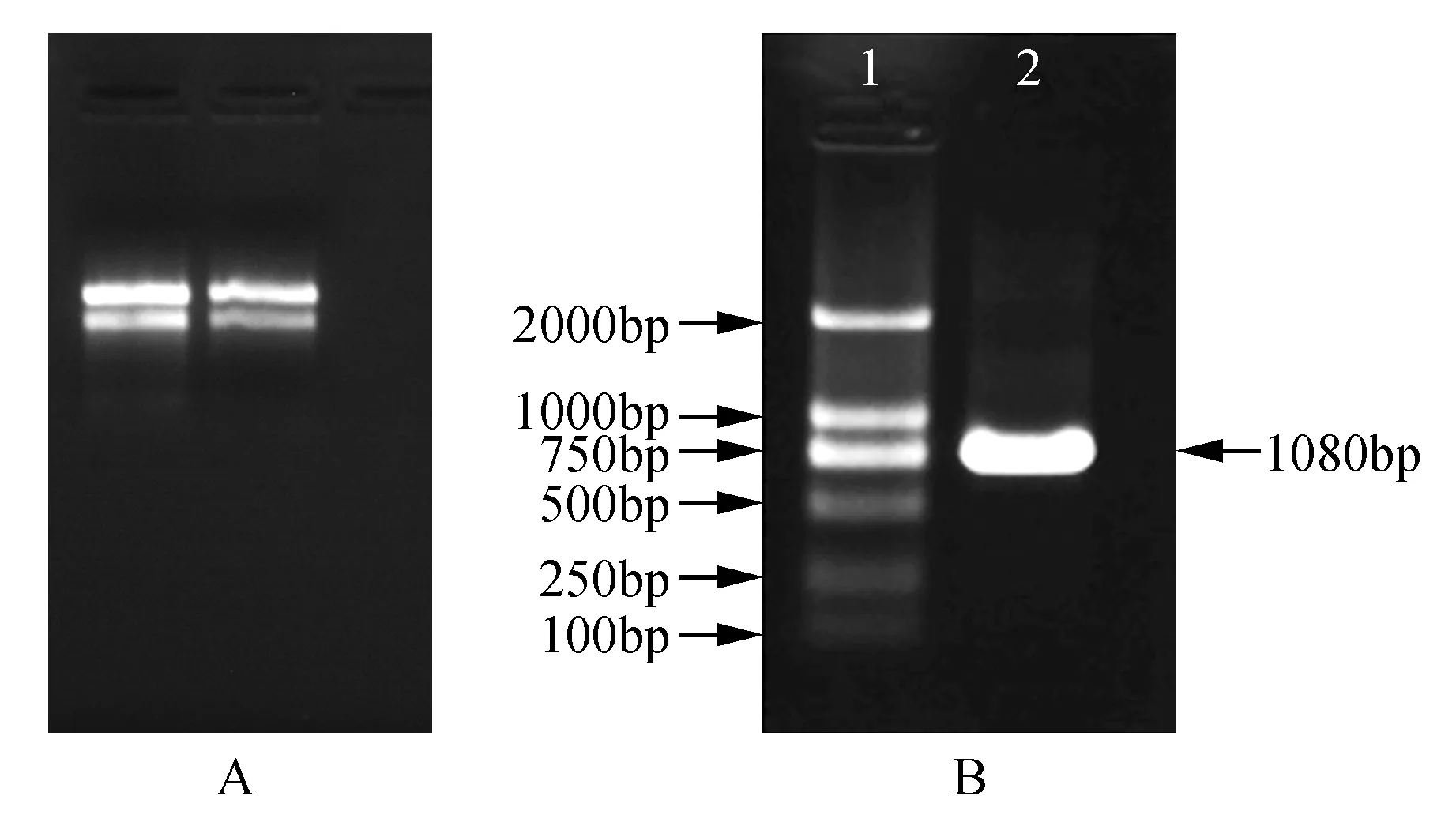
图2 白桦总RNA的提取及BpBEE2基因的克隆鉴定A.白桦总RNA;B.白桦BpBEE2基因的克隆(1.Marker DL2000;2.白桦BpBEE2PCR产物Fig.2 Birch of total RNA extraction and cloning identification of BpBEE2 gene A.Total RNA of B.platyphylla B. BpBEE2 cloning(1.Marker DL2000;2.PCR production of BpBEE2)
2.2 植物表达载体构建
2.2.1BpBEE2植物过表达载体构建
以pMD18-BpBEE2质粒为模板进行PCR扩增,扩增产物纯化后进行TOPO反应,并通过热激法转化到大肠杆菌感受态细胞中。阳性单克隆PCR检测后在1 080 bp获得目的条带(图3A)。将TOPO重组质粒与pGWB2载体连接进行LR反应,反应液转化到大肠杆菌DH5α感受态细胞中,PCR检测为阳性单克隆(图3B),通过电击法将pGWB2-BpBEE2质粒转化到农杆菌感受态中,利用特异性引物对获得的阳性单克隆进行PCR检测,在浓度为1%的琼脂糖凝胶中进行电泳检测(图3C)。结果表明,目的基因BpBEE2已成功构建到了pGWB2载体上。
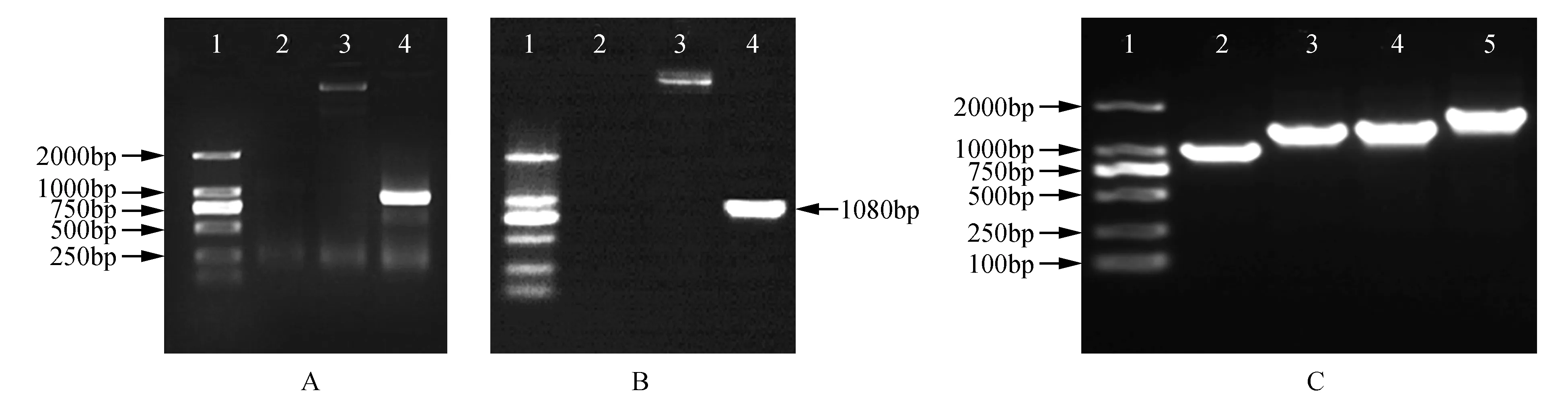
图3 植物过表达载体构建及检测 A.TOPO反应PCR检测(1.Marker DL2000;2.阴性对照;3.阳性对照;4.试样) B.LR反应PCR检测(1.Marker DL2000;2.阴性对照;3.阳性对照;4.试样) C.BpBEE2基因农杆菌引物组合PCR检测(1.Marker DL2000;2.基因引物;3.基因与载体引物;4.载体与基因引物;5.载体引物)Fig.3 Construction and identification of plant overexpression vector of BEE2 A. PCR identification of TOPO reaction(1.Marker DL2000;2.Negative control;3.Positive control;4.Samples) B. PCR identification of LR reaction(1.Marker DL2000;2.Negative control;3.Positive control;4.Samples) C. PCR identification of transformation of A.tumefaciens(1.Marker DL2000;2.Primers from gene;3.Primers from gene and vector;4.Primers from gene and vector;5.Primers from vector)
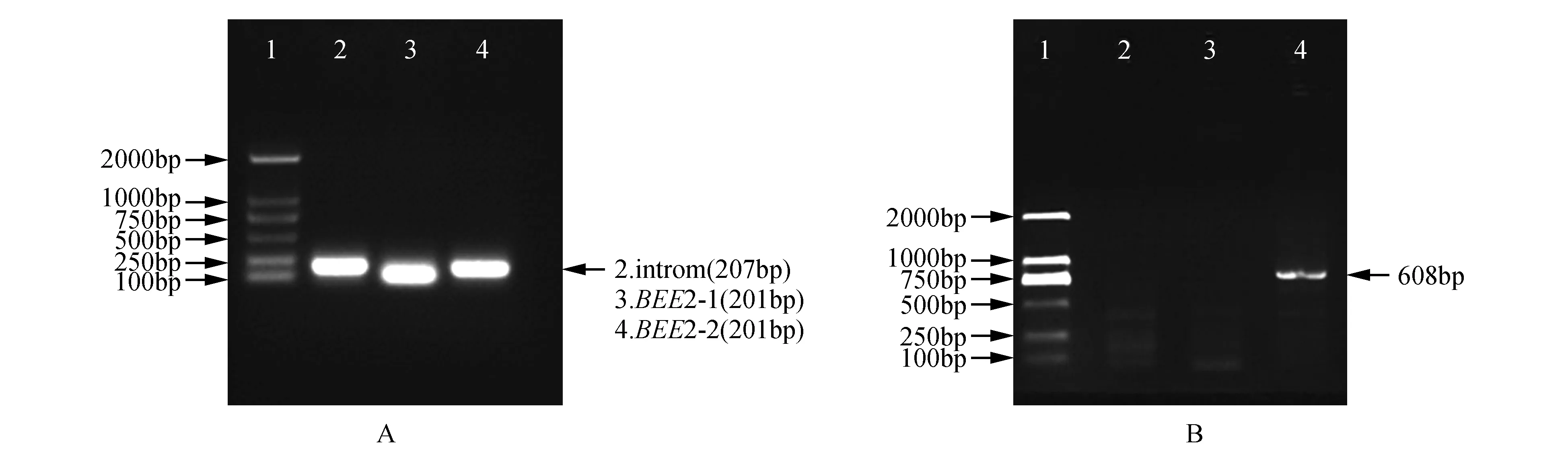
图4 植物抑制表达载体构建及检测 A.BpBEE2基因植物抑制表达载体部件的PCR扩增(1.Marker DL2000;2.Intron;3.BEE2-1;4.BEE2-2) B.BpBEE2抑制表达载体重质粒PCR(1.Marker DL2000;2.水对照;3.阴性对照;4.阳性重组质粒)Fig.4 Construction and identification of plant inhibiting expression vector of BEE2 A.PCR of vector fragments(1.Marker DL2000;2.Intron;3.BEE2-1;4.BEE2-2) B.The PCR assay for recombinant plasid(1.Marker DL2000;2.Water control;3.Negative control;4.Recombinant plasid)
2.2.2BpBEE2植物抑制表达载体构建
以pMD18-BpBEE2质粒为模板,扩增其3'端201 bp的特异序列,同时扩增细菌的207 bp intron序列(图4A),酶切连接将这3个片段形成loop结构并连接到在pROKⅡ载体的多克隆位点中。对转化大肠杆菌后获得的单克隆分别以riBEE2-1和riBEE2-3为引物进行菌液PCR检测(图4B),结果显示在608 bp处获得特异条带,并与目标条带大小一致。随后将构建成功的pROKⅡ-RNAiBpBEE2载体质粒转化入农杆菌EHA105内。
2.3 白桦遗传转化及分子检测
2.3.1 转BpBEE2基因植株的获得
用含有pROKⅡ-RNAiBpBEE2的农杆菌侵染白桦合子胚,暗培养后对其进行脱菌处理,2~3 d后,将合子胚置于选择培养基上,25 d过后可见切口处长有绿色的愈伤颗粒(图5A~B);待愈伤长到直径5 mm的大小,将其放置分化培养基上,数日后愈伤组织慢慢形成不定芽(图5C);再培养20~30 d,丛生苗生根(图5D)。最终获得过表达株系1个,命名为OE-BpBEE2-1,抑制表达株系2个,分别命名为RNAi-BpBEE2-1、RNAi-BpBEE2-2。
2.3.2 转基因株系的检测
以过表达转基因植株、抑制表达及非转基因对照白桦株系叶片DNA作为模板,采用BpBEE2基因上、载体下游引物及riBEE2-1和intron-2为引物分别对过表达株系及抑制表达株系进行PCR检测,PCR产物在1%的琼脂糖凝胶进行电泳,结果显示目的条带位置与阳性对照的位置一致(图6)。证明外源基因已成功转入白桦中。

图5 转基因植株的获得 A.抗性愈伤;B.抗性愈伤分化;C.继代苗的培养;D.生根苗的培养Fig.5 Regeneration and identification of BpBEE2 transgenic lines A.Resistant calli; B.The differentiation culture containing resistant calli; C.Transgenerational seedling cultivation; D.The cultivation of rooted plantlets
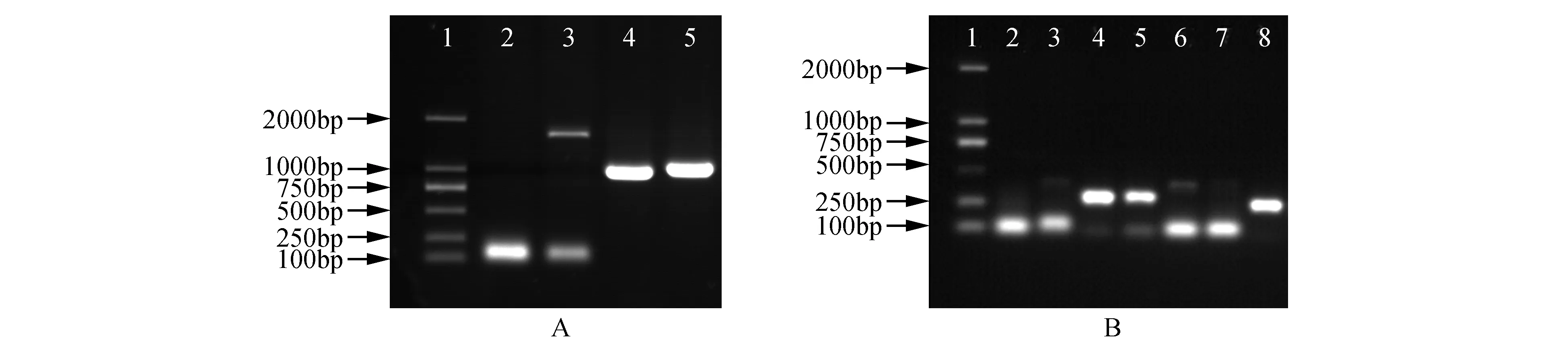
图6 转基因株系的检测 A.过表达株系PCR检测电泳图(1.Marker DL2000;2.水对照;3.NT;4.阳性对照;5.转基因株系) B.抑制表达株系PCR检测电泳图(1.Marker DL2000;2.阴性对照;3.NT;4.阳性对照;5~8.抗性株系)Fig.6 PCR amplification analysis of BpBEE2 in transgenic lines A. PCR amplification analysis of overexpression transgenic lines(1.Marker DL2000; 2.Water control; 3.Negative control(untransformed plant); 4.Positive control; 5.Transgenic line) B. PCR amplification analysis of inhibiting expression transgenic lines(1.Marker DL2000; 2.Water control; 3.Positive control; 4.Negative control(untransformed plant); 5-8.Transgenic line
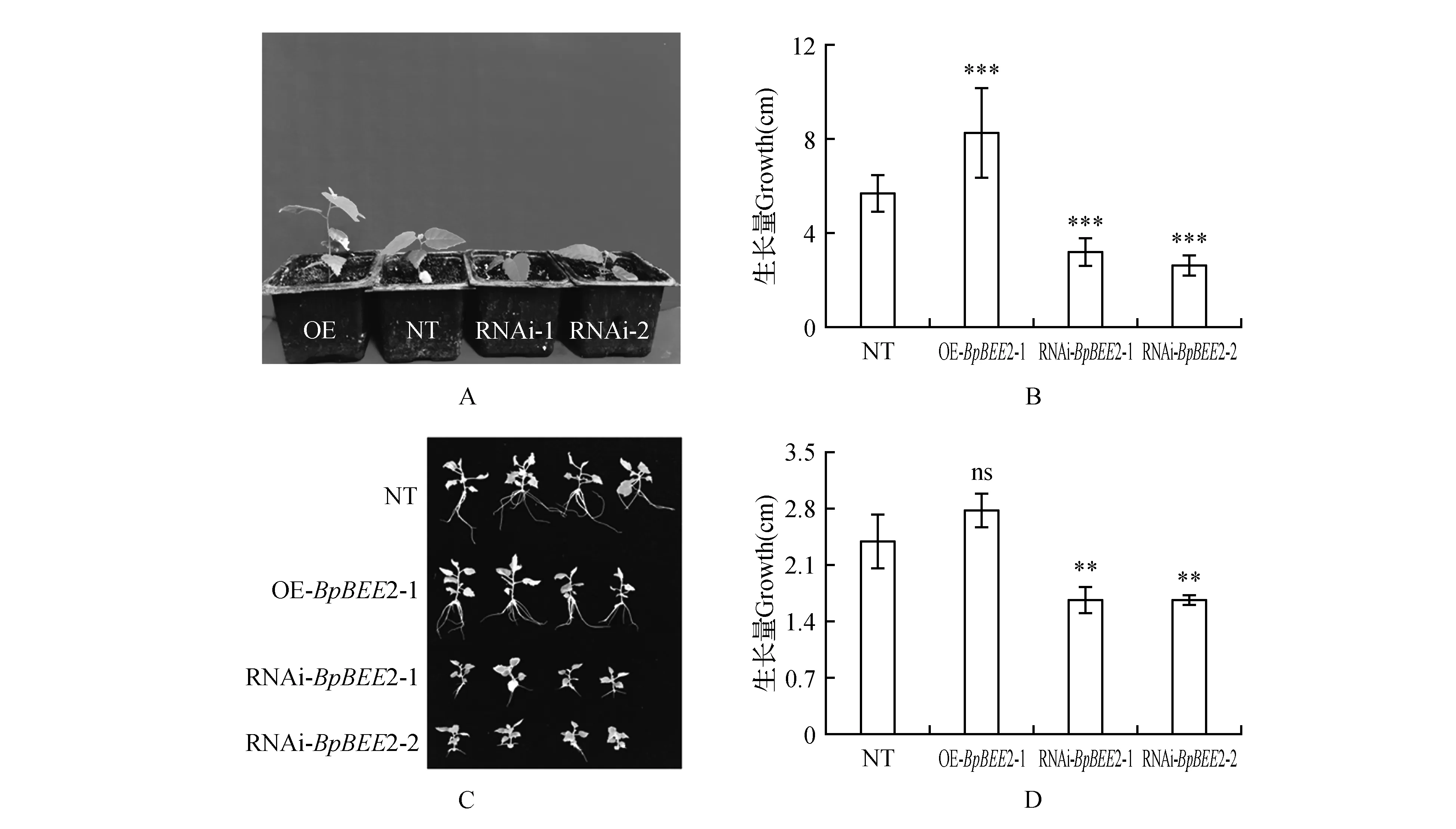
图7 苗高测定 A~B.移栽后苗高测定;C~D.组培苗苗高测定 ***P<0.001Fig.7 Seedling height of trangenetic lines and nontrangenetic line A-B.Seedling height of transplanting plantlets; C-D.Seedling height of tissue culture plantlets
2.4 转基因植株的生长量测定及抗逆分析
2.4.1 转基因株系生长量测定
对移栽后的转基因株系和培养基中培养的生根苗的苗高进行统计。结果表明:在2种基质中,转基因株系与非转基因株系的苗高均差异显著,其中过表达株系的苗高明显高于野生型,比对照株系分别提高了44.2%和16.8%(图7),而2个抑制表达株系的生长量显著低于野生型,分别比对照株系降低了43.4%和30.5%;53.9%和30.1%(图7)。
2.4.2 转基因株系盐、旱胁迫后鲜重变化情况
无处理组中,非转基因对照与过表达株系鲜重差异不显著,抑制表达株系鲜重显著低于对照株系。NaCl处理后,各株系生长量明显降低,但过表达株系的鲜重高于对照及抑制表达株系。PEG处理后,抑制表达株系在的鲜重显著低于对照及过表达株系(图8)。这表明,BpBEE2基因可能参与到盐旱胁迫途径中。
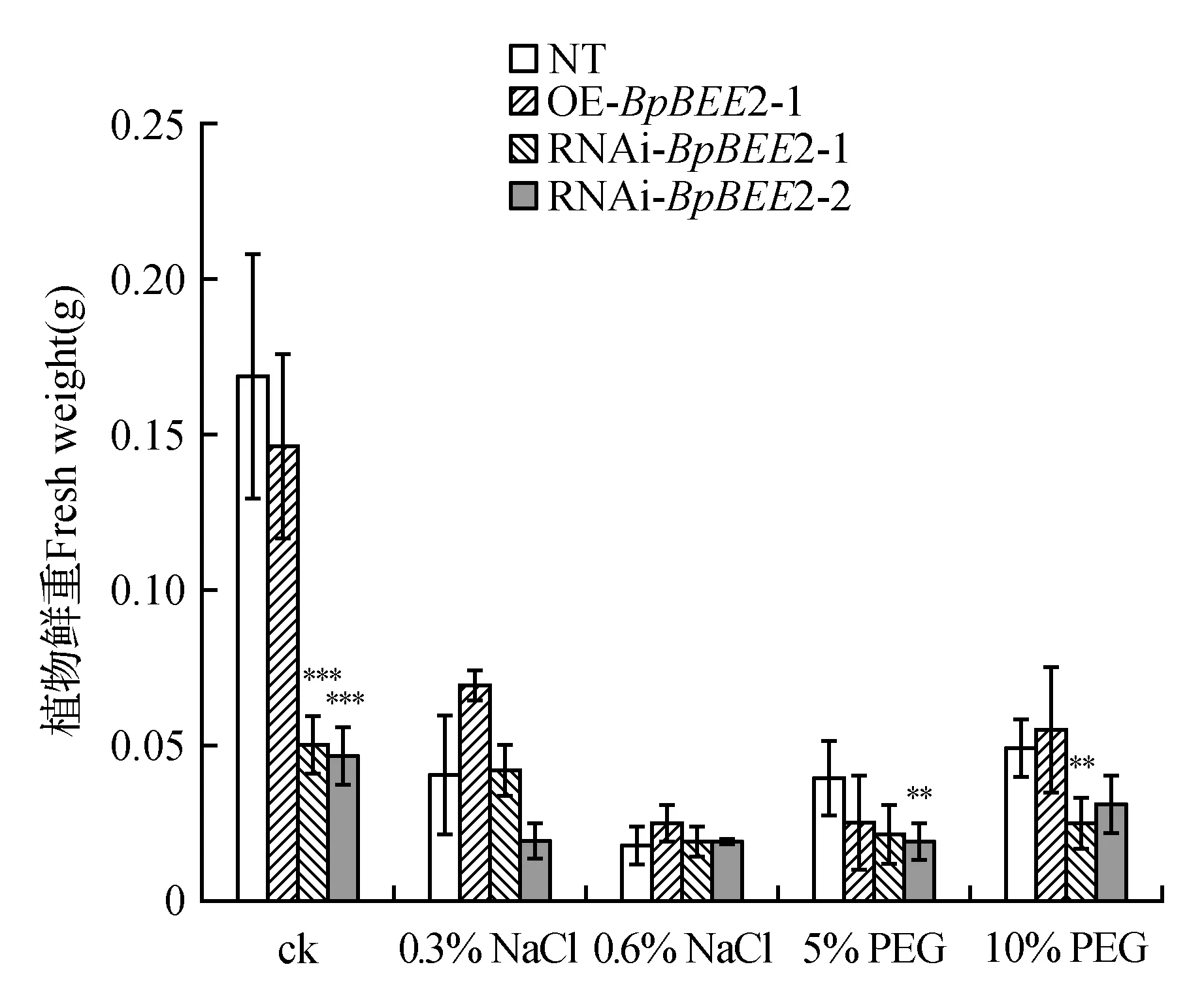
图8 转基因株系不同胁迫处理下生长量变化Fig.8 Fresh weights of trangenetic lines and nontrangenetic line under different stress processing **P<0.01;***P<0.001
3 讨论
BEE基因是编码植物所特有的bHLH转录因子,参与植物生长发育过程及非生物胁迫反应[18]。BpBEE1,BpBEE2和BpBEE3属于bHLH转录因子的第25亚类,与拟南芥中AtBEEs同源性较高[17]。已有研究报道,拟南芥第25亚类中共有17个成员,其中包括AtBEE1,AtBEE2,AtBEE3和AtCIB1基因,这些基因参与激素信号途径和器官的发育[19]。武丹阳[17]等发现,在白桦生长旺盛时期,BpBEE1、BpBEE2、BpBEE3基因在白桦顶芽、叶片等组织部位中均呈现上调表达,因此认为白桦BpBEE基因参与了植物的生长发育过程。本研究克隆了BpBEE2基因的全长序列,并构建了过表达及抑制表达载体,进行了农杆菌介导的遗传转化。对获得的BpBEE2过表达及抑制表达株系转基因株系的生长量及抗逆性进行分析,发现过表达株系的苗高高于对照株系,而抑制表达株系的苗高低于对照株系,进一步证明了BpBEE2参与了植物的生长发育过程。许思佳[20~21]等此前已对BpBEE1启动子顺式原件进行预测,发现启动子中含有一些激素响应及胁迫应答元件,并证实BpBEE参与MeJA、SA、BL和ABA应答过程。bHLH转录因子的第25亚类基因除了参与BR途径外,还参与ABA等激素途径[22]。拟南芥中发现的bHLH92转录因子,受盐、干旱、渗透、冷等多种胁迫的强烈诱导,过量表达bHLH92基因则表现出较强的抗盐胁迫的能力[6]。Zhou等[21]克隆了OrbHLH2基因,在拟南芥中过表达OrbHLH2能够增强转基因植株的耐盐性及渗透胁迫抗性。本研究发现BpBEE2基因对盐、旱胁迫后白桦的鲜重产生了影响,并且改善了植物的抗旱、耐盐性。BpBEE2如何通过如何调控植株的生长及参与抗旱耐盐胁迫应答还需要进一步深入研究。

