重组蔗糖异构酶在短短芽孢杆菌中的表达及发酵优化
邹 亮 ,吴 敬 ,陈 晟 *
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江南大学 教育部食品安全国际合作联合实验室,江苏 无锡 214122)
蔗糖异构酶 (EC5.4.99.11,Sucrose isomerase,SIase)能以蔗糖为底物生成异麦芽酮糖(6-O-α-D-吡喃葡糖基-D-果糖,isomaltulose)和海藻酮糖(1-O-α-D-吡喃葡糖基-D-果糖,trehalulose), 属于糖苷水解酶13家族[1]。异麦芽酮糖在自然界中较少,主要存在于蜂蜜、甘蔗汁中,与蔗糖属于同分异构体,有着相似的物理性质和特殊生理功能[2-5],可以作为一种新型的食品添加剂应用于面包、饮料、糖果等食品中。目前,异麦芽酮糖的工业化生产主要通过蔗糖异构酶转化蔗糖获得。据文献报道,来源于大黄欧文菌属Erwinia rhapontici[6]、沙雷氏杆菌Serratia plymuthica[7-8]、肠杆菌属(Enterobactersp)[9]、克雷伯氏菌属 (Klebsiellasp)[10-11]、 分散泛菌属(Pantoea dispersa)[12-13]等菌属的蔗糖异构酶都已成功进行了异源表达,但由于表达量较低,仍无法满足市场需求。
短短芽孢杆菌(Brevibacillus choshinensis)与枯草芽孢杆菌(Bacillus subtilis)都属于革兰氏阳性菌,其细胞壁不含内毒素,是非致病安全菌株,可以应用于食品工业。由于其在芽孢杆菌属中具有优良的分泌功能,因而广泛用于异源蛋白的表达,包括普鲁兰酶、α-淀粉酶、抗原片段、生长因子[14-16]等。目前短短芽孢杆菌主要通过穿梭载体pNCMO2表达胞外酶,穿梭载体pNCMO2上的P2启动子是6种生理性外壁蛋白启动子中的一种强启动子,贯穿整个细胞生长时期,它是一种未知类型的启动子,并可能参与外壁蛋白的合成与分泌,同时也控制着外源蛋白的表达。
作者以实验室前期构建的重组菌Brevibacillus choshinensis/pNCMO2-SI为基础,进行了摇瓶和发酵罐的条件优化。另外构建了不同类型启动子的重组短短芽孢杆菌工程菌以探索启动子对蔗糖异构酶胞外表达的影响,在此基础上进一步进行了摇瓶和3 L发酵罐条件优化。这些研究对工业化生产蔗糖异构酶有一定研究意义,同时也为短短芽孢杆菌表达其他异源蛋白提供了理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 大肠杆菌 (Escherichia coliJM109)、枯草芽孢杆菌 (Bacillus subtilisCCTCC NO:M2016536)和重组菌Brevibacillus choshinenssi/pNCMO2-SI、含有巨大芽孢杆菌Bacillus megaterium木糖诱导型启动子Pxyl/Bm的质粒pSEVB:作者所在实验室保藏;短短芽孢杆菌(Brevibacillus choshinensis)与穿梭质粒 pNCMO2:购于宝生物生物工程有限公司。穿梭质粒pNapr-SI、pNnpr-SI、pNamy-SI、pNxyl-SI:作者所在实验室构建。
1.1.2 主要试剂 限制性内切酶(NdeⅠ、HindⅢ、PstⅠ等)、DNA 聚合酶 Primer Star、DNA marker :购于宝生物生物工程有限公司;蛋白胶试剂盒与蛋白分子质量标准:购于碧云天技术研究所;质粒小提试剂盒、普通DNA产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒:购于北京天根生化科技有限公司;其他试剂为进口或国产分析纯级。
1.1.3 主要仪器 UVP凝胶成像仪:美国Bio-Rad公司产品;DYY-6C型凝胶电泳仪:北京六一仪器有限公司产品;安捷伦1200型高效液相色谱仪:美国Agilent公司产品;BECKMAN COULTER高速离心机:美国贝克曼库尔特有限公司产品;SBA-40C生物传感分析仪:山东省科学院生物研究所产品;3 L全自动NBS发酵罐:美国NBS公司产品。
1.1.4 培养基 LB液体培养基(g/L):蛋白胨 10,酵母粉 5,NaCl 10;LB 固体培养基(g/L):在 LB 液体培养基的基础上,加入1.8 g/dL的琼脂;TM液体培养基(g/L):多聚蛋白胨 10,牛肉粉 5,分子级酵母粉 2,葡萄糖(单独灭菌)10,微量元素液(10 mL/L);TM固体培养基(g/L):在TM液体培养基的基础上,加入1.8 g/dL的琼脂;电转培养基SHC溶液(g/L):甘油 150,蔗糖 100,HEPES 3.82,CaCl20.11;3 L 罐发酵培养基(g/L):多聚蛋白胨 8.5,牛肉浸膏 8.5,(NH4)2HPO40.5,KH2PO41,葡萄糖(单独灭菌);微量元素液10 mL/L;补料培养基(g/L):葡萄糖100;微量元素液 (g/L):FeSO4·7H2O 1.0 ,MnSO4·4H2O 1.0 ,ZnSO4·7H2O 0.1。
葡萄糖在115℃下,灭菌15 min,其他培养基均为121℃,灭菌15 min。另外根据具体情况,添加不同的抗生素:100 mg/L的氨苄青霉素或10 mg/L的硫酸新霉素。
1.2 方法
1.2.1 摇瓶培养 种子培养:从甘油管中以体积分数2%接种体积分数接种到装液量为10 mL TM培养基的三角瓶中,加入终质量浓度为30 mg/L的硫酸新霉素,在37℃、200 r/min条件下培养12~14 h。
摇瓶发酵:从种子液中吸取2.5 mL接种到装液量为50 mL TM培养基的三角瓶中,加入终质量浓度为10 mg/L的硫酸新霉素,在30℃、200 r/min条件下培养48 h。待发酵完成后,将菌液离心并收集上清液,上清即为蔗糖异构酶粗酶液。
1.2.2 重组菌在3 L发酵罐的发酵培养 将培养好的种子液按照10%的接种体积分数,接种到装有1 L发酵培养基的3 L NBS发酵罐中,同时加入质量浓度为10 g/L葡萄糖和10 μg/mL新霉素。在温度为30℃,搅拌转速200 r/min条件下进行恒温发酵。用2 mol/L硫酸和5 mol/L NaOH溶液调节pH 7.0,及时测罐内残糖,当残糖质量浓度低于5 g/L时,开始流加葡萄糖,使其维持在恒定值。将搅拌转速(300~700 r/min)与空气流量(1~3 L/min)耦联,使罐内溶氧维持在30%。
1.2.3 带有不同启动子重组质粒的构建 以质粒pNapr-SI构建为例,先以质粒pNCMO2-SI为模板,用引物pNC-F/pNC-R进行去除P2启动子的基因片段,再以枯草芽孢杆菌B.subtilisCCTCC NO:M2016536基因组为模板,用引物Apr-F/Apr-R菌落PCR克隆出启动子Apr-E基因片段,分别进行胶回收及纯化后,进行酶连操作,转化到大肠杆菌JM109中,在氨苄抗性平板上进行筛选,挑单菌落到LB培养基中培养,提质粒酶切验证后送测序,与NCBI数据库中Apr-E启动子序列进行比对,若无误则表示质粒pNapr-SI构建成功。其他重组质粒的构建过程类似。构建重组质粒所需引物见表1。

表1 引物Table 1 Primers’sequence
1.2.4 重组质粒转化短短芽孢杆菌
1)感受态的制备 感受态细胞在TM培养基中37℃,200 r/min过夜培养,稀释40倍后再在TM培养基中37℃200 r/min培养4~5 h,分装至50 mL离心管在冰上冷却10 min,在4℃、5 000 r/min条件下离心10 min,倒掉上清液。吸取SHC缓冲液轻轻吹吸菌液,在4℃、5 000 r/min条件下离心5 min,重复3~4次后加入体积比为1∶20的SHC缓冲液重悬浮菌体,每个EP管分装200 μL菌液。
2)电转 将上一步制备好的感受态细胞放入1 mm 电击杯中,加入 10 μL 重组质粒(100 ng/μL)和100 μL质量分数15%PEG6000,冰上放置10 min后用一个单一的电脉冲场强为21 kV/cm进行电击,电击完成后迅速加入TM培养基,并在37℃、200 r/min摇床中培养2 h,在3 000 r/min条件下离心5 min,留100 μL菌液涂布于10 mg/L的硫酸新霉素的TM固体培养基中,过夜倒置培养。
1.2.5 重组菌的摇瓶发酵优化
1)氮源对不同启动子重组菌的影响 在TM培养基培养条件的基础上,分别选取鱼粉蛋白胨、工业蛋白胨、酵母浸膏、牛肉浸膏、安琪酵母粉为氮源(17 g/L),以葡萄糖为碳源,进行摇瓶发酵。
2)表面活性剂对不同启动子重组菌的影响分别在培养基中加入质量分数0.1%TWEEN20和2%PEG4000,进行摇瓶发酵。
1.2.6 细胞干重的测定 取5 mL发酵液,高速离心后弃上清,用生理盐水洗涤两遍后烘干称重,得到菌体细胞干重(DCW),单位为g/L。
1.2.7 蛋白质质量分数的测定 采用Bradford法测蛋白质质量分数,标准曲线用牛血清蛋白测定。
1.2.8 发酵罐内残糖的测定 采用SBA-40C生物传感分析仪测定发酵罐内葡萄糖质量浓度。点击“开始”清洗管路,用取样针吸取25 μL标准样品,待绿灯常亮后表示校准成功。将待测样品稀释到合适范围后准确吸取25 μL打入进样口,读取数值。
1.2.9 发酵液中蔗糖异构酶SDS-PAGE电泳 将发酵液在12 000 r/min,10 min离心处理后,弃沉淀,留上清。取发酵上清20 μL,加入5μL蛋白加样缓冲液,煮沸处理10 min(同时处理蛋白分子marker)。参照聚丙烯酰胺凝胶电泳试剂盒配制蛋白胶,分别取8 μL发酵上清和蛋白分子marker上样。电泳结束后,用考马斯亮蓝R-250染色处理,多次脱色待电泳条带清晰可见后在凝胶成像仪中观看。
1.2.10 蔗糖异构酶酶活的测定 用50 mmol/L、pH 6.0的Na2HPO4-柠檬酸缓冲液将待测样品稀释到一定倍数后,吸取100 μL稀释后的酶液到终质量浓度为200 g/L蔗糖的上述缓冲液中。立即用旋涡振荡仪混匀后,在30℃恒温水浴锅中反应15 min,煮沸10 min灭酶。采用HPLC示差检测器检测样品含量,其中包括底物蔗糖,产物异麦芽酮糖,副产物海藻酮糖、葡萄糖、果糖。
酶活单位(U)定义:在30℃,pH 6.0条件下,每分钟转化蔗糖生成1 μmol异麦芽酮糖所需要的酶量定义为1 U。
2 结果与讨论
2.1 重组菌Brevibacillus choshinensis/pNCMO2-SI产蔗糖异构酶的研究
2.1.1 重组蔗糖异构酶的摇瓶发酵 实验室前期将来源于Pantoea dispersa的蔗糖异构酶基因与穿梭载体pNCMO2连接,构建了重组菌Brevibacilluschoshinensis/pNCMO2-SI。从-80℃保藏的甘油管中以2%体积分数接种,将重组菌接种到加有新霉素的TM培养基中,37℃,200 r/min条件下将种子扩大培养12 h,以5%的接种体积分数接种到优化TM培养基中,30℃,200 r/min条件下培养培养48 h后,用高速离心机离心,上清即为蔗糖异构酶粗酶液,稀释相应倍数后测得胞外上清酶活为50 U/mL。蔗糖异构酶发酵上清经过SDS-PAGE凝胶电泳显示如图1。

图1 重组菌Brevibacillus choshinensis/pNCMO2-SI在TM培养基中表达Fig.1 Production ofSIaseby recombinantstrain Brevibacillus choshinensis/pNCMO2-SI in TM medium
2.1.2 重组蔗糖异构酶的发酵罐条件优化 在实验室前期基础上确立了重组菌3 L发酵罐初始发酵条件为初始碳源10 g/L葡萄糖,初始氮源多聚蛋白胨、牛肉浸膏各8.5 g/L,30℃恒温发酵的发酵工艺,初始pH为7.0,配制2 mol/L H2SO4和5 mol/L NaOH自动调节pH,整个发酵过程罐内溶氧控制在体积分数30%,通过控制通气量和纯氧使其达到以上水准。依次分别对上罐时初始碳源质量浓度,初始氮源质量浓度以及发酵温度进行优化。
1)初始碳源对重组菌生长及产酶的影响 重组菌在不同初始葡萄糖质量浓度时,其生长与产酶受到很大影响。碳源质量浓度对重组菌产酶影响见图2。相较于其他碳源质量浓度,添加10 g/L葡萄糖时,酶活达到185 U/mL。碳源质量浓度对重组菌生长情况影响如图3所示,初始碳源质量浓度越高时,重组菌生长得越好,但酶活并未随着菌体增长而线性增长。由此选择添加10 g/L葡萄糖作为初始碳源时最为合适。
2)初始氮源对重组菌生长及产酶的影响 不同初始氮源质量浓度对重组菌产酶影响见图4。相较于其他氮源质量浓度,添加30 g/L的初始氮源(多聚蛋白胨与牛肉浸膏各15 g/L)时酶活为260 U/mL。氮源质量浓度对菌体生长情况影响见图5。在发酵前期,初始氮源质量浓度越高,菌体生长得更快。由此选择添加30 g/L初始氮源最为合适。

图2 初始碳源对重组菌产酶的影响Fig.2 Effects ofinitialcarbon sources on SIase production of recombinant strains
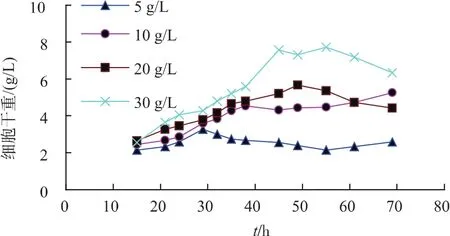
图3 初始碳源对重组菌生长的影响Fig.3 Effects of initial carbon sources on the growth of recombinant strains
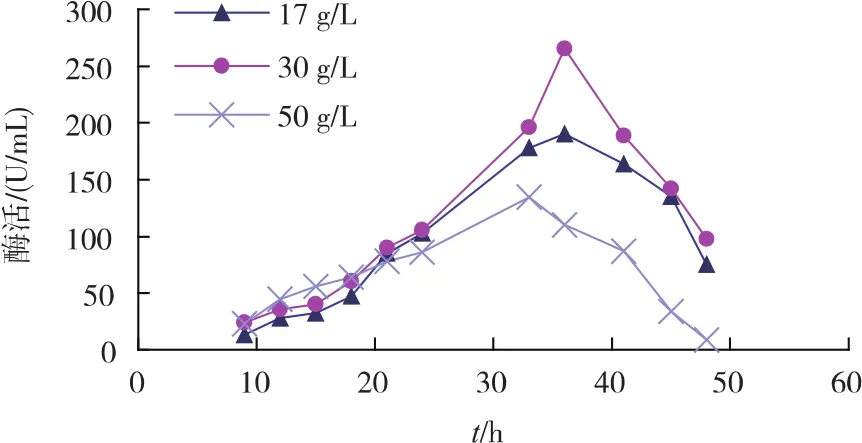
图4 初始氮源对重组菌产酶的影响Fig.4 Effectsofinitialnitrogen sourceson SIase production of recombinant strains
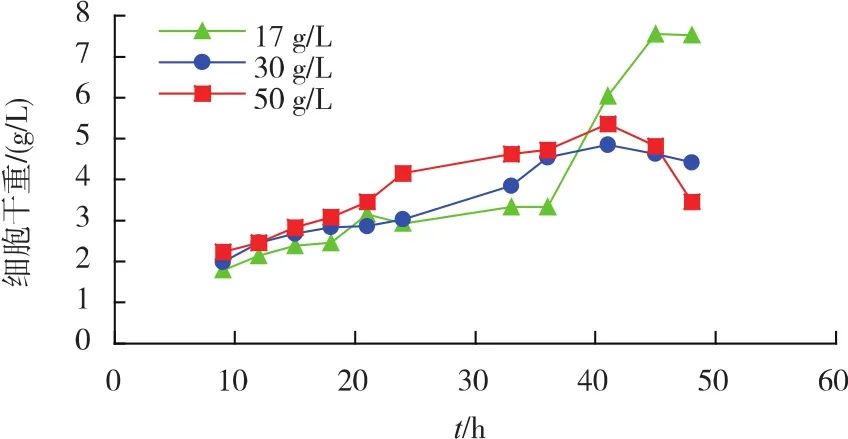
图5 初始氮源对重组菌生长的影响Fig.5 Effects of initial nitrogen sources on the growth of recombinant strains
3)发酵温度对重组菌生长及产酶的影响 不同发酵温度对重组菌产酶影响见图6。从图中可以看出,恒温30℃发酵时酶活为275 U/mL,明显高于其他温度。不同发酵温度对重组菌生长情况影响见图7。发酵温度过高或过低时,未达到菌株的最佳产酶温度,因而酶活较低。由此选择30℃恒温发酵最为合适。
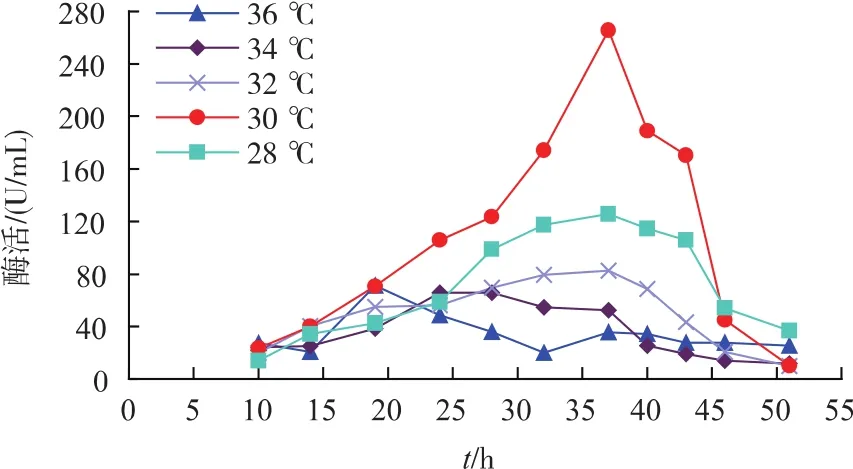
图6 发酵温度对重组菌产酶的影响Fig.6 Effects of fermentation temperature on SIase production of recombinant strains

图7 发酵温度对重组菌生长的影响Fig.7 Effects of fermentation temperature on the growthof recombinant strains
2.2 不同启动子重组菌株的构建、表达与发酵优化
2.2.1 不同启动子的筛选 不同启动子对异源蛋白的表达效果不一,因而筛选启动子尤为重要。目前,在短短芽孢杆菌为宿主的表达系统中,国内外主要使用来源于短短芽孢杆菌自身的启动子,而较少研究其他来源的启动子。作者选取了来源于枯草芽孢杆菌的组成型启动子Papr-E,Pnpr-E,Pamy以及来源于巨大芽孢杆菌的诱导型启动子Pxyl。构建不同启动子的重组质粒分别为pNapr-SI、pNnpr-SI、pNamy-SI、pNxyl-SI, 分别转化进短短芽孢杆菌后命名为 BCpNapr-SI、BCpNnpr-SI、BCpNamy-SI、BCpNxyl-SI。经过TM培养基发酵48 h后,离心取胞外上清稀释一定倍数测得酶活如图8所示。
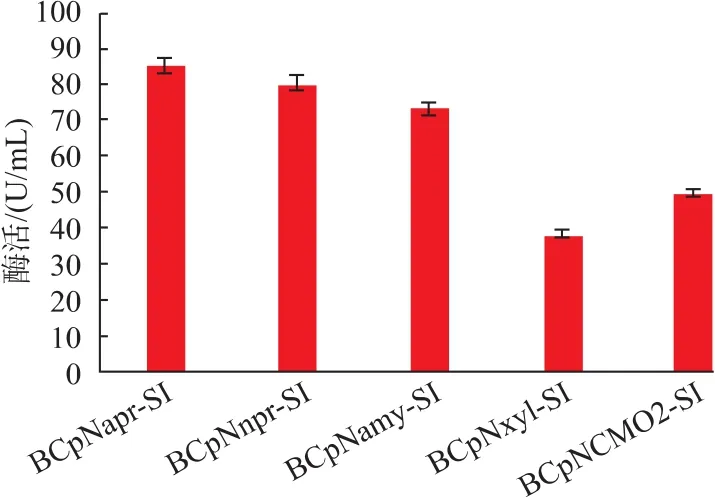
图8 重组菌株在TM培养基中的发酵情况Fig.8 Fermentation conditions of recombinant strains in TM medium
通过图可以看出,组成型启动子(Papr、Pnpr、Pamy)表达量明显高于诱导型启动子(Pxyl),其中,重组菌株BCpNapr-SI所测酶活最高,为85.1 U/mL,高于其他启动子表达量。
2.2.2 重组菌株摇瓶培养条件优化 为进一步提高上述菌株的产酶能力,作者对其培养条件进行优化,前期研究表明碳源为10 g/L葡萄糖效果较好,在此基础上本实验主要对不同重组菌株的氮源和添加剂进行了优化。
不同氮源对重组菌摇瓶发酵结果影响见图9。从图中可以看出,氮源为鱼粉蛋白胨或牛肉浸膏时, 重组菌株 BCpNapr-SI、BCpNamy-SI、BCpNxyl-SI的酶活较高;氮源为牛肉浸膏或安琪酵母粉时,重组菌株BCpNnpr-SI的酶活较高。其中氮源为鱼粉蛋白胨时,重组菌株BCpNapr-SI的酶活最高,为127 U/mL,高于其他重组菌株。
添加剂对不同重组菌株发酵结果影响见图10。通过图可以看出,TWEEN 20对不同重组菌的表达都有明显的促进作用,其中对重组菌BCpNapr-SI的提高最为显著,酶活为137 U/mL究其原因可能是TWEEN 20降低了目的蛋白与细胞膜之间的相互作用[20]。PEG4000对重组菌的表达效果不显著。

图9 氮源对不同重组菌株发酵结果的影响Fig.9 Effects of nitrogen sources on the fermentation conditions of recombinant strains

图10 添加剂对不同重组菌发酵结果的影响Fig.10 Effects of additives on the fermentation conditions of recombinant strains
2.3 重组菌BCpNapr-SI 3 L发酵罐分析
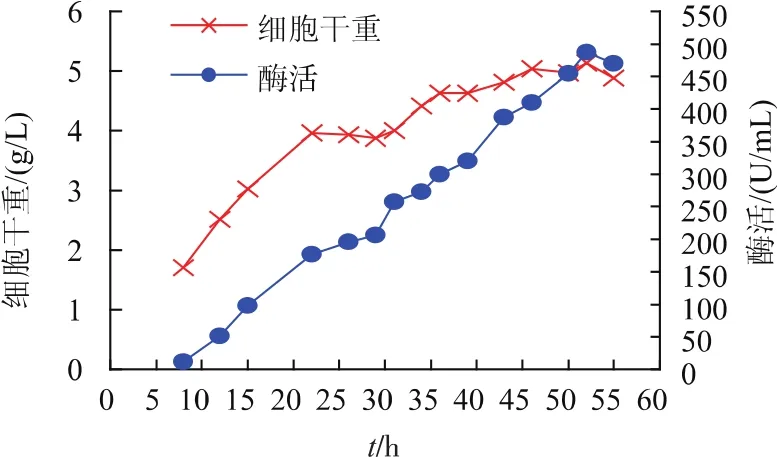
图11 重组菌株BCpNapr-SI在3 L发酵罐中产蔗糖异构酶发酵结果Fig.1 Production of SIase in the recombinant strain BCpNapr-SI by fed-batch fermentation in a 3 L fermenter
通过摇瓶优化培养基后,在3 L发酵罐中进行放大试验分析。其发酵结果见图11。图中可以看出,重组菌在发酵20 h后进入稳定期,在发酵30 h后仍有缓慢的增长。随着重组菌的生长,酶活亦随之增长,酶活最高点出现在52 h处,为485.5 U/mL,是未优化摇瓶酶活的5.7倍,是重组菌pNCMO2-SI上罐优化后酶活的1.76倍。
3 结 语
在3 L发酵罐水平下进行了初始碳源、初始氮源、温度的优化,优化后胞外酶活为275 U/mL。
为进一步研究不同启动子对蔗糖异构酶表达的影响,选取了来源于枯草芽孢杆菌的组成型启动子Papr-E、Pnpr-E、Pamy以及来源于巨大芽孢杆菌中的诱导型启动子Pxyl,构建不同类型的重组菌后进行了摇瓶优化。用优化后的条件对重组菌BCpNapr-SI进行3 L发酵罐分析,在52 h时,胞外酶活最高,为485.5 U/mL。

